Exubera για τη θεραπεία του διαβήτη
Εμπορικό σήμα: Exubera
Γενικό όνομα: ανθρώπινη ινσουλίνη
Μορφή δοσολογίας: σκόνη εισπνοής
Περιεχόμενα:
Περιγραφή
Κλινική Φαρμακολογία
Κλινικές μελέτες
Ενδείξεις και χρήση
Αντενδείξεις
Προειδοποιήσεις
Προφυλάξεις
Αλληλεπιδράσεις με άλλα φάρμακα
Ανεπιθύμητες ενέργειες
Υπερδοσολογία
Δοσολογία και χορήγηση
Πώς παρέχεται
Exubera, ανθρώπινη ινσουλίνη [rDNA προέλευση] Πληροφορίες για τον ασθενή (στην απλή αγγλική γλώσσα)
Περιγραφή
Exubera® αποτελείται από κυψέλες που περιέχουν σκόνη εισπνοής ανθρώπινης ινσουλίνης, οι οποίες χορηγούνται χρησιμοποιώντας το Exubera® Εισπνευστήρ. Τα κυψέλες Exubera περιέχουν ανθρώπινη ινσουλίνη που παράγεται με τεχνολογία ανασυνδυασμένου DNA χρησιμοποιώντας μη παθογόνο εργαστηριακό στέλεχος Escherichia coli (K12). Χημικά, η ανθρώπινη ινσουλίνη έχει τον εμπειρικό τύπο C257H383Ν65Ο77μικρό6 και μοριακό βάρος 5808. Η ανθρώπινη ινσουλίνη έχει την ακόλουθη πρωτοταγή αλληλουχία αμινοξέων:
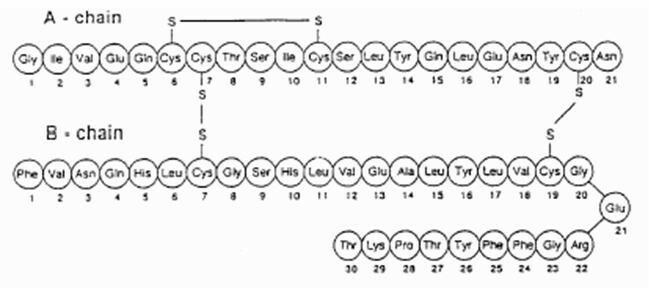
Exubera (ανθρώπινη ινσουλίνη [rDNA προέλευσης]) Η σκόνη εισπνοής είναι μία λευκή έως υπόλευκη σκόνη σε μια κυψέλη μονάδας δόσης (μάζα πλήρωσης, βλέπε Πίνακα 1). Κάθε κυψέλη μοναδιαίας δόσης του Exubera περιέχει μια δόση ινσουλίνης 1 mg ή 3 mg (βλ. Πίνακα 1) σε ένα ομογενής σύνθεση σε σκόνη που περιέχει κιτρικό νάτριο (διένυδρο), μαννιτόλη, γλυκίνη και νάτριο υδροξείδιο. Αφού εισαχθεί μια κυψέλη Exubera στην συσκευή εισπνοής, ο ασθενής αντλεί τη λαβή της συσκευής εισπνοής και στη συνέχεια πιέζει ένα κουμπί, προκαλώντας διάτρηση της κυψέλης. Η σκόνη εισπνοής ινσουλίνης στη συνέχεια διασκορπίζεται εντός του θαλάμου, επιτρέποντας στον ασθενή να εισπνεύσει την αεροζόλ σκόνη.
Υπό τυποποιημένες in vitro συνθήκες δοκιμής, το Exubera χορηγεί μια ειδική δόση εκπεμπόμενης ινσουλίνης από το επιστόμιο της συσκευής εισπνοής (βλ. Πίνακα 1). Ένα κλάσμα της συνολικής μάζας σωματιδίων εκπέμπεται ως λεπτά σωματίδια ικανά να φθάσουν στον βαθύ πνεύμονα. Μέχρι και 45% των περιεχομένων κυψελίδων 1 mg και μέχρι 25% των περιεχομένων κυψελίδων των 3 mg, μπορούν να διατηρηθούν στην κυψέλη.
Πίνακας 1: Ονοματολογία και πληροφορίες δόσης
| Γεμίστε τη μάζα (mg σκόνης) |
Ονομαστική δόση (mg ινσουλίνης) |
Εκπεμπόμενη δόση*,†(mg ινσουλίνης) |
Λεπτή δόση σωματιδίωνντο,†(mg ινσουλίνης) |
|---|---|---|---|
| |||
| 1.7 | 1.0 | 0.53 | 0.4 |
| 5.1 | 3.0 | 2.03 | 1.0 |
Η πραγματική ποσότητα ινσουλίνης που χορηγείται στον πνεύμονα θα εξαρτάται από μεμονωμένους παράγοντες ασθενούς, όπως το προφίλ εισπνευστικής ροής. In vitro, οι εκπεμπόμενες μετρήσεις αερολύματος δεν επηρεάζονται σε ρυθμούς ροής άνω των 10 L / λεπτό.
μπλουζα
Κλινική Φαρμακολογία
Μηχανισμός δράσης
Η κύρια δραστηριότητα της ινσουλίνης είναι η ρύθμιση του μεταβολισμού της γλυκόζης. Η ινσουλίνη μειώνει τις συγκεντρώσεις γλυκόζης στο αίμα διεγείροντας την περιφερική πρόσληψη γλυκόζης από τους σκελετικούς μύες και το λίπος και αναστέλλοντας την παραγωγή ηπατικής γλυκόζης. Η ινσουλίνη αναστέλλει τη λιπόλυση στα λιποκύτταρα, αναστέλλει την πρωτεόλυση και ενισχύει τη σύνθεση πρωτεϊνών.
Φαρμακοκινητική
Απορρόφηση
Το Exubera χορηγεί ινσουλίνη με από του στόματος εισπνοή. Η ινσουλίνη απορροφάται τόσο γρήγορα όσο τα υποδόρια χορηγούμενα ανάλογα ινσουλίνης ταχείας δράσης και ταχύτερα από το υποδόρια χορηγούμενη τακτική ανθρώπινη ινσουλίνη σε υγιή άτομα και σε ασθενείς με διαβήτη τύπου 1 ή τύπου 2 (βλ Φιγούρα 1).
Φιγούρα 1: Μέσες μεταβολές στις συγκεντρώσεις ελεύθερης ινσουλίνης στον ορό (μU / mL) σε ασθενείς με διαβήτη τύπου 2 που ακολουθούν Χορήγηση μοναδικών δόσεων εισπνεόμενης ινσουλίνης από Exubera (6 mg) και υποδόρια κανονική ανθρώπινη ινσουλίνη (18U)
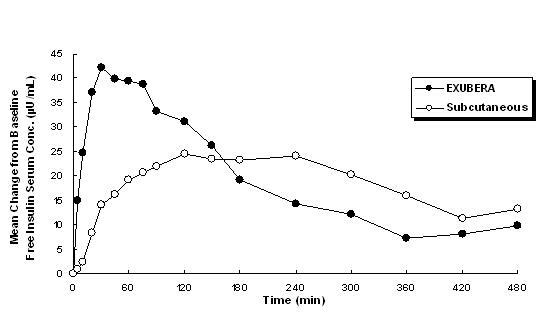
Σε κλινικές μελέτες σε ασθενείς με διαβήτη τύπου 1 και τύπου 2, μετά από εισπνοή του Exubera, η ινσουλίνη στον ορό έφτασε σε μέγιστη συγκέντρωση μετά από υποδόρια ένεση κανονικής ανθρώπινης ινσουλίνης, 49 λεπτά (εύρος 30 έως 90 λεπτά) σε σύγκριση με 105 λεπτά (εύρος 60 έως 240 λεπτά), αντίστοιχα.
Σε κλινικές μελέτες, η απορρόφηση της υποδόριας κανονικής ανθρώπινης ινσουλίνης μειώθηκε με τον αυξανόμενο δείκτη μάζας σώματος του ασθενούς (ΔΜΣ). Ωστόσο, η απορρόφηση της ινσουλίνης μετά την εισπνοή του Exubera ήταν ανεξάρτητη από το BMI.
Σε μια μελέτη σε υγιή άτομα, η έκθεση σε συστηματική ινσουλίνη (AUC και Cmax) μετά τη χορήγηση της Το Exubera αυξήθηκε με δόση που κυμαίνεται από 1 έως 6 mg όταν χορηγείται ως συνδυασμοί 1 και 3 mg κυψέλες.
Σε μια μελέτη όπου η μορφή δοσολογίας τριών κυψελίδων 1 mg συγκρίθηκε με μία κυψέλη των 3 mg, η Cmax και η AUC μετά τη χορήγηση τρεις κυψέλες 1 mg ήταν περίπου 30% και 40% μεγαλύτερες, αντίστοιχα, από ότι μετά τη χορήγηση μιας κυψέλης των 3 mg (βλ ΔΟΣΟΛΟΓΙΑ ΚΑΙ ΧΟΡΗΓΗΣΗ).
Διανομή και Εξάλειψη
Επειδή η ανασυνδυασμένη ανθρώπινη ινσουλίνη είναι ταυτόσημη με την ενδογενή ινσουλίνη, η συστηματική κατανομή και αποβολή αναμένεται να είναι η ίδια. Ωστόσο, αυτό δεν επιβεβαιώθηκε για το Exubera.
Φαρμακοδυναμική
Το Exubera, όπως και τα υποδόρια χορηγούμενα ανάλογα ινσουλίνης ταχείας δράσης, έχει ταχύτερη έναρξη της δραστηριότητας μείωσης της γλυκόζης από ότι η υποδόρια χορηγούμενη κανονική ανθρώπινη ινσουλίνη. Σε υγιείς εθελοντές, η διάρκεια της δραστηριότητας μείωσης της γλυκόζης για το Exubera ήταν συγκρίσιμη με την υποδορίως χορηγήθηκε κανονική ανθρώπινη ινσουλίνη και περισσότερο από τα υποδόρια χορηγούμενα ανάλογα ινσουλίνης ταχείας δράσης (βλ Σχήμα 2).
Σχήμα 2. Μέσος ρυθμός έγχυσης γλυκόζης (GIR) Ομαλοποιημένος σε GIRΜέγιστη για κάθε θεραπευτική αγωγή έναντι του χρόνου σε υγιείς εθελοντές
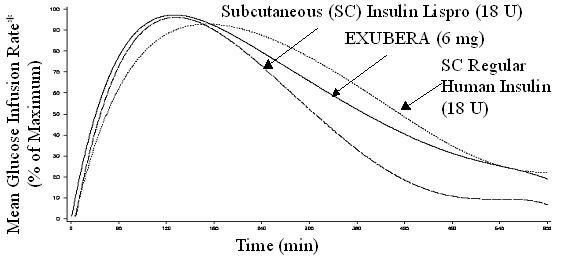
* Προσδιορίζεται ως ποσότητα γλυκόζης που εγχύεται για τη διατήρηση σταθερών συγκεντρώσεων γλυκόζης στο πλάσμα, ομαλοποιημένη σε μέγιστες τιμές (τοις εκατό των μέγιστων τιμών). ενδεικτική της δραστηριότητας ινσουλίνης.
Όταν το Exubera εισπνέεται, η έναρξη της δραστηριότητας μείωσης της γλυκόζης σε υγιείς εθελοντές συμβαίνει εντός 10-20 λεπτών. Η μέγιστη επίδραση στη μείωση της γλυκόζης ασκείται περίπου 2 ώρες μετά την εισπνοή. Η διάρκεια της δραστηριότητας μείωσης της γλυκόζης είναι περίπου 6 ώρες.
Σε ασθενείς με διαβήτη τύπου 1 ή τύπου 2, το Exubera έχει μεγαλύτερη επίδραση στη μείωση της γλυκόζης μέσα στις δύο πρώτες ώρες μετά τη χορήγηση της δόσης σε σύγκριση με την υποδόρια χορηγούμενη κανονική ανθρώπινη ινσουλίνη.
Η ενδο-αντικειμενική μεταβλητότητα της δραστικότητας μείωσης της γλυκόζης του Exubera είναι γενικά συγκρίσιμη με αυτή της υποδόρια χορηγούμενης κανονικής ανθρώπινης ινσουλίνης σε ασθενείς με διαβήτη τύπου 1 και 2.
Ειδικοί πληθυσμοί
Παιδιατρικοί ασθενείς
Στα παιδιά (6-11 ετών) και στους εφήβους (12-17 ετών) με διαβήτη τύπου 1, ο χρόνος έως τη μέγιστη συγκέντρωση ινσουλίνης για το Exubera ήταν επιτυγχάνεται ταχύτερα από ό, τι για την υποδόρια κανονική ανθρώπινη ινσουλίνη, η οποία είναι συνεπής με τις παρατηρήσεις σε ενήλικες ασθενείς τύπου 1 Διαβήτης.
Γηριατρικοί ασθενείς
Δεν υπάρχουν εμφανείς διαφορές στις φαρμακοκινητικές ιδιότητες του Exubera όταν συγκρίνονται ασθενείς ηλικίας άνω των 65 ετών και νεότεροι ενήλικες ασθενείς.
Γένος
Σε άτομα με και χωρίς διαβήτη, δεν παρατηρήθηκαν εμφανείς διαφορές στις φαρμακοκινητικές ιδιότητες του Exubera μεταξύ ανδρών και γυναικών.
Αγώνας
Διεξήχθη μια μελέτη σε 25 υγιείς καυκάσιους και ιαπωνικούς μη διαβητικούς ασθενείς για να συγκριθούν φαρμακοκινητικές και φαρμακοδυναμικές ιδιότητες του Exubera, έναντι υποδόριας ένεσης κανονικού ανθρώπου ινσουλίνη. Οι φαρμακοκινητικές και φαρμακοδυναμικές ιδιότητες του Exubera ήταν συγκρίσιμες μεταξύ των δύο πληθυσμών.
Ευσαρκία
Η απορρόφηση του Exubera είναι ανεξάρτητη από τον BMI του ασθενούς.
Νεφρική δυσλειτουργία
Η επίδραση της νεφρικής δυσλειτουργίας στη φαρμακοκινητική του Exubera δεν έχει μελετηθεί. Η προσεκτική παρακολούθηση της γλυκόζης και η προσαρμογή της δόσης της ινσουλίνης μπορεί να είναι απαραίτητες σε ασθενείς με νεφρική δυσλειτουργία (βλ ΠΡΟΦΥΛΑΞΕΙΣ, Νεφρική δυσλειτουργία).
Ηπατική ανεπάρκεια
Η επίδραση της ηπατικής δυσλειτουργίας στη φαρμακοκινητική του Exubera δεν έχει μελετηθεί. Η προσεκτική παρακολούθηση της γλυκόζης και η προσαρμογή της δόσης της ινσουλίνης μπορεί να είναι απαραίτητες σε ασθενείς με ηπατική δυσλειτουργία (βλ ΠΡΟΦΥΛΑΞΕΙΣ).
Εγκυμοσύνη
Η απορρόφηση του Exubera σε εγκύους ασθενείς με διαβήτη κύησης και πριν από την κύηση ήταν σύμφωνη με αυτή σε μη εγκύους ασθενείς με διαβήτη τύπου 2 (βλ. ΠΡΟΦΥΛΑΞΕΙΣ).
Κάπνισμα
Στους καπνιστές, η συστηματική έκθεση στην ινσουλίνη για το Exubera αναμένεται να είναι 2 έως 5 φορές υψηλότερη από ό, τι στους μη καπνιστές. Το Exubera αντενδείκνυται σε ασθενείς που καπνίζουν ή οι οποίοι διέκοψαν το κάπνισμα λιγότερο από 6 μήνες πριν από την έναρξη της θεραπείας με Exubera. Εάν ένας ασθενής ξεκινήσει ή συνεχίσει το κάπνισμα, το Exubera πρέπει να διακοπεί αμέσως λόγω του αυξημένου κινδύνου υπογλυκαιμίας και πρέπει να χρησιμοποιηθεί μια εναλλακτική θεραπεία (βλ. ΑΝΤΕΝΔΕΙΞΕΙΣ).
Σε κλινικές μελέτες με Exubera σε 123 ασθενείς (69 από τους οποίους ήταν καπνιστές), οι καπνιστές παρουσίασαν ταχύτερη έναρξη δράσης μείωσης της γλυκόζης, μεγαλύτερη μέγιστη επίδραση και μεγαλύτερη ολική μείωση της γλυκόζης (ιδιαίτερα κατά τη διάρκεια των πρώτων 2-3 ωρών μετά τη χορήγηση της δόσης), σε σύγκριση με μη καπνιστές.
Παθητικός καπνός τσιγάρων
Σε αντίθεση με την αύξηση της έκθεσης στην ινσουλίνη μετά από ενεργό κάπνισμα, όταν το Exubera χορηγήθηκε σε 30 υγιείς μη καπνιστές εθελοντές μετά από 2 ώρες έκθεσης σε παθητικό καπνό τσιγάρου σε ελεγχόμενη πειραματική ρύθμιση, η AUC και η Cmax της ινσουλίνης μειώθηκαν κατά περίπου 20% και 30% αντίστοιχα. Η φαρμακοκινητική του Exubera δεν έχει μελετηθεί σε μη καπνιστές που εκτίθενται χρονίως σε παθητικό καπνό τσιγάρου.
Ασθενείς με Υποκείμενες Πνευμονοπάθειες
Η χρήση του Exubera σε ασθενείς με υποκείμενη πνευμονική νόσο, όπως άσθμα ή ΧΑΠ, δεν συνιστάται διότι η ασφάλεια και η αποτελεσματικότητα του Exubera σε αυτόν τον πληθυσμό δεν έχουν τεκμηριωθεί (βλ. ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ). Η χρήση του Exubera αντενδείκνυται σε ασθενείς με ασταθή ή κακώς ελεγχόμενη πνευμονική νόσο, λόγω της ευρείας μεταβολές στη λειτουργία των πνευμόνων που θα μπορούσαν να επηρεάσουν την απορρόφηση του Exubera και να αυξήσουν τον κίνδυνο υπογλυκαιμίας ή υπεργλυκαιμία (βλ ΑΝΤΕΝΔΕΙΞΕΙΣ).
Σε μια φαρμακοκινητική μελέτη σε 24 μη διαβητικά άτομα με ήπιο άσθμα, η απορρόφηση ινσουλίνης μετά από χορήγηση Το Exubera, ελλείψει θεραπείας με βρογχοδιασταλτικό, ήταν περίπου 20% χαμηλότερο από την απορρόφηση που παρατηρήθηκε σε άτομα χωρίς βρογχικο Ασθμα. Ωστόσο, σε μια μελέτη σε 24 μη διαβητικά άτομα με Χρόνια Αποφρακτική Πνευμονοπάθεια (COPD), η συστηματική η έκθεση μετά τη χορήγηση του Exubera ήταν περίπου διπλάσια από εκείνη των φυσιολογικών ατόμων χωρίς ΧΑΠ (βλέπε ΠΡΟΦΥΛΑΞΕΙΣ).
Η χορήγηση αλβουτερόλης 30 λεπτά πριν από τη χορήγηση του Exubera σε μη διαβητικά άτομα με ήπιο άσθμα (n = 36) και μέτρια το άσθμα (n = 31) είχε ως αποτέλεσμα τη μέση αύξηση της AUC και της Cmax της ινσουλίνης μεταξύ 25 και 50% σε σύγκριση με τη χορήγηση του Exubera μόνος (βλ. ΠΡΟΦΥΛΑΞΕΙΣ).
μπλουζα
Κλινικές μελέτες
Η ασφάλεια και η αποτελεσματικότητα του Exubera έχει μελετηθεί σε περίπου 2500 ενήλικες ασθενείς με διαβήτη τύπου 1 και τύπου 2. Η κύρια παράμετρος αποτελεσματικότητας για τις περισσότερες μελέτες ήταν ο γλυκαιμικός έλεγχος, όπως μετρήθηκε με τη μείωση της αρχικής τιμής της αιμοσφαιρίνης A1c (HbA1c).
Διαβήτης τύπου 1
Μια τυχαιοποιημένη, ανοικτή, μελέτη ενεργού ελέγχου (μελέτη A) διάρκειας 24 εβδομάδων διεξήχθη σε ασθενείς με διαβήτη τύπου 1 για να εκτιμηθεί η ασφάλεια και η αποτελεσματικότητα Το Exubera χορήγησε προ-γεύμα τρεις φορές την ημέρα (TID) με μία μόνο ένεση νύχτας Humulin® U Ultralente® (εναιώρημα ψευδαργύρου εκτεταμένης ανθρωπινής ινσουλίνης) (n = 136). Η θεραπεία σύγκρισης ήταν υποδόρια κανονική ανθρώπινη ινσουλίνη χορηγούμενη δύο φορές την ημέρα (BID) (πριν το πρωινό και πριν το δείπνο) με ένεση BID ανθρώπινης ινσουλίνης NPH (εναιώρημα ισοφάνης ανθρώπινης ινσουλίνης) (η = 132). Σε αυτή τη μελέτη, η μέση ηλικία ήταν 38,2 έτη (εύρος: 20-64) και το 52% των ατόμων ήταν άνδρες.
Μια δεύτερη, 24 εβδομάδων, τυχαιοποιημένη, ανοικτή, μελέτη ενεργού ελέγχου (μελέτη Β) διεξήχθη σε ασθενείς με σακχαρώδη διαβήτη τύπου 1 για να εκτιμηθεί την ασφάλεια και την αποτελεσματικότητα του Exubera (n = 103) σε σύγκριση με την υποδόρια κανονική ανθρώπινη ινσουλίνη (n = 103) όταν χορηγήθηκε τα γεύματα. Και στους δύο βραχίονες θεραπείας χορηγήθηκε ανθρώπινη ινσουλίνη NPH BID (το πρωί και κατά τον ύπνο) ως η βασική ινσουλίνη. Σε αυτή τη μελέτη, η μέση ηλικία ήταν 38,4 έτη (εύρος: 19-65) και το 54% των ατόμων ήταν άνδρες.
Σε κάθε μελέτη, η μείωση της HbA1c και οι ρυθμοί υπογλυκαιμίας ήταν συγκρίσιμες για τις δύο ομάδες θεραπείας. Οι ασθενείς που έλαβαν θεραπεία με Exubera είχαν μεγαλύτερη μείωση στη γλυκόζη πλάσματος νηστείας σε σύγκριση με τους ασθενείς στην ομάδα σύγκρισης. Το ποσοστό των ασθενών που έφθασαν σε επίπεδο HbA1c <8% (ανά θεραπεία Αμερικανικής Διαβητικής Αγωγής Επίπεδο κατά το χρόνο διεξαγωγής της μελέτης) και ένα επίπεδο HbA1c <7% ήταν συγκρίσιμο μεταξύ των δύο ομάδων θεραπείας. Τα αποτελέσματα για τις Μελέτες Α και Β παρουσιάζονται στον Πίνακα 2.
Πίνακας 2: Αποτελέσματα δύο δοκιμών 24 εβδομάδων, ενεργού-ελέγχου, ανοιχτού σήματος σε ασθενείς με διαβήτη τύπου 1 (μελέτες Α και Β)
| Μελέτη A | Μελέτη Β | |||
|---|---|---|---|---|
| Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) | Exubera (TID) + NPH (BID) | SC R (TID) + NPH (BID) | |
| Το μέγεθος του δείγματος | 136 | 132 | 103 | 103 |
| UL = Humulin® U Ultralente®; SC R = υποδόρια κανονική ανθρώπινη ινσουλίνη | ||||
| ||||
| HbA1γ (%) | ||||
| Μέσος όρος βάσης | 7.9 | 8.0 | 7.8 | 7.8 |
| Adj. μέση αλλαγή από την αρχική τιμή | -0.2 | -0.4 | -0.3 | -0.2 |
| Exubera μείον SC R* | 0.14 | -0.11 | ||
| 95% CI για διαφορά θεραπείας | (-0.03, 0.32) | (-0.30, 0.08) | ||
| Γλυκόζη πλάσματος νηστείας (mg / dL) | ||||
| Μέσος όρος βάσης | 191 | 198 | 178 | 191 |
| Adj. μέση αλλαγή από την αρχική τιμή | -32 | -6 | -23 | 13 |
| Exubera μείον SC R | -27 | -35 | ||
| 95% CI για διαφορά θεραπείας | (-47, -6) | (-58, -13) | ||
| 2-ωρες συγκέντρωση γλυκόζης μετά το γεύμα (mg / dL) | ||||
| Μέσος όρος βάσης | 283 | 305 | 273 | 293 |
| Adj. μέση αλλαγή από την αρχική τιμή | -21 | 14 | -1 | -3 |
| Exubera μείον SC R | -35 | 2 | ||
| 95% CI για διαφορά θεραπείας | (-61, -8) | (-29, 32) | ||
| Ασθενείς με τελική μελέτη HbA1γ < 8%†| 64.0% | 68.2% | 74.8% | 66.0% |
| Ασθενείς με τελική μελέτη HbA1γ < 7% | 16.9% | 19.7% | 28.2% | 30.1% |
| Σωματικό βάρος | ||||
| Μέσος όρος βάσης (kg) | 77.4 | 76.4 | 76.0 | 76.9 |
| Adj. μέση μεταβολή από την αρχική τιμή (kg) | 0.4 | 1.1 | 0.4 | 0.6 |
| Exubera μείον SC R | -0.72 | -0.24 | ||
| 95% CI για διαφορά θεραπείας | (-1.48, 0.04) | (-1.07, 0.59) | ||
| Τέλος μελέτης ημερήσιας δόσης ινσουλίνης | ||||
| Ινσουλίνη βραχείας δράσης | 13,4 mgντο | 18,3 IU | 10,9 mgντο | 25,7 IU |
| Ινσουλίνη μακράς δράσης | 26,4 IU | 37,1 IU | 31,5 IU | 31,9 IU |
Διαβήτης τύπου 2
Μονοθεραπεία σε ασθενείς που δεν ελέγχονται βέλτιστα με θεραπεία διατροφής και άσκησης
Μια τυχαιοποιημένη, ανοικτή, ενεργή μελέτη ελέγχου (μελέτη C), διάρκειας 12 εβδομάδων, διεξήχθη σε ασθενείς με διαβήτη τύπου 2 όχι βέλτιστα ελεγχόμενη με δίαιτα και άσκηση, αξιολογώντας την ασφάλεια και την αποτελεσματικότητα του TID Exubera πριν από το γεύμα (n = 75) σε σύγκριση με ένα παράγοντα ευαισθητοποίησης ινσουλίνης. Σε αυτή τη μελέτη, η μέση ηλικία ήταν 53,7 έτη (εύρος: 28-80), το 55% των ατόμων ήταν άνδρες και ο μέσος δείκτης μάζας σώματος ήταν 32,3 kg / m2.
Σε 12 εβδομάδες, HbA1γ τα επίπεδα σε ασθενείς που έλαβαν θεραπεία με Exubera μειώθηκαν κατά 2,2% (SD = 1,0) από βασική γραμμή 9,5% (SD = 1,1). Το ποσοστό των ασθενών που έλαβαν θεραπεία με Exubera έφτασε σε HbA στο τέλος της μελέτης1γ επίπεδο <8% αυξήθηκε σε 82,7%. Το ποσοστό των ασθενών που έλαβαν θεραπεία με Exubera έφτασε σε HbA στο τέλος της μελέτης1γ επίπεδο του
Μονοθεραπεία και συμπληρωματική θεραπεία σε ασθενείς που είχαν υποβληθεί προηγουμένως σε θεραπεία με θεραπευτική αγωγή από το στόμα
Μια τυχαιοποιημένη, ανοικτή, μελέτη ενεργού ελέγχου 12 εβδομάδων (Μελέτη D) διεξήχθη σε ασθενείς με τύπο 2 διαβήτη, οι οποίοι επί του παρόντος έλαβαν θεραπεία, αλλά ήταν ανεπαρκώς ελεγχόμενοι, με δύο από του στόματος παράγοντες (ΟΑ). Τα βασικά ΟΑ περιλαμβάνουν ένα έκκριμα της ινσουλίνης και είτε μετφορμίνη ή θειαζολιδινοδιόνη. Οι ασθενείς τυχαιοποιήθηκαν σε έναν από τους τρεις βραχίονες: συνέχιση της θεραπείας με ΟΑ μόνο (n = 96), μετάβαση σε προ-γεύμα TID Exubera μονοθεραπεία (n = 102) ή προσθήκη προ-γεύματος TID Exubera σε συνεχή θεραπεία ΟΑ (n = 100). Σε αυτή τη μελέτη, η μέση ηλικία ήταν 57,4 έτη (εύρος: 33-80), το 66% των ατόμων ήταν άνδρες και ο μέσος δείκτης μάζας σώματος ήταν 30 kg / m2.
Η μονοθεραπεία με Exubera και το Exubera σε συνδυασμό με τη θεραπεία με ΟΑ ήταν ανώτερες από τη θεραπεία με ΟΑ μόνο στη μείωση της HbA1γ επίπεδα από την αρχική τιμή. Οι ρυθμοί υπογλυκαιμίας για τις δύο ομάδες θεραπείας με Exubera ήταν ελαφρώς υψηλότεροι από ό, τι στην ομάδα θεραπείας ΟΑ μόνο. Σε σύγκριση με τη θεραπεία με ΟΑ μόνο, το ποσοστό των ασθενών που έφτασαν σε HbA1γ επίπεδο <8% (ανά Αμερικανική Διαβητική Αγωγή θεραπευτικής αγωγής κατά τη διάρκεια της μελέτης συμπεριφοράς) και HbA1γ επίπεδο <7% ήταν μεγαλύτερο για ασθενείς που έλαβαν θεραπεία με Exubera μονοθεραπεία και Exubera σε συνδυασμό με θεραπεία ΟΑ. Οι ασθενείς και στις δύο ομάδες θεραπείας με Exubera είχαν μεγαλύτερη μείωση στη γλυκόζη πλάσματος νηστείας σε σύγκριση με τους ασθενείς που έλαβαν μόνο θεραπεία με ΟΑ. Τα αποτελέσματα για τη Μελέτη D παρουσιάζονται στον Πίνακα 3.
Πίνακας 3: Αποτελέσματα δοκιμής 12 εβδομάδων, ενεργού ελέγχου, ανοιχτής ετικέτας σε ασθενείς με διαβήτη τύπου 2 που δεν ελέγχονται βέλτιστα με διπλή θεραπεία από το στόμα (μελέτη D)
| Μελέτη D | Μονοθεραπεία με Exubera | OAs* | Exubera + ΟΑ |
|---|---|---|---|
| Το μέγεθος του δείγματος | 102 | 96 | 100 |
| |||
| HbA1γ (%) | |||
| Μέσος όρος βάσης | 9.3 | 9.3 | 9.2 |
| Adj. μέση αλλαγή από την αρχική τιμή | -1.4 | -0.2 | -1.9 |
| Ομάδα Exubera μείον OAs†| -1.18†,ντο, § | -1.67†, ¶, § | |
| 95% CI για διαφορά θεραπείας | (-1.41, -0.95) | (-1.90, -1.44) | |
| Γλυκόζη πλάσματος νηστείας (mg / dL) | |||
| Μέσος όρος βάσης | 203 | 203 | 195 |
| Adj. μέση αλλαγή από την αρχική τιμή | -23 | 1 | -53 |
| Ομάδα Exubera μείον OAs | -24ντο | -53 ¶ | |
| 95% CI για διαφορά θεραπείας | (-36, -11) | (-66, -41) | |
| Ασθενείς με τελική μελέτη HbA1γ < 8%# | 55.9% | 18.8% | 86.0% |
| Ασθενείς με τελική μελέτη HbA1γ < 7% | 16.7% | 1.0% | 32.0% |
| Σωματικό βάρος | |||
| Μέσος όρος βάσης (kg) | 89.5 | 88.0 | 88.6 |
| Adj. μέση μεταβολή από την αρχική τιμή (kg) | 2.8 | 0.0 | 2.7 |
| Ομάδα Exubera μείον OAs | 2.80ντο | 2.75 ¶ | |
| 95% CI για διαφορά θεραπείας | (1.94, 3.65) | (1.89, 3.61) |
Μια τυχαιοποιημένη, ανοικτή, μελέτη ενεργού ελέγχου (μελέτη E), διάρκειας 24 εβδομάδων, διεξήχθη σε ασθενείς με διαβήτη τύπου 2, που λαμβάνουν σήμερα θεραπεία με σουλφονυλουρία. Αυτή η μελέτη σχεδιάστηκε για να αξιολογηθεί η συνέχιση της ασφάλειας και της αποτελεσματικότητας της προσθήκης Exubera πριν από το γεύμα θεραπεία με σουλφονυλουρία (n = 214) σε σύγκριση με την προσθήκη μετφορμίνης πριν από το γεύμα σε συνεχιζόμενη θεραπεία με σουλφονυλουρία (n = 196). Τα υποκείμενα στρωματοποιήθηκαν σύμφωνα με την HbA1c τους την εβδομάδα -1. Δύο στρώματα ορίστηκαν: ένα χαμηλό επίπεδο HbA1c (HbA1γ ≥ 8% έως ≥9,5%) και υψηλό HbA1γ στρώμα (HbA1γ > 9,5 έως â ‰ ¤12%).
Το Exubera σε συνδυασμό με τη σουλφονυλουρία ήταν ανώτερο από τη μετφορμίνη και τη σουλφονυλουρία στη μείωση των τιμών HbA1c από την αρχική τιμή στην ομάδα υψηλού στρώματος. Το Exubera σε συνδυασμό με τη σουλφονυλουρία ήταν συγκρίσιμο με τη μετφορμίνη σε συνδυασμό με τη σουλφονυλουρία για τη μείωση των τιμών HbA1c από την αρχική τιμή στην ομάδα χαμηλού στρώματος. Ο ρυθμός της υπογλυκαιμίας ήταν υψηλότερος μετά την προσθήκη του Exubera στη σουλφονυλουρία παρά μετά την προσθήκη μετφορμίνης στη σουλφονυλουρία. Το ποσοστό των ασθενών που έλαβαν τιμές στόχου HbA1c 8% και 7% ήταν συγκρίσιμο μεταξύ των ομάδων θεραπείας και στα δύο στρώματα, όπως και η μείωση της γλυκόζης στο πλάσμα νηστείας (βλ. Πίνακας 4).
Μια άλλη τυχαιοποιημένη, ανοικτή, μελέτη ενεργού ελέγχου (μελέτη F), διάρκειας 24 εβδομάδων, διεξήχθη σε ασθενείς με διαβήτη τύπου 2, που λαμβάνουν σήμερα θεραπεία με μετφορμίνη. Αυτή η μελέτη σχεδιάστηκε για να αξιολογηθεί η συνέχιση της ασφάλειας και της αποτελεσματικότητας της προσθήκης Exubera πριν από το γεύμα θεραπεία με μετφορμίνη (n = 234) σε σύγκριση με την προσθήκη γλιβενκλαμίδης πριν από το γεύμα σε συνεχή θεραπεία με μετφορμίνη (n = 222). Τα άτομα αυτής της μελέτης ήταν επίσης στρωματοποιημένα σε ένα από τα δύο στρώματα όπως ορίζονται στη Μελέτη Ε.
Το Exubera σε συνδυασμό με μετφορμίνη ήταν ανώτερο από το glibenclamide και τη μετφορμίνη στη μείωση της HbA1γ από την αρχική τιμή και την επίτευξη του στόχου HbA1γ τιμές στην ομάδα υψηλού στρώματος. Το Exubera σε συνδυασμό με μετφορμίνη ήταν συγκρίσιμο με το glibenclamide σε συνδυασμό με μετφορμίνη στη μείωση της HbA1γ από την αρχική τιμή και την επίτευξη του στόχου HbA1γ τιμές στην ομάδα χαμηλού στρώματος. Ο ρυθμός υπογλυκαιμίας ήταν ελαφρώς υψηλότερος μετά την προσθήκη του Exubera στη μετφορμίνη παρά μετά την προσθήκη γλιβενκλαμίδης στη μετφορμίνη. Η μείωση της γλυκόζης πλάσματος νηστείας ήταν συγκρίσιμη μεταξύ των ομάδων θεραπείας (βλ Πίνακας 4).
Πίνακας 4: Αποτελέσματα δύο δοκιμών 24 εβδομάδων, ενεργού-ελέγχου, ανοιχτού σήματος σε ασθενείς με σακχαρώδη διαβήτη τύπου 2, προγενέστερα στη θεραπευτική αγωγή από το στόμα (μελέτες E και F)
| Μελέτη Ε | Μελέτη F | |||||||
|---|---|---|---|---|---|---|---|---|
| Exubera + SU* | Συνάντησε*+ SU* | Exubera + SU* | Συνάντησε*+ SU* | Exubera + Met* | Γλι* + Μετρήθηκε* | Exubera + Met* | Γλι* + Μετρήθηκε* | |
| Υψηλό στρώμα†| Χαμηλό στρώμα†| Υψηλό στρώμα†| Χαμηλό στρώμα†| |||||
| Το μέγεθος του δείγματος | 113 | 103 | 101 | 93 | 109 | 103 | 125 | 119 |
| ||||||||
| HbA1γ (%) | ||||||||
| Μέσος όρος βάσης | 10.5 | 10.6 | 8.8 | 8.8 | 10.4 | 10.6 | 8.6 | 8.7 |
| Adj. μέση αλλαγή από την αρχική τιμή | -2.2 | -1.8 | -1.9 | -1.9 | -2.2 | -1.9 | -1.8 | -1.9 |
| Exubera μείον OAντο | -0.38ντο, § | -0.07 | -0.37ντο, ¶ | 0.04 | ||||
| 95% CI για διαφορά θεραπείας | (-0.63, -0.14) | (-0.33, 0.19) | (-0.62, -0.12) | (-0.19, 0.27) | ||||
| Γλυκόζη πλάσματος νηστείας (mg / dL) | ||||||||
| Μέσος όρος βάσης | 241 | 237 | 197 | 198 | 223 | 243 | 187 | 196 |
| Μέση αλλαγή από τη γραμμή βάσης | -46 | -47 | -48 | -52 | -42 | -40 | -46 | -49 |
| Exubera μείον OA | 1 | 4 | -2 | 4 | ||||
| 95% CI για διαφορά θεραπείας | (-11, 12) | (-8, 16) | (-14, 10) | (-7, 15) | ||||
| Υποκείμενα με τελική μελέτη HbA1γ < 8%# | 48.7% | 44.7% | 81.2% | 73.1% | 72.5% | 56.3% | 80.8% | 86.6% |
| Υποκείμενα με τελική μελέτη HbA1γ < 7% | 20.4% | 14.6% | 30.7% | 32.3% | 33.9% | 17.5% | 40.0% | 42.9% |
| Σωματικό βάρος | ||||||||
| Μέσος όρος βάσης (kg) | 80.8 | 79.5 | 79.9 | 81.9 | 88.3 | 87.8 | 90.3 | 88.2 |
| Adj. μέση μεταβολή από την αρχική τιμή (kg) | 3.6 | -0.0 | 2.4 | -0.3 | 2.8 | 2.5 | 2.0 | 1.6 |
| Exubera μείον OA | 3.60 | 2.67 | 0.26 | 0.38 | ||||
| 95% CI για διαφορά θεραπείας | (2.81, 4.39) | (1.84, 3.51) | (-0.70, 1.21) | (-0.52, 1.27) |
Χρήση σε ασθενείς που έχουν υποβληθεί προηγουμένως σε θεραπεία με υποδόρια ινσουλίνη
Μια τυχαιοποιημένη, ανοικτή, μελέτη ενεργού ελέγχου 24 εβδομάδων (μελέτη G) διεξήχθη σε ασθενείς που έλαβαν ινσουλίνη με τύπο 2 διαβήτη για να εκτιμηθεί η ασφάλεια και η αποτελεσματικότητα του Exubera που χορηγείται πριν από το γεύμα τρεις φορές την ημέρα με μία μόνο ένεση νύχτας Humulin® U Ultralente® (n = 146) σε σύγκριση με την υποδόρια κανονική ανθρώπινη ινσουλίνη που χορηγήθηκε BID (πριν το πρωινό και πριν το δείπνο) με ένεση BID ανθρώπινης ινσουλίνης NPH (n = 149). Σε αυτή τη μελέτη, η μέση ηλικία ήταν 57,5 έτη (εύρος: 23-80), το 66% των ατόμων ήταν άνδρες και ο μέσος δείκτης μάζας σώματος ήταν 30,3 kg / m2.
Οι μειώσεις από την αρχική τιμή της HbA1γ, τοις εκατό των ασθενών που έφτασαν σε HbA1γ επίπεδο <8% (ανά Αμερικανική Διαβητική Αγωγή θεραπευτικής αγωγής κατά τη διάρκεια της μελέτης συμπεριφοράς) και HbA1γ επίπεδα <7%, καθώς και τα ποσοστά υπογλυκαιμίας, ήταν παρόμοια μεταξύ των ομάδων θεραπείας. Οι ασθενείς που έλαβαν θεραπεία με Exubera είχαν μεγαλύτερη μείωση στη γλυκόζη πλάσματος νηστείας σε σύγκριση με τους ασθενείς στην ομάδα σύγκρισης. Τα αποτελέσματα για τη Μελέτη G παρουσιάζονται στον Πίνακα 5.
Πίνακας 5: Αποτελέσματα μιας δοκιμής 24 εβδομάδων, ενεργού ελέγχου, ανοιχτής ετικέτας σε ασθενείς με διαβήτη τύπου 2 που είχαν προηγουμένως υποβληθεί σε θεραπεία με υποδόρια ινσουλίνη (μελέτη G)
| Μελέτη G | Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) |
|---|---|---|
| Το μέγεθος του δείγματος | 146 | 149 |
| UL = Humulin® U Ultralente®; SC R = υποδόρια κανονική ανθρώπινη ινσουλίνη | ||
| ||
| HbA1γ (%) | ||
| Μέσος όρος βάσης | 8.1 | 8.2 |
| Adj. μέση αλλαγή από την αρχική τιμή | -0.7 | -0.6 |
| Exubera μείον SC R* | -0.07 | |
| 95% CI για διαφορά θεραπείας | (-0.31, 0.17) | |
| Γλυκόζη πλάσματος νηστείας (mg / dL) | ||
| Μέσος όρος βάσης | 152 | 159 |
| Adj. μέση αλλαγή από την αρχική τιμή | -22 | -6 |
| Exubera μείον SC R | -16.36 | |
| 95% CI για διαφορά θεραπείας | (-27.09, -5.36) | |
| Ασθενείς με τελική μελέτη HbA1γ < 8%†| 76.0% | 69.1% |
| Ασθενείς με τελική μελέτη HbA1γ < 7% | 45.2% | 32.2% |
| Σωματικό βάρος | ||
| Μέσος όρος βάσης (kg) | 90.6 | 89.0 |
| Adj. μέση μεταβολή από την αρχική τιμή (kg) | 0.1 | 1.3 |
| Exubera μείον SC R | -1.28 | |
| 95% CI για διαφορά θεραπείας | (-1.96, -0.60) | |
| Τέλος μελέτης ημερήσιας δόσης ινσουλίνης | ||
| Ινσουλίνη βραχείας δράσης | 16,6 mgντο | 25,5 IU |
| Ινσουλίνη μακράς δράσης | 37,9 IU | 52,3 IU |
μπλουζα
Ενδείξεις και χρήση
Το Exubera ενδείκνυται για τη θεραπεία ενηλίκων ασθενών με σακχαρώδη διαβήτη για τον έλεγχο της υπεργλυκαιμίας. Το Exubera παρουσιάζει δράση παρόμοια με τα ανάλογα ινσουλίνης ταχείας δράσης και έχει διάρκεια δράσης μείωσης της γλυκόζης συγκρίσιμη με την υποδόρια χορηγούμενη τακτική ανθρώπινη ινσουλίνη. Σε ασθενείς με διαβήτη τύπου 1, το Exubera πρέπει να χρησιμοποιείται σε αγωγές που περιλαμβάνουν ινσουλίνη μακρύτερης διάρκειας. Σε ασθενείς με διαβήτη τύπου 2, το Exubera μπορεί να χρησιμοποιηθεί ως μονοθεραπεία ή σε συνδυασμό με στοματικούς παράγοντες ή ινσουλίνες με μεγαλύτερη διάρκεια δράσης.
μπλουζα
Αντενδείξεις
Το Exubera αντενδείκνυται σε ασθενείς που παρουσιάζουν υπερευαισθησία στο Exubera ή σε κάποιο από τα έκδοχα του.
Το Exubera αντενδείκνυται σε ασθενείς που καπνίζουν ή οι οποίοι διέκοψαν το κάπνισμα λιγότερο από 6 μήνες πριν από την έναρξη της θεραπείας με Exubera. Εάν ένας ασθενής ξεκινήσει ή συνεχίσει το κάπνισμα, το Exubera πρέπει να διακοπεί αμέσως λόγω του αυξημένου κινδύνου υπογλυκαιμίας και πρέπει να χρησιμοποιηθεί μια εναλλακτική θεραπεία (βλ. ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ, Ειδικοί Πληθυσμοί, Κάπνισμα). Η ασφάλεια και η αποτελεσματικότητα του Exubera σε ασθενείς που καπνίζουν δεν έχουν τεκμηριωθεί.
Το Exubera αντενδείκνυται σε ασθενείς με ασταθή ή κακώς ελεγχόμενη πνευμονική νόσο, λόγω μεγάλων διακυμάνσεων σε λειτουργία του πνεύμονα που θα μπορούσε να επηρεάσει την απορρόφηση του Exubera και να αυξήσει τον κίνδυνο υπογλυκαιμίας ή υπεργλυκαιμία.
μπλουζα
Προειδοποιήσεις
Το Exubera διαφέρει από την κανονική ανθρώπινη ινσουλίνη λόγω της ταχείας έναρξης της δράσης του. Όταν χρησιμοποιείται ως ινσουλίνη γεύματος, η δόση του Exubera πρέπει να χορηγείται εντός 10 λεπτών πριν από το γεύμα.
Η υπογλυκαιμία είναι το πιο συχνά αναφερόμενο ανεπιθύμητο συμβάν της ινσουλινοθεραπείας, συμπεριλαμβανομένου του Exubera. Ο χρόνος υπογλυκαιμίας μπορεί να διαφέρει μεταξύ των διαφόρων συνθέσεων ινσουλίνης.
Οι ασθενείς με διαβήτη τύπου 1 χρειάζονται επίσης ινσουλίνη μακρύτερης δράσης για να διατηρούν επαρκή έλεγχο της γλυκόζης.
Κάθε αλλαγή της ινσουλίνης πρέπει να γίνεται με προσοχή και μόνο υπό ιατρική παρακολούθηση. Οι αλλαγές στην αντοχή στην ινσουλίνη, τον κατασκευαστή, τον τύπο (π.χ. κανονικό, NPH, ανάλογα) ή είδη (ζώο, άνθρωπος) μπορεί να οδηγήσουν στην ανάγκη για αλλαγή δοσολογίας. Μπορεί να χρειαστεί προσαρμογή της ταυτόχρονης αντιδιαβητικής θεραπείας από του στόματος.
Η παρακολούθηση της γλυκόζης συνιστάται για όλους τους ασθενείς με διαβήτη.
Λόγω της επίδρασης του Exubera σε πνευμονική λειτουργία, όλοι οι ασθενείς θα πρέπει να έχουν αξιολογηθεί η πνευμονική λειτουργία πριν από την έναρξη της θεραπείας με Exubera (βλ. ΠΡΟΦΥΛΑΞΕΙΣ: Πνευμονική λειτουργία).
Η χρήση του Exubera σε ασθενείς με υποκείμενη πνευμονική νόσο, όπως άσθμα ή ΧΑΠ, δεν συνιστάται διότι η ασφάλεια και η αποτελεσματικότητα του Exubera σε αυτόν τον πληθυσμό δεν έχουν τεκμηριωθεί (βλ. ΠΡΟΦΥΛΑΞΕΙΣ: Υποκείμενη πνευμονοπάθεια).
Σε κλινικές δοκιμές του Exubera, υπήρξαν 6 νεοδιαγνωσθέντες κρούσματα πρωτοπαθούς κακοήθους πνεύμονα στους ασθενείς που έλαβαν θεραπεία με Exubera και 1 νεοδιαγνωσθείσα περίπτωση μεταξύ των ασθενών που έλαβαν θεραπεία με συγκριτή. Υπήρξε επίσης 1 μετά την κυκλοφορία του φαρμάκου έκθεση πρωτοπαθούς πνευμονικής κακοήθειας σε ασθενή που έλαβε θεραπεία με Exubera. Σε ελεγχόμενες κλινικές δοκιμές του Exubera, η συχνότητα εμφάνισης νέου πρωτογενούς καρκίνου του πνεύμονα ανά 100 έτη ασθενών ως προς την έκθεση του φαρμάκου στη μελέτη ήταν 0,13 (5 περιπτώσεις σε διάστημα 3900 ασθενών ετών) για τους ασθενείς που έλαβαν θεραπεία με Exubera και 0,02 (1 περίπτωση για περισσότερο από 4100 ασθενείς-έτη) για ασθενείς που έλαβαν θεραπεία με συγκριτή. Υπήρχαν πολύ λίγες περιπτώσεις για να καθοριστεί αν η εμφάνιση αυτών των περιστατικών σχετίζεται με το Exubera. Όλοι οι ασθενείς που είχαν διαγνωστεί με καρκίνο του πνεύμονα είχαν προηγούμενο ιστορικό κάπνισμα τσιγάρων.
μπλουζα
Προφυλάξεις
Γενικός
Όπως συμβαίνει με όλα τα σκευάσματα ινσουλίνης, η χρονική πορεία της δράσης του Exubera μπορεί να ποικίλει σε διαφορετικά άτομα ή σε διαφορετικούς χρόνους στο ίδιο άτομο. Η προσαρμογή της δοσολογίας οποιασδήποτε ινσουλίνης μπορεί να είναι απαραίτητη εάν οι ασθενείς αλλάξουν τη σωματική τους δραστηριότητα ή το συνηθισμένο σχέδιο γεύματος τους. Οι ανάγκες σε ινσουλίνη ενδέχεται να μεταβάλλονται κατά τη διάρκεια διαταραγμένων συνθηκών όπως ασθένεια, συναισθηματικές διαταραχές ή στρες.
Υπογλυκαιμία
Όπως με όλα τα σκευάσματα ινσουλίνης, οι υπογλυκαιμικές αντιδράσεις μπορεί να σχετίζονται με τη χορήγηση του Exubera. Οι γρήγορες αλλαγές στις συγκεντρώσεις γλυκόζης στον ορό μπορεί να προκαλέσουν συμπτώματα παρόμοια με την υπογλυκαιμία σε άτομα με διαβήτη, ανεξάρτητα από την τιμή γλυκόζης. Τα πρόδρομα προειδοποιητικά συμπτώματα της υπογλυκαιμίας μπορεί να είναι διαφορετικά ή λιγότερο έντονα υπό ορισμένες συνθήκες, όπως η μεγάλη τη διάρκεια του διαβήτη, τη νόσο του διαβητικού νεύρου, τη χρήση φαρμάκων όπως οι β-αναστολείς ή τον ενισχυμένο έλεγχο του διαβήτη (βλέπω ΠΡΟΦΥΛΑΞΕΙΣ: Αλληλεπιδράσεις με άλλα φάρμακα). Τέτοιες καταστάσεις μπορεί να οδηγήσουν σε σοβαρή υπογλυκαιμία (και, ενδεχομένως, απώλεια συνείδησης) πριν από την ευαισθητοποίηση των ασθενών για υπογλυκαιμία.
Νεφρική δυσλειτουργία
Δεν έχουν διεξαχθεί μελέτες σε ασθενείς με νεφρική δυσλειτουργία. Όπως και με άλλα σκευάσματα ινσουλίνης, οι απαιτήσεις δοσολογίας για το Exubera μπορεί να μειωθούν σε ασθενείς με νεφρική δυσλειτουργία (βλ ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ, Ειδικοί Πληθυσμοί).
Ηπατική ανεπάρκεια
Δεν έχουν διεξαχθεί μελέτες σε ασθενείς με ηπατική δυσλειτουργία. Όπως και με άλλα σκευάσματα ινσουλίνης, οι απαιτήσεις δοσολογίας για το Exubera μπορεί να μειωθούν σε ασθενείς με ηπατική δυσλειτουργία (βλ ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ, Ειδικοί Πληθυσμοί).
Αλλεργία
Συστηματική αλλεργία
Σε κλινικές μελέτες, η συνολική συχνότητα εμφάνισης αλλεργικών αντιδράσεων σε ασθενείς που έλαβαν θεραπεία με Exubera ήταν παρόμοια με αυτή σε ασθενείς που χρησιμοποιούν υποδόρια αγωγή με κανονική ανθρώπινη ινσουλίνη.
Όπως συμβαίνει με άλλα σκευάσματα ινσουλίνης, μπορεί να εμφανιστεί σπάνια αλλά δυνητικά σοβαρή γενικευμένη αλλεργία στην ινσουλίνη, η οποία μπορεί να προκαλέσει εξάνθημα (συμπεριλαμβανομένου του κνησμού) σε όλο το σώμα, δύσπνοια, συριγμός, μείωση της αρτηριακής πίεσης, γρήγορος παλμός ή ιδρώνοντας. Οι σοβαρές περιπτώσεις γενικευμένης αλλεργίας, συμπεριλαμβανομένων των αναφυλακτικών αντιδράσεων, μπορεί να είναι απειλητικές για τη ζωή. Εάν εμφανιστούν τέτοιες αντιδράσεις από το Exubera, το Exubera πρέπει να διακοπεί και να εξεταστούν εναλλακτικές θεραπείες.
Παραγωγή αντισωμάτων
Τα αντισώματα ινσουλίνης μπορεί να αναπτυχθούν κατά τη διάρκεια της θεραπείας με όλα τα σκευάσματα ινσουλίνης, συμπεριλαμβανομένου του Exubera. Σε κλινικές μελέτες του Exubera όπου ο συγκριτής ήταν υποδόρια ινσουλίνη, αυξήθηκαν τα επίπεδα αντισωμάτων ινσουλίνης (όπως ινσουλίνη) ήταν σημαντικά μεγαλύτερες για τους ασθενείς που έλαβαν Exubera από ότι για τους ασθενείς που έλαβαν υποδόρια ινσουλίνη μόνο. Δεν διαπιστώθηκαν κλινικές συνέπειες αυτών των αντισωμάτων κατά τη διάρκεια των κλινικών μελετών του Exubera. Ωστόσο, η μακροπρόθεσμη κλινική σημασία αυτής της αύξησης του σχηματισμού αντισωμάτων είναι άγνωστη.
Αναπνευστικός
Πνευμονική λειτουργία
Σε κλινικές δοκιμές διάρκειας έως δύο ετών, οι ασθενείς που έλαβαν θεραπεία με Exubera κατέδειξαν μεγαλύτερη μείωση της πνευμονικής λειτουργίας, συγκεκριμένα ο εξαναγκασμένος όγκος εκπνοής σε ένα δευτερόλεπτο (FEV1) και η ικανότητα διάχυσης του μονοξειδίου του άνθρακα (DLCO), σε σύγκριση με το συγκριτούμενο ασθενείς. Η μέση διαφορά της ομάδας θεραπείας στην πνευμονική λειτουργία που ευνοεί την ομάδα συγκριτών, σημειώθηκε εντός τις πρώτες εβδομάδες θεραπείας με το Exubera και δεν άλλαξε κατά τη διάρκεια της διετούς περιόδου θεραπείας (Βλέπω ΑΝΕΠΙΘΥΜΗΤΕΣ ΕΝΕΡΓΕΙΕΣ: Πνευμονική λειτουργία).
Κατά τη διάρκεια των ελεγχόμενων κλινικών δοκιμών, μεμονωμένοι ασθενείς παρουσίασαν αξιοσημείωτη πτώση της πνευμονικής λειτουργίας και στις δύο ομάδες θεραπείας. Μία μείωση από την αρχική FEV1 κατά ≥ 20% κατά την τελευταία παρατήρηση παρατηρήθηκε στο 1,5% των ασθενών που έλαβαν θεραπεία με Exubera και 1,3% των ασθενών που έλαβαν θεραπεία με συγκριτή. Μείωση από την αρχική τιμή DLCO ≥ 20% κατά την τελευταία παρατήρηση παρατηρήθηκε σε 5,1% των ασθενών που έλαβαν θεραπεία με Exubera και 3,6% των ασθενών που έλαβαν θεραπεία με συγκριτικό φάρμακο.
Λόγω της επίδρασης του Exubera σε πνευμονική λειτουργία, όλοι οι ασθενείς θα πρέπει να έχουν σπιρομετρία (FEV1) πριν από την έναρξη της θεραπείας με Exubera. Αξιολόγηση του DLCO θα πρέπει να ληφθεί υπόψην. Η αποτελεσματικότητα και η ασφάλεια του Exubera σε ασθενείς με αρχικό FEV1 ή DLCO <70% των προβλεπόμενων δεν έχουν τεκμηριωθεί και η χρήση του Exubera σε αυτόν τον πληθυσμό δεν συνιστάται.
Η αξιολόγηση της πνευμονικής λειτουργίας (π.χ. σπιρομετρία) συνιστάται μετά από τους πρώτους 6 μήνες της θεραπείας και ετησίως μετά την απουσία πνευμονικών συμπτωμάτων. Σε ασθενείς που παρουσιάζουν μείωση κατά ≥ 20% στο FEV1 από την αρχική τιμή, οι δοκιμές πνευμονικής λειτουργίας πρέπει να επαναληφθούν. Εάν επιβεβαιωθεί η μείωση κατά 20% από την αρχική FEV1, θα πρέπει να διακοπεί το Exubera. Η παρουσία πνευμονικών συμπτωμάτων και η μικρότερη πτώση της πνευμονικής λειτουργίας μπορεί να απαιτούν συχνότερη παρακολούθηση της πνευμονικής λειτουργίας και εξέταση της διακοπής του Exubera.
Υποκείμενη πνευμονοπάθεια
Η χρήση του Exubera σε ασθενείς με υποκείμενη πνευμονοπάθεια, όπως το άσθμα ή η ΧΑΠ, δεν συνιστάται επειδή δεν έχει αποδειχθεί η αποτελεσματικότητα και η ασφάλεια του Exubera σε αυτόν τον πληθυσμό.
Βρογχόσπασμος
Ο βρογχόσπασμος έχει σπάνια αναφερθεί σε ασθενείς που λαμβάνουν Exubera. Οι ασθενείς που αντιμετωπίζουν μια τέτοια αντίδραση θα πρέπει να διακόψουν το Exubera και να αναζητήσουν αμέσως ιατρική αξιολόγηση. Η επαναχορήγηση του Exubera απαιτεί προσεκτική αξιολόγηση κινδύνου και πρέπει να γίνεται μόνο υπό στενή ιατρική παρακολούθηση με κατάλληλες κλινικές εγκαταστάσεις.
Διαταραχή της αναπνευστικής ασθένειας
Το Exubera έχει χορηγηθεί σε ασθενείς με διαταραχές του αναπνευστικού συστήματος (π.χ. βρογχίτιδα, λοιμώξεις του ανώτερου αναπνευστικού συστήματος, ρινίτιδα) κατά τη διάρκεια κλινικών μελετών. Σε ασθενείς που αντιμετωπίζουν αυτές τις καταστάσεις, το 3-4% διακόπτει προσωρινά τη θεραπεία με το Exubera. Δεν παρατηρήθηκε αυξημένος κίνδυνος υπογλυκαιμίας ή επιδείνωση του γλυκαιμικού ελέγχου που παρατηρήθηκε σε ασθενείς που έλαβαν θεραπεία με Exubera σε σύγκριση με ασθενείς που έλαβαν υποδόρια ινσουλίνη. Κατά τη διάρκεια διαταραχών του αναπνευστικού συστήματος, μπορεί να απαιτηθεί στενή παρακολούθηση των συγκεντρώσεων γλυκόζης στο αίμα και προσαρμογή της δόσης.
Πληροφορίες για τους ασθενείς
Οι ασθενείς πρέπει να ενημερώνονται για τις διαδικασίες αυτοδιαχείρισης, συμπεριλαμβανομένης της παρακολούθησης της γλυκόζης. κατάλληλη τεχνική εισπνοής Exubera. και της υπογλυκαιμίας και της υπεργλυκαιμίας. Οι ασθενείς πρέπει να ενημερώνονται σχετικά με το χειρισμό ειδικών καταστάσεων, όπως διαταραχές (ασθένεια, άγχος ή συναισθηματική κατάσταση διαταραχές), ανεπαρκή ή παραλειφθείσα δόση ινσουλίνης, ακούσια χορήγηση αυξημένης δόσης ινσουλίνης, ανεπαρκής λήψη τροφής ή παραλείψει τα γεύματα.
Οι ασθενείς θα πρέπει να ενημερώνονται ότι σε κλινικές μελέτες, η θεραπεία με το Exubera συσχετίστηκε με μικρές, μη προοδευτικές μέσες μειώσεις πνευμονικής λειτουργίας σε σχέση με τις θεραπείες συγκριτή. Λόγω της επίδρασης του Exubera σε πνευμονική λειτουργία, συνιστώνται δοκιμές πνευμονικής λειτουργίας πριν από την έναρξη της θεραπείας με Exubera. Μετά την έναρξη της θεραπείας, συνιστώνται περιοδικές εξετάσεις πνευμονικής λειτουργίας (βλ ΠΡΟΦΥΛΑΞΕΙΣ Αναπνευστική, πνευμονική λειτουργία).
Οι ασθενείς θα πρέπει να ενημερώσουν τον γιατρό τους εάν έχουν ιστορικό πνευμονικής νόσου, επειδή δεν συνιστάται η χρήση του Exubera ασθενείς με υποκείμενη πνευμονική νόσο (π.χ. άσθμα ή COPD) και αντενδείκνυται σε ασθενείς με κακώς ελεγχόμενο πνεύμονα νόσος.
Οι γυναίκες με διαβήτη πρέπει να ενημερώνονται για να ενημερώσουν το γιατρό τους εάν είναι έγκυες ή σκέφτονται την εγκυμοσύνη.
μπλουζα
Αλληλεπιδράσεις με άλλα φάρμακα
Ορισμένες ουσίες επηρεάζουν τον μεταβολισμό της γλυκόζης και μπορεί να απαιτούν προσαρμογή της δόσης ινσουλίνης και ιδιαίτερα στενή παρακολούθηση.
Τα παρακάτω είναι παραδείγματα ουσιών που μπορούν να μειώσουν την επίδραση της ινσουλίνης στη μείωση της γλυκόζης του αίματος που μπορεί να οδηγήσει σε υπεργλυκαιμία: κορτικοστεροειδή, (π.χ., επινεφρίνη, αλβουτερόλη, τερβουταλίνη), γλυκαγόνη, ισονιαζίδη, παράγωγα φαινοθειαζίνης, σωματοτροπίνη, ορμόνες θυρεοειδούς, οιστρογόνα, προγεσταγόνα (π.χ. σε από του στόματος αντισυλληπτικά), αναστολείς πρωτεάσης και άτυπα αντιψυχωτικά φάρμακα (π.χ. ολανζαπίνη και κλοζαπίνη).
Τα παρακάτω είναι παραδείγματα ουσιών που μπορεί να αυξήσουν την επίδραση της ινσουλίνης στη μείωση της γλυκόζης αίματος και την ευαισθησία στην υπογλυκαιμία: από του στόματος αντιδιαβητικά προϊόντα, αναστολείς ΜΕΑ, δισοπυραμίδη, φιβράτες, φλουοξετίνη, αναστολείς ΜΑΟ, πεντοξυφυλλίνη, προποξυφαίνη, σαλικυλικά και σουλφοναμίδιο αντιβιοτικά.
Οι β-αναστολείς, η κλονιδίνη, τα άλατα λιθίου και η αλκοόλη μπορούν είτε να αυξήσουν είτε να μειώσουν την επίδραση της ινσουλίνης στη μείωση της γλυκόζης στο αίμα. Η πενταμιδίνη μπορεί να προκαλέσει υπογλυκαιμία, η οποία μπορεί μερικές φορές να ακολουθείται από υπεργλυκαιμία.
Επιπλέον, υπό την επίδραση των συμπαθολυτικών φαρμακευτικών προϊόντων όπως οι βήτα-αναστολείς, η κλονιδίνη, η γουανεθιδίνη και η ρεσερπίνη, τα σημεία και τα συμπτώματα της υπογλυκαιμίας μπορεί να μειωθούν ή να απουσιάζουν.
Τα βρογχοδιασταλτικά και άλλα εισπνεόμενα προϊόντα μπορεί να μεταβάλλουν την απορρόφηση της εισπνεόμενης ανθρώπινης ινσουλίνης (βλ ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ, Ειδικοί πληθυσμοί). Απαιτείται συνεπής χρονικός καθορισμός της δοσολογίας των βρογχοδιασταλτικών σε σχέση με τη χορήγηση του Exubera, η προσεκτική παρακολούθηση των συγκεντρώσεων γλυκόζης στο αίμα και η τιτλοποίηση της δόσης, ανάλογα με την περίπτωση.
Καρκινογένεση, Μεταλλαξογένεση, Βλάβη της Γονιμότητας
Δεν έχουν διεξαχθεί δύο χρόνια μελέτες καρκινογένεσης σε ζώα. Η ινσουλίνη δεν ήταν μεταλλαξιογόνος στη δοκιμή βακτηριακής ανάστροφης μετάλλαξης Ames παρουσία και απουσία μεταβολικής ενεργοποίησης.
Σε αρουραίους Sprague-Dawley, διεξήχθη μελέτη τοξικότητας επαναλαμβανόμενης δόσης 6 μηνών με σκόνη εισπνοής ινσουλίνης σε δόσεις έως και 5,8 mg / kg / ημέρα (σε σύγκριση με την κλινική αρχική δόση 0,15 mg / kg / ημέρα, η υψηλή δόση αρουραίου ήταν 39 φορές ή 8,3 φορές η κλινική δόση, με βάση είτε τη σύγκριση επιφάνειας σωματικού βάρους mg / kg είτε mg / m2). Στους πιθήκους Cynomolgus, διεξήχθη μια μελέτη τοξικότητας επαναλαμβανόμενης δόσης διάρκειας 6 μηνών με εισπνεόμενη ινσουλίνη σε δόσεις μέχρι 0,64 mg / kg / ημέρα. Σε σύγκριση με την κλινική αρχική δόση των 0,15 mg / kg / ημέρα, η υψηλή δόση πιθήκου ήταν 4,3 φορές ή 1,4 φορές η κλινική δόση, με βάση είτε τη σύγκριση σωματικού εμβαδού mg / kg είτε mg / m2. Αυτές ήταν μέγιστες ανεκτές δόσεις με βάση την υπογλυκαιμία.
Σε σύγκριση με τα ζώα ελέγχου, δεν παρατηρήθηκαν ανεπιθύμητες ενέργειες σχετιζόμενες με τη θεραπεία ούτε σε είδη με πνευμονική λειτουργία, ούτε σε βαριά ή μικροσκοπική μορφολογία της αναπνευστικής οδού ή σε βρογχικούς λεμφαδένες. Παρομοίως, δεν υπήρξε καμία επίδραση στους δείκτες πολλαπλασιασμού κυττάρων στην κυψελιδική ή βρογχιολική περιοχή του πνεύμονα και στα δύο είδη.
Επειδή η ανασυνδυασμένη ανθρώπινη ινσουλίνη είναι ταυτόσημη με την ενδογενή ορμόνη, δεν έχουν διεξαχθεί μελέτες αναπαραγωγής / γονιμότητας σε ζώα.
Εγκυμοσύνη
Τερατογόνες επιδράσεις
Κατηγορία εγκυμοσύνης C
Δεν έχουν διεξαχθεί μελέτες αναπαραγωγής σε ζώα με το Exubera. Επίσης, δεν είναι γνωστό εάν το Exubera μπορεί να προκαλέσει βλάβη στο έμβρυο όταν χορηγείται σε έγκυο γυναίκα ή εάν το Exubera μπορεί να επηρεάσει την αναπαραγωγική ικανότητα. Το Exubera πρέπει να χορηγείται σε έγκυο γυναίκα μόνο εάν είναι σαφώς απαραίτητο.
Θηλάζουσες μητέρες
Πολλά φάρμακα, συμπεριλαμβανομένης της ανθρώπινης ινσουλίνης, εκκρίνονται στο ανθρώπινο γάλα. Για το λόγο αυτό, πρέπει να δίδεται προσοχή όταν το Exubera χορηγείται σε μια νοσηλευτική γυναίκα. Οι ασθενείς με διαβήτη που θηλάζουν μπορεί να χρειαστούν προσαρμογές στη δόση του Exubera, στο σχέδιο γευμάτων ή και στα δύο.
Παιδιατρική χρήση
Η μακροχρόνια ασφάλεια και αποτελεσματικότητα του Exubera σε παιδιατρικούς ασθενείς δεν έχει τεκμηριωθεί (βλ ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ, Ειδικοί πληθυσμοί).
Γηριατρική χρήση
Στις ελεγχόμενες κλινικές μελέτες Φάσης 2/3 (n = 1975), το Exubera χορηγήθηκε σε 266 ασθενείς ηλικίας ≥ 65 ετών και 30 ασθενείς ηλικίας ≥ 75 ετών. Η πλειοψηφία αυτών των ασθενών είχε διαβήτη τύπου 2. Η αλλαγή στην HbA1C και ο ρυθμός υπογλυκαιμίας δεν διέφερε ανάλογα με την ηλικία.
μπλουζα
Ανεπιθύμητες ενέργειες
Η ασφάλεια του Exubera μόνο, ή σε συνδυασμό με υποδόρια ινσουλίνη ή από του στόματος, ήταν αξιολογήθηκε σε περίπου 2500 ενήλικες ασθενείς με διαβήτη τύπου 1 ή τύπου 2 στους οποίους εκτέθηκε Exubera. Περίπου 2000 ασθενείς εκτέθηκαν στο Exubera για περισσότερο από 6 μήνες και περισσότεροι από 800 ασθενείς εκτέθηκαν για περισσότερο από 2 χρόνια.
Μη αναπνευστικά ανεπιθύμητα συμβάντα
Οι μη αναπνευστικές ανεπιθύμητες ενέργειες που αναφέρθηκαν σε ≥ 1% των ασθενών που έλαβαν θεραπεία με Exubera το 1977 σε ελεγχόμενες κλινικές μελέτες Φάσης 2/3, ανεξαρτήτως αιτιότητας, περιλαμβάνουν (αλλά δεν περιορίζονται) τα ακόλουθα:
Μεταβολικά και θρεπτικά: υπογλυκαιμία (βλ ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ και ΠΡΟΦΥΛΑΞΕΙΣ)
Σώμα στο σύνολό του: πόνος στο στήθος
Πεπτικό: ξηροστομία
Ειδικές αισθήσεις: μέση ωτίτιδα (παιδιατρικοί διαβητικοί τύπου 1)
Υπογλυκαιμία
Οι ρυθμοί και η συχνότητα εμφάνισης της υπογλυκαιμίας ήταν συγκρίσιμοι μεταξύ του Exubera και της υποδόριας κανονικής ανθρώπινης ινσουλίνης σε ασθενείς με διαβήτη τύπου 1 και τύπου 2. Σε ασθενείς τύπου 2 οι οποίοι δεν ελέγχονταν επαρκώς με μονοθεραπεία από το στόμα, η προσθήκη Το Exubera συσχετίστηκε με υψηλότερο ποσοστό υπογλυκαιμίας από ό, τι η προσθήκη δεύτερης από του στόματος μέσο.
Πόνος στο στήθος
Μια ποικιλία διαφορετικών συμπτωμάτων στο θώρακα αναφέρθηκαν ως ανεπιθύμητες αντιδράσεις και ομαδοποιήθηκαν κάτω από τον μη ειδικό θωρακικό πόνο. Αυτά τα συμβάντα εμφανίστηκαν στο 4,7% των ασθενών που έλαβαν θεραπεία με Exubera και στο 3,2% των ασθενών στις ομάδες σύγκρισης. Η πλειοψηφία (> 90%) αυτών των περιστατικών αναφέρθηκε ως ήπια ή μέτρια. Δύο ασθενείς στο Exubera και ένας στην ομάδα σύγκρισης διέκοψαν τη θεραπεία λόγω θωρακικού πόνου. Η συχνότητα ανεπιθύμητων ενεργειών που σχετίζονται με τη νόσο της στεφανιαίας αρτηρίας, όπως η στηθάγχη ή το έμφραγμα του μυοκαρδίου, ήταν συγκρίσιμη στο Exubera (0,9% στηθάγχη, 0,7% έμφραγμα μυοκαρδίου) και συγκριτικό (1,3% στηθάγχη; 0,7% εμφράγματος του μυοκαρδίου).
Ξερό στόμα
Η ξηροστομία αναφέρθηκε στο 2,4% των ασθενών που έλαβαν θεραπεία με Exubera και στο 0,8% των ασθενών στις ομάδες σύγκρισης. Σχεδόν το σύνολο (> 98%) ξηροστομίας που αναφέρθηκε ήταν ήπιο ή μέτριο. Κανένας ασθενής δεν διέκοψε τη θεραπεία λόγω ξηροστομίας.
Συμβάντα αυτιών σε παιδιατρικούς διαβητικούς
Παιδιατρικοί διαβητικοί τύπου 1 στις ομάδες του Exubera εμφάνισαν ανεπιθύμητες ενέργειες που σχετίζονται με το αυτί συχνότερα από τους παιδιατρικούς διαβητικούς τύπου 1 στις ομάδες θεραπείας που έλαβαν μόνο υποδόρια ινσουλίνη. Αυτά τα περιστατικά περιλάμβαναν μέση ωτίτιδα (Exubera 6,5%; SC 3,4%), πόνος στο αυτί (Exubera 3,9%; SC 1,4%) και διαταραχή του αυτιού (Exubera 1,3%. SC 0%).
Αναπνευστικά ανεπιθύμητα συμβάντα
Ο Πίνακας 6 δείχνει τη συχνότητα εμφάνισης αναπνευστικών ανεπιθύμητων ενεργειών για κάθε ομάδα θεραπείας που αναφέρθηκαν σε ± 1% οποιασδήποτε ομάδας θεραπείας σε ελεγχόμενες κλινικές μελέτες Φάσης 2 και 3, ανεξαρτήτως αιτιότητας.
Πίνακας 6: Αναπνευστικά ανεπιθύμητα συμβάντα που αναφέρθηκαν σε ± 1% οποιουδήποτε θεραπευτικού ομίλου σε ελεγχόμενες κλινικές μελέτες φάσης 2 και 3, ανεξαρτήτως αιτιότητας
| Ποσοστό συμβάντων αναφοράς ασθενών | |||||
|---|---|---|---|---|---|
| Ανεπιθύμητη ενέργεια | Διαβήτης τύπου 1 | Διαβήτης τύπου 2 | |||
| Exubera Ν = 698 |
SC Ν = 705 |
Exubera Ν = 1279 |
SC Ν = 488 |
OAs Ν = 644 |
|
| SC = υποδόριος συγκριτής ινσουλίνης. ΟΑ = συγκριτές στοματικού παράγοντα | |||||
| Η μόλυνση του αναπνευστικού συστήματος | 43.3 | 42.0 | 29.2 | 38.1 | 19.7 |
| Βήχας Αυξημένος | 29.5 | 8.8 | 21.9 | 10.2 | 3.7 |
| Φαρυγγίτιδα | 18.2 | 16.6 | 9.5 | 9.6 | 5.9 |
| Ρινίτιδα | 14.5 | 10.9 | 8.8 | 10.5 | 3.0 |
| Ιγμορίτιδα | 10.3 | 7.4 | 5.4 | 10.0 | 2.3 |
| Αναπνευστική διαταραχή | 7.4 | 4.1 | 6.1 | 10.2 | 1.7 |
| Δύσπνοια | 4.4 | 0.9 | 3.6 | 2.5 | 1.4 |
| Πρήξιμο αυξημένο | 3.9 | 1.3 | 2.8 | 1.0 | 0.5 |
| Βρογχίτιδα | 3.2 | 4.1 | 5.4 | 3.9 | 4.0 |
| Βρογχικο Ασθμα | 1.3 | 1.3 | 2.0 | 2.3 | 0.5 |
| Επίσταξη | 1.3 | 0.4 | 1.2 | 0.4 | 0.8 |
| Λαρυγγίτιδα | 1.1 | 0.4 | 0.5 | 0.4 | 0.3 |
| Πνευμονία | 0.9 | 1.1 | 0.9 | 1.6 | 0.6 |
| Μεταβολή φωνής | 0.1 | 0.1 | 1.3 | 0.0 | 0.3 |
Βήχας
Σε 3 κλινικές μελέτες, οι ασθενείς που ολοκλήρωσαν ένα ερωτηματολόγιο για το βήχα ανέφεραν ότι ο βήχας τείνει να εμφανίζεται εντός δευτερόλεπτα έως λεπτά μετά την εισπνοή του Exubera, ήταν κατά κύριο λόγο ήπια σοβαρότητα και σπάνια ήταν παραγωγική φύση. Η συχνότητα εμφάνισης αυτού του βήχα μειώθηκε με τη συνεχή χρήση του Exubera. Σε ελεγχόμενες κλινικές μελέτες, το 1,2% των ασθενών διέκοψε τη θεραπεία με Exubera εξαιτίας του βήχα.
Δύσπνοια
Σχεδόν όλα (> 97%) της δύσπνοιας αναφέρθηκαν ως ήπια ή μέτρια. Ένας μικρός αριθμός ασθενών που έλαβαν θεραπεία με Exubera (0,4%) διέκοψε τη θεραπεία λόγω δύσπνοιας σε σύγκριση με 0,1% των ασθενών που έλαβαν θεραπεία με συγκριτή.
Άλλα αναπνευστικά ανεπιθύμητα συμβάματα - Φαρυγγίτιδα, αυξημένα πτύελα και επίσταξη
Η πλειοψηφία αυτών των περιστατικών αναφέρθηκε ως ήπια ή μέτρια. Ένας μικρός αριθμός ασθενών που έλαβαν θεραπεία με Exubera διέκοψε τη θεραπεία λόγω φαρυγγίτιδας (0,2%) και αυξημένα πτύελα (0,1%). κανένας ασθενής δεν διέκοψε τη θεραπεία λόγω επίσταξης.
Πνευμονική λειτουργία
Η επίδραση του Exubera στο αναπνευστικό σύστημα έχει αξιολογηθεί σε περισσότερους από 3800 ασθενείς σε ελεγχόμενες κλινικές μελέτες φάσης 2 και 3 (στις οποίες 1977 ασθενείς έλαβαν θεραπεία με Exubera). Σε τυχαιοποιημένες, ανοιχτές κλινικές δοκιμές διάρκειας μέχρι δύο ετών, οι ασθενείς έλαβαν θεραπεία με Exubera κατέδειξε μεγαλύτερη πτώση της πνευμονικής λειτουργίας, συγκεκριμένα τον εξαναγκασμένο εκπνεόμενο όγκο σε ένα δεύτερος (FEV1) και την ικανότητα διάχυσης μονοξειδίου του άνθρακα (DLCO), από τους ασθενείς που έλαβαν θεραπεία με συγκριτή. Οι μέσες διαφορές της ομάδας θεραπείας στον FEV1 και DLCO, σημειώθηκαν κατά τις πρώτες μερικές εβδομάδες θεραπείας με Exubera και δεν προχώρησαν κατά τη διάρκεια της διετούς περιόδου θεραπείας. Σε μία ολοκληρωμένη ελεγχόμενη κλινική δοκιμή σε ασθενείς με διαβήτη τύπου 2 μετά από διετή θεραπεία με Exubera, οι ασθενείς έδειξαν διαφορά της διαφοράς της ομάδας θεραπείας με FEV1 έξι εβδομάδες μετά τη διακοπή της θεραπείας. Η ανάλυση της επίδρασης του Exubera σε πνευμονική λειτουργία σε ασθενείς με διαβήτη τύπου 1 δεν έχει μελετηθεί μετά από μακροχρόνια θεραπεία.
Τα σχήματα 3 έως 6 εμφανίζουν το μέσο FEV1 και DLCO μεταβολή από την αρχική τιμή έναντι του χρόνου από δύο εξελισσόμενες τυχαιοποιημένες, ανοικτές, διετείς μελέτες σε 580 ασθενείς με τύπου 1 και 620 ασθενείς με διαβήτη τύπου 2.
Εικόνα 3: Μεταβολή από την αρχική τιμή FEV1 (L) σε ασθενείς με διαβήτη τύπου 1 (μέση +/- τυπική απόκλιση)
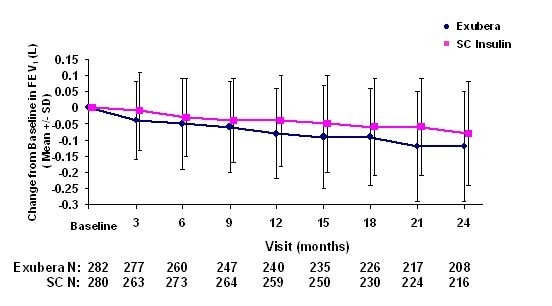
Σχήμα 4: Μεταβολή από την αρχική τιμή FEV1 (L) σε ασθενείς με διαβήτη τύπου 2 (μέση +/- τυπική απόκλιση)

Μετά από 2 χρόνια θεραπείας με Exubera σε ασθενείς με διαβήτη τύπου 1 και τύπου 2, η διαφορά μεταξύ των ομάδων θεραπείας για τη μέση αλλαγή από την αρχική FEV1 ήταν περίπου 40 mL, ευνοώντας το συγκριτή.
Εικόνα 5: Μεταβολή από τη βασική τιμή DLco (mL / min / mmHg) σε ασθενείς με διαβήτη τύπου 1 (μέση +/- τυπική απόκλιση)
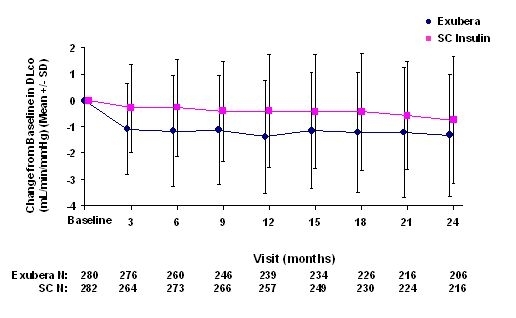
Σχήμα 6: Μεταβολή από την αρχική τιμή DLco (mL / min / mmHg) σε ασθενείς με διαβήτη τύπου 2 (μέση +/- τυπική απόκλιση)

Μετά από 2 χρόνια θεραπείας με Exubera, η διαφορά μεταξύ των ομάδων θεραπείας για τη μέση αλλαγή από την αρχική τιμή DLCO ήταν περίπου 0,5 ml / λεπτό / mmHg (διαβήτης τύπου 1), ευνοώντας τον συγκριτή και περίπου 0,1 ml / λεπτό / mmHg (διαβήτης τύπου 2), ευνοώντας το Exubera.
Κατά τη διάρκεια των διετών κλινικών δοκιμών, μεμονωμένοι ασθενείς παρουσίασαν αξιοσημείωτη πτώση της πνευμονικής λειτουργίας και στις δύο ομάδες θεραπείας. Μείωση από τον αρχικό FEV1 κατά ≥ 20% κατά την τελευταία παρατήρηση παρατηρήθηκε σε 1,5% των ασθενών που έλαβαν θεραπεία με συγκριτή με Exubera και 1,3% των ασθενών που έλαβαν θεραπεία με συγκριτή. Μείωση από την αρχική τιμή DLCO ≥ 20% κατά την τελευταία παρατήρηση παρατηρήθηκε σε 5,1% των ασθενών που έλαβαν θεραπεία με Exubera και 3,6% των ασθενών που έλαβαν θεραπεία με συγκριτικό φάρμακο.
μπλουζα
Υπερδοσολογία
Η υπογλυκαιμία μπορεί να συμβεί ως αποτέλεσμα της περίσσειας ινσουλίνης σε σχέση με την πρόσληψη τροφής, την ενεργειακή δαπάνη ή και τα δύο.
Τα ήπια έως μέτρια επεισόδια υπογλυκαιμίας συνήθως μπορούν να αντιμετωπιστούν με στοματική γλυκόζη. Μπορεί να χρειαστούν προσαρμογές στη δοσολογία του φαρμάκου, στα γεύματα ή στην άσκηση.
Τα σοβαρά επεισόδια υπογλυκαιμίας με κώμα, κρίση ή νευρολογική ανεπάρκεια μπορούν να αντιμετωπιστούν με ενδομυϊκή / υποδόρια γλυκαγόνη ή με συμπυκνωμένη ενδοφλέβια γλυκόζη. Η παρατεταμένη λήψη και παρακολούθηση υδατανθράκων μπορεί να είναι απαραίτητη επειδή η υπογλυκαιμία μπορεί να εμφανιστεί μετά από εμφανή κλινική ανάκαμψη.
μπλουζα
Δοσολογία και χορήγηση
Το Exubera, όπως τα ανάλογα ινσουλίνης ταχείας δράσης, έχει ταχύτερη έναρξη της δραστηριότητας μείωσης της γλυκόζης σε σύγκριση με την υποδόρια ένεση κανονικής ανθρώπινης ινσουλίνης. Το Exubera έχει διάρκεια δραστηριότητας μείωσης της γλυκόζης συγκρίσιμη με την υποδόρια ένεση κανονικής ανθρώπινης ινσουλίνης και μεγαλύτερη από την ινσουλίνη ταχείας δράσης. Οι δόσεις του Exubera πρέπει να χορηγούνται αμέσως πριν από τα γεύματα (όχι περισσότερο από 10 λεπτά πριν από κάθε γεύμα).
Σε ασθενείς με διαβήτη τύπου 1, το Exubera πρέπει να χρησιμοποιείται σε αγωγές που περιλαμβάνουν ινσουλίνη μακρύτερης διάρκειας. Για τους ασθενείς με διαβήτη τύπου 2, το Exubera μπορεί να χρησιμοποιηθεί ως μονοθεραπεία ή σε συνδυασμό με στοματικούς παράγοντες ή ινσουλίνη μακράς δράσης.
Λόγω της επίδρασης του Exubera στην πνευμονική λειτουργία, όλοι οι ασθενείς θα πρέπει να έχουν αξιολογηθεί η πνευμονική λειτουργία πριν την έναρξη της θεραπείας με Exubera. Για ασθενείς που λαμβάνουν θεραπεία με Exubera συνιστάται περιοδική παρακολούθηση της πνευμονικής λειτουργίας (βλ ΠΡΟΦΥΛΑΞΕΙΣ, Πνευμονική λειτουργία).
Το Exubera προορίζεται για χορήγηση με εισπνοή και πρέπει να χορηγείται μόνο με το Exubera® Εισπνευστήρ. Αναφέρομαι στο Οδηγός φαρμακευτικής αγωγής Exubera για μια περιγραφή του Exubera® Τον αναπνευστήρα και για οδηγίες σχετικά με τον τρόπο χρήσης της συσκευής εισπνοής.
Υπολογισμός της αρχικής δόσης του Exubera πριν από το γεύμα
Η αρχική δόση του Exubera θα πρέπει να εξατομικεύεται και να καθορίζεται με βάση τις συμβουλές του ιατρού σύμφωνα με τις ανάγκες του ασθενούς. Οι συνιστώμενες αρχικές δόσεις πριν από το γεύμα βασίζονται σε κλινικές δοκιμές στις οποίες οι ασθενείς κλήθηκαν να τρώνε τρία γεύματα την ημέρα. Οι αρχικές δόσεις πριν από το γεύμα μπορούν να υπολογιστούν χρησιμοποιώντας τον ακόλουθο τύπο: [Βάρος σώματος (kg) X 0,05 mg / kg = πριν από το γεύμα (mg)], στρογγυλεμένες προς τα κάτω στον πλησιέστερο αριθμό ολικού χιλιοστογράμματος (π.χ., 3,7 mg στρογγυλευμένα στο 3 mg).
Οι κατά προσέγγιση οδηγίες για τις αρχικές δόσεις Exubera πριν από το γεύμα, με βάση το σωματικό βάρος του ασθενούς, παρουσιάζονται στον Πίνακα 7:
Πίνακας 7: Κατά προσέγγιση κατευθυντήριες οδηγίες για την αρχική δόση Exubera πριν από το γεύμα (με βάση το σωματικό βάρος του ασθενούς)
| Βάρος ασθενούς (σε kg) |
Βάρος ασθενούς (σε lb) |
Αρχική δόση ανά γεύμα | Αριθμός κυψελίδων 1 mg ανά δόση | Αριθμός κυψελίδων 3 mg ανά δόση |
|---|---|---|---|---|
| 30 έως 39,9 kg | 66 - 87 λίβρες | 1 mg ανά γεύμα | 1 | - |
| 40 έως 59,9 kg | 88 - 132 λίβρες | 2 mg ανά γεύμα | 2 | - |
| 60 έως 79,9 kg | 133 - 176 λίβρες | 3 mg ανά γεύμα | - | 1 |
| 80 έως 99,9 kg | 177 - 220 λίβρες | 4 mg ανά γεύμα | 1 | 1 |
| 100 έως 119,9 kg | 221-246 λίβρες | 5 mg ανά γεύμα | 2 | 1 |
| 120 έως 139,9 kg | 265 - 308 λίβρες | 6 mg ανά γεύμα | - | 2 |
Μια κυψέλη 1 mg της εισπνεόμενης ινσουλίνης Exubera είναι περίπου ισοδύναμη με 3 IU υποδόρια εγχυμένης κανονικής ανθρώπινης ινσουλίνης. Μια κυψέλη 3 mg της εισπνεόμενης ινσουλίνης Exubera είναι περίπου ισοδύναμη με 8 IU υποδόρια εγχυμένης κανονικής ανθρώπινης ινσουλίνης. Ο Πίνακας 8 παρέχει την κατά προσέγγιση δόση IU κανονικής υποδόριας ανθρώπινης ινσουλίνης για δόσεις εισπνοής ινσουλίνης Exubera από 1 mg έως 6 mg.
Πίνακας 8: Κατά προσέγγιση ισοδύναμη ΔΜ Δόση κανονικής ανθρώπινης υποδόριας ινσουλίνης για δόσεις εισπνεόμενης ινσουλίνης Exubera που κυμαίνονται από 1 mg έως 6 mg
| Δόση (mg) | Κατά προσέγγιση κανονική ινσουλίνη SC δόση σε IU | Αριθμός κυψελίδων Exubera 1 mg ανά δόση | Αριθμός κυψελών Exubera 3 mg ανά δόση |
|---|---|---|---|
| 1 mg | 3 | 1 | - |
| 2 mg | 6 | 2 | - |
| 3 mg | 8 | - | 1 |
| 4 mg | 11 | 1 | 1 |
| 5 mg | 14 | 2 | 1 |
| 6 mg | 16 | - | 2 |
Οι ασθενείς θα πρέπει να συνδυάζουν κυψέλες 1 mg και 3 mg έτσι ώστε να λαμβάνεται ο μικρότερος αριθμός κυψελίδων ανά δόση (π.χ. μία δόση των 4 mg πρέπει να χορηγείται ως μία κυψέλη 1 mg και μία κυψέλη των 3 mg). Η διαδοχική εισπνοή τριών κυψελίδων μονάδων δόσης 1 mg έχει ως αποτέλεσμα σημαντικά μεγαλύτερη έκθεση στην ινσουλίνη από την εισπνοή μιας κυψέλης μονάδας δόσης των 3 mg. Επομένως, τρεις δόσεις των 1 mg δεν πρέπει να υποκαταστήσουν μία δόση των 3 mg (βλ ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ, Φαρμακοκινητική). Όταν ο ασθενής σταθεροποιείται σε δοσολογικό σχήμα που περιλαμβάνει κυψέλες 3 mg και κυψέλες 3 mg μπορεί προσωρινά να μην είναι διαθέσιμη, ο ασθενής μπορεί να αντικαταστήσει προσωρινά δύο κυψέλες 1 mg για ένα 3 mg φουσκάλα. Η γλυκόζη του αίματος πρέπει να παρακολουθείται στενά.
Όπως με όλες τις ινσουλίνες, πρόσθετοι παράγοντες που πρέπει να λαμβάνονται υπόψη κατά τον καθορισμό της δόσης έναρξης του Exubera περιλαμβάνουν, αλλά δεν περιορίζονται στον τρέχοντα γλυκαιμικό έλεγχο του ασθενούς, την προηγούμενη ανταπόκριση στην ινσουλίνη, τη διάρκεια του διαβήτη και τη διατροφή και την άσκηση συνήθειες.
Σκέψεις για την τιτλοποίηση της δόσης
Μετά την έναρξη της θεραπείας με Exubera, όπως και με άλλους παράγοντες μείωσης της γλυκόζης, μπορεί να απαιτηθεί προσαρμογή της δόσης με βάση το την ανάγκη του ασθενούς (π.χ. συγκεντρώσεις γλυκόζης στο αίμα, μέγεθος γεύματος και σύνθεση θρεπτικών ουσιών, ώρα της ημέρας και πρόσφατες ή αναμενόμενες άσκηση). Κάθε ασθενής πρέπει να τιτλοδοτείται στη βέλτιστη δοσολογία με βάση τα αποτελέσματα της παρακολούθησης της γλυκόζης αίματος.
Όπως και για όλες τις ινσουλίνες, η χρονική πορεία της δράσης του Exubera μπορεί να διαφέρει σε διαφορετικά άτομα ή σε διαφορετικούς χρόνους στο ίδιο άτομο.
Το Exubera μπορεί να χρησιμοποιηθεί κατά τη διάρκεια παροδικών αναπνευστικών ασθενειών (π.χ. βρογχίτιδα, λοίμωξη της ανώτερης αναπνευστικής οδού, ρινίτιδα). Μπορεί να απαιτείται στενή παρακολούθηση των συγκεντρώσεων της γλυκόζης στο αίμα και της προσαρμογής της δόσης σε μεμονωμένη βάση. Τα εισπνεόμενα φαρμακευτικά προϊόντα (π.χ. βρογχοδιασταλτικά) πρέπει να χορηγούνται πριν από τη χορήγηση του Exubera.
μπλουζα
Πώς παρέχεται
Exubera (ανθρώπινη ινσουλίνη [rDNA προέλευση]) Η σκόνη εισπνοής είναι διαθέσιμη σε κυψέλες μονάδων δόσης 1 mg και 3 mg. Οι κυψέλες διανέμονται σε διάτρητες κάρτες με έξι φυσαλίδες ανά μονάδα δόσης (PVC / Αλουμίνιο). Οι δύο δυνάμεις διαφοροποιούνται με έγχρωμη εκτύπωση και απτικές σημάνσεις που μπορούν να διαφοροποιηθούν με την αφή. Οι κυψέλες 1 mg και οι αντίστοιχες διάτρητες κάρτες εκτυπώνονται με πράσινο μελάνι και οι κάρτες σημειώνονται με μία υπερυψωμένη ράβδο. Οι κυψέλες των 3 mg και οι αντίστοιχες διάτρητες κάρτες τυπώνονται με μπλε μελάνι και οι κάρτες φέρουν τρεις ανυψωμένες ράβδους.
Πέντε κάρτες κυψέλης συσκευάζονται σε ένα διαφανές πλαστικό (PET) θερμοδιαμορφωμένο δίσκο. Κάθε δίσκος ΡΕΤ περιέχει επίσης ένα ξηραντικό και καλύπτεται με ένα διαφανές πλαστικό (PET) καπάκι. Ο δίσκος πέντε καρτών με κυψέλες (30 κυψέλες μονάδας δόσης) σφραγίζεται σε ένα φύλλο με φύλλα πολυουρεθάνης με αποξηραντικό.
Exubera (ανθρώπινη ινσουλίνη [rDNA προέλευσης]) Φουσκάλες για εισπνοή σκόνης, ένα Exubera® Αναπνευστήρας και αντικατάσταση του Exubera® Οι μονάδες απελευθέρωσης απαιτούνται για την έναρξη της θεραπείας με Exubera και παρέχονται στο κιτ Exubera. Μια πλήρως συναρμολογημένη συσκευή Exubera® Ο αναπνευστήρας αποτελείται από τη βάση εισπνευστήρα, έναν θάλαμο και ένα Exubera® Μονάδα απελευθέρωσης. Ένας πλήρως συναρμολογημένος αναπνευστήρας συσκευάζεται με ένα θάλαμο αντικατάστασης και διατίθεται στο κιτ Exubera και ως ξεχωριστή μονάδα. Το Επιμελητήριο είναι επίσης διαθέσιμο ως μεμονωμένο στοιχείο.
Exubera® Οι Μονάδες Απελευθέρωσης συσκευάζονται ξεχωριστά σε ένα σφραγισμένο θερμοδιαμορφωμένο δίσκο. Ένα Exubera® Η μονάδα απελευθέρωσης περιλαμβάνεται σε κάθε πλήρως συναρμολογημένο αναπνευστήρα. Δύο πρόσθετες μονάδες απελευθέρωσης παρέχονται στο κιτ Exubera και σε κάθε συνδυαστικό πακέτο. Οι μονάδες απελευθέρωσης Exubera διατίθενται επίσης ξεχωριστά.
Δείτε τους πίνακες 9 και 10 για μια περιγραφή αυτών των διαμορφώσεων.
Πίνακας 9
| Το Exubera (ανθρώπινη ινσουλίνη [rDNA προέλευσης]) Η σκόνη εισπνοής είναι διαθέσιμη ως εξής: | ||
|---|---|---|
| Περιγραφή | Περιεχόμενα | NDC |
| Exubera KIT | 1 αναπνευστήρας Exubera 1 Χώρος αντικατάστασης 1 mg Ã-180 φυσαλίδες 3 mg ü-90 κυψέλες 2 Exubera® Μονάδες απελευθέρωσης |
0069-0050-85 |
| Συσκευασία συνδυασμού Exubera 12 | 1 mg Ã- 90 κυψέλες 3 mg ü-90 κυψέλες 2 Exubera® Μονάδες απελευθέρωσης |
0069-0050-19 |
| Συσκευασία συνδυασμού Exubera 15 | 1 mg Ã-180 φυσαλίδες 3 mg ü-90 κυψέλες 2 Exubera® Μονάδες απελευθέρωσης |
0069-0050-53 |
| Πακέτο ασθενών με Exubera 1 mg | 90 α- 1 mg 2 Exubera® Μονάδες απελευθέρωσης |
0069-0707-37 |
| Πακέτο ασθενών με Exubera 3 mg | 90-3 mg 2 Exubera® Μονάδες απελευθέρωσης |
0069-0724-37 |
Πίνακας 10
| Exubera® Ο αναπνευστήρας και τα συστατικά είναι διαθέσιμα ως εξής: | ||
|---|---|---|
| Περιγραφή | Περιεχόμενα | NDC |
| Exubera® Εισπνευστήρας και θάλαμος | 1 Exubera® Εισπνευστήρ 1 Χώρος αντικατάστασης |
0069-0054-19 |
| Exubera® Μονάδες απελευθέρωσης | 2 Exubera® Μονάδες απελευθέρωσης | 0069-0097-41 |
| Exubera® θάλαμος - Δωμάτιο | 1 Χώρος αντικατάστασης | 0069-0061-19 |
Αποθήκευση φυσαλίδων
Μη χρησιμοποιημένο (μη ανοιγμένο): Φυλάσσεται σε ελεγχόμενη θερμοκρασία δωματίου, 25 ° C (77 ° F). επιτρέπονται εκδρομές στους 15-30 ° C (59-86 ° F) [βλέπε USP Ελεγχόμενη θερμοκρασία δωματίου]. Μην καταψύχετε. Μην ψύχετε.
Κατά τη χρήση: Μόλις ανοίξει το περιτύλιγμα του φύλλου, οι φουσκάλες μοναδιαίας δόσης πρέπει να προστατεύονται από την υγρασία, να αποθηκεύονται στους 25 ° C (77 ° F). επιτρέπονται εκδρομές στους 15-30 ° C (59-86 ° F) [βλέπε USP Ελεγχόμενη θερμοκρασία δωματίου]. Μην καταψύχετε. Μην ψύχετε. Οι φουσκάλες μοναδιαίας δόσης πρέπει να χρησιμοποιούνται εντός 3 μηνών από το άνοιγμα του περιτυλίγματος του φύλλου. Επιστρέψτε τις κυψέλες στο περιτύλιγμα για προστασία από την υγρασία. Πρέπει να ληφθεί πρόσθετη μέριμνα για την αποφυγή υγρού περιβάλλοντος, π.χ. αττικό μπάνιο μετά από ένα ντους.
Απορρίψτε την κυψέλη εάν έχει καταψυχθεί.
Αποθήκευση εισπνοών
Φυλάσσεται σε ελεγχόμενη θερμοκρασία δωματίου, 25 ° C (77 ° F). επιτρέπονται εκδρομές στους 15-30 ° C (59-86 ° F) [βλέπε USP Ελεγχόμενη θερμοκρασία δωματίου]. Μην καταψύχετε. Μην ψύχετε.
Το Exubera® Ο αναπνευστήρας μπορεί να χρησιμοποιηθεί έως και 1 έτος από την ημερομηνία της πρώτης χρήσης.
Αντικατάσταση του Exubera® Μονάδα απελευθέρωσης
Το Exubera® Μονάδα απελευθέρωσης στο Exubera® Ο αναπνευστήρας πρέπει να αλλάζεται κάθε 2 εβδομάδες.
Να φυλάσσεται μακριά από παιδιά
Rx μόνο

LAB-0331-12.0
τελευταία αναθεώρηση 04/2008
Exubera, ανθρώπινη ινσουλίνη [rDNA προέλευση] Πληροφορίες για τον ασθενή (στην απλή αγγλική γλώσσα)
Λεπτομερείς πληροφορίες για σημεία, συμπτώματα, αιτίες, θεραπείες διαβήτη
Οι πληροφορίες σε αυτή τη μονογραφία δεν προορίζονται να καλύψουν όλες τις πιθανές χρήσεις, οδηγίες, προφυλάξεις, αλληλεπιδράσεις φαρμάκων ή ανεπιθύμητες ενέργειες. Αυτές οι πληροφορίες είναι γενικευμένες και δεν προορίζονται ως συγκεκριμένες ιατρικές συμβουλές. Εάν έχετε απορίες σχετικά με τα φάρμακα που παίρνετε ή θέλετε περισσότερες πληροφορίες, επικοινωνήστε με το γιατρό σας, το φαρμακοποιό ή τη νοσοκόμα σας.
πίσω στο: Περιηγηθείτε σε όλα τα φάρμακα για τον διαβήτη



