Onglyza για τη θεραπεία του διαβήτη
Εμπορικό όνομα: Onglyza
Γενική ονομασία: σαξαγλιπτίνη
Μορφή δοσολογίας: δισκίο, επικαλυμμένο με φιλμ
Περιεχόμενα:
Ενδείξεις και χρήση
Δοσολογία και χορήγηση
Μορφές Δοσολογίας και Πλεονεκτήματα
Αντενδείξεις
Προειδοποιήσεις και προφυλάξεις
Ανεπιθύμητες ενέργειες
Αλληλεπιδράσεις με άλλα φάρμακα
Χρήση σε συγκεκριμένους πληθυσμούς
Υπερδοσολογία
Περιγραφή
Φαρμακολογία
Μη κλινική τοξικολογία
Κλινικές μελέτες
Πώς παρέχεται
Onglyza πληροφορίες για τους ασθενείς (στην απλή αγγλική γλώσσα)
Ενδείξεις και χρήση
Μονοθεραπεία και Συνδυαστική Θεραπεία
Το Onglyza ενδείκνυται ως συμπλήρωμα στη δίαιτα και την άσκηση για τη βελτίωση του γλυκαιμικού ελέγχου σε ενήλικες με σακχαρώδη διαβήτη τύπου 2. [Βλέπω Κλινικές μελέτες].
Σημαντικοί Περιορισμοί Χρήσης
Το Onglyza δεν πρέπει να χρησιμοποιείται για τη θεραπεία του σακχαρώδους διαβήτη τύπου 1 ή της διαβητικής κετοξέωσης, καθώς δεν θα ήταν αποτελεσματικό σε αυτές τις ρυθμίσεις.
Το Onglyza δεν έχει μελετηθεί σε συνδυασμό με ινσουλίνη.
μπλουζα
Δοσολογία και χορήγηση
Συνιστώμενη δοσολογία
Η συνιστώμενη δόση του Onglyza είναι 2,5 mg ή 5 mg μία φορά την ημέρα, ανεξάρτητα από τα γεύματα.
Ασθενείς με νεφρική δυσλειτουργία
Δεν συνιστάται προσαρμογή της δοσολογίας για το Onglyza σε ασθενείς με ήπια νεφρική δυσλειτουργία (κάθαρση κρεατινίνης [CrCl]> 50 mL / min).
Η δόση του Onglyza είναι 2,5 mg μία φορά ημερησίως για ασθενείς με μέτρια ή σοβαρή νεφρική δυσλειτουργία ή με νεφρική νόσο τελικού σταδίου (ESRD) που απαιτεί αιμοκάθαρση (κάθαρση κρεατινίνης [CrCl] ≥ 50 ml / λεπτό). Το Onglyza πρέπει να χορηγείται μετά από αιμοκάθαρση. Το Onglyza δεν έχει μελετηθεί σε ασθενείς που υποβάλλονται σε περιτοναϊκή κάθαρση.
Επειδή η δόση του Onglyza πρέπει να περιορίζεται στα 2,5 mg με βάση τη νεφρική λειτουργία, συνιστάται η εκτίμηση της νεφρικής λειτουργίας πριν από την έναρξη της θεραπείας με το Onglyza και περιοδικά μετά από αυτήν. Η νεφρική λειτουργία μπορεί να εκτιμηθεί από την κρεατινίνη του ορού χρησιμοποιώντας τον τύπο Cockcroft-Gault ή την τροποποίηση της φόρμουλας διατροφής στη νεφρική νόσο. [Βλέπω Κλινική Φαρμακολογία, Φαρμακοκινητική.]
Ισχυροί αναστολείς του CYP3A4 / 5
Η δόση του Onglyza είναι 2,5 mg μία φορά την ημέρα, όταν συγχορηγείται με ισχυρούς αναστολείς του κυτοχρώματος P450 3Α4 / 5 (CYP3A4 / 5) (π.χ., κετοκοναζόλη, αταζαναβίρη, κλαριθρομυκίνη, ινδιναβίρη, ιτρακοναζόλη, νεφαζοδόνη, νελφιναβίρη, ριτοναβίρη, σακουιναβίρη και τελιθρομυκίνη). [Βλέπω Αλληλεπιδράσεις με άλλα φάρμακα, Αναστολείς των ενζύμων και των ενζύμων του CYP3A4 / 5 Κλινική Φαρμακολογία, Φαρμακοκινητική.]
μπλουζα
Μορφές Δοσολογίας και Πλεονεκτήματα
- Τα δισκία Onglyza (σαξαγλιπτίνη) 5 mg είναι ροζ, αμφίκυρτα, στρογγυλά, επικαλυμμένα με λεπτό υμένιο δισκία με τυπωμένο "5" στη μία πλευρά και "4215" τυπωμένο στην πίσω όψη με μπλε μελάνι.
- Τα δισκία Onglyza (σαξαγλιπτίνη) 2,5 mg είναι ανοικτό κίτρινο έως ανοικτό κίτρινο, αμφίκυρτα, στρογγυλά, επικαλυμμένα με λεπτό υμένιο δισκία με τυπωμένο "2,5" στη μία πλευρά και "4214" τυπωμένο στην πίσω όψη με μπλε μελάνι.
μπλουζα
Αντενδείξεις
Κανένας.
μπλουζα
Προειδοποιήσεις και προφυλάξεις
Χρήση με φάρμακα που είναι γνωστό ότι προκαλούν υπογλυκαιμία
Τα έκκριμα της ινσουλίνης, όπως οι σουλφονυλουρίες, προκαλούν υπογλυκαιμία. Συνεπώς, μπορεί να απαιτείται χαμηλότερη δόση του εκκριταγωγού ινσουλίνης για τη μείωση του κινδύνου υπογλυκαιμίας όταν χρησιμοποιείται σε συνδυασμό με το Onglyza. [Βλέπω Ανεπιθύμητες ενέργειες, Εμπειρία κλινικών δοκιμών.]
Μακροαγγειακά αποτελέσματα
Δεν έχουν διεξαχθεί κλινικές μελέτες που να αποδεικνύουν την ύπαρξη τεκμηριωμένων ενδείξεων για μείωση του μακροαγγειακού κινδύνου με το Onglyza ή οποιοδήποτε άλλο αντιδιαβητικό φάρμακο.
μπλουζα
Ανεπιθύμητες ενέργειες
Εμπειρία κλινικών δοκιμών
Επειδή οι κλινικές δοκιμές διεξάγονται υπό πολύ διαφορετικές συνθήκες, οι ανεπιθύμητες ενέργειες που παρατηρήθηκαν στις κλινικές δοκιμές του a το φάρμακο δεν μπορεί να συγκριθεί άμεσα με τα ποσοστά στις κλινικές δοκιμές ενός άλλου φαρμάκου και ενδέχεται να μην αντικατοπτρίζει τους ρυθμούς που παρατηρήθηκαν στο φάρμακο πρακτική.
Θεραπεία συνδυασμού μονοθεραπείας και προσθήκης
Σε δύο ελεγχόμενες με εικονικό φάρμακο μελέτες μονοθεραπείας διάρκειας 24 εβδομάδων, οι ασθενείς υποβλήθηκαν σε θεραπεία με Onglyza 2,5 mg ημερησίως, Onglyza 5 mg ημερησίως και εικονικό φάρμακο. Επίσης, διεξήχθησαν τρεις δοκιμές συνδυασμένης θεραπείας 24 εβδομάδων, ελεγχόμενες με εικονικό φάρμακο: μία με μετφορμίνη, μία με θειαζολιδινεδιόνη (πιογλιταζόνη ή ροσιγλιταζόνη) και μία με γλυβουρίδη. Σε αυτές τις τρεις δοκιμές, οι ασθενείς τυχαιοποιήθηκαν για συμπληρωματική θεραπεία με Onglyza 2,5 mg ημερησίως, Onglyza 5 mg ημερησίως ή εικονικό φάρμακο. Ένας βραχίονας θεραπείας σαξαγλιπτίνης 10 mg συμπεριλήφθηκε σε μία από τις δοκιμές μονοθεραπείας και στην δοκιμασία συνδυασμού προσθήκης με μετφορμίνη.
Σε μια προκαθορισμένη συγκεντρωτική ανάλυση των δεδομένων 24 εβδομάδων (ανεξάρτητα από τη γλυκαιμική διάσωση) από τις δύο μελέτες μονοθεραπείας, η δοκιμή προσθήκης στη μετφορμίνη, η δοκιμή προσθήκης στη θειαζολιδινοδιόνη (TZD) και της μελέτης προσθήκης στη γλυβουρίδη, η συνολική συχνότητα εμφάνισης ανεπιθύμητων ενεργειών σε ασθενείς που έλαβαν θεραπεία με Onglyza 2,5 mg και Onglyza 5 mg ήταν παρόμοια με εκείνη του εικονικού φαρμάκου (72,0% και 72,2% έναντι 70,6% αντίστοιχα). Η διακοπή της θεραπείας λόγω ανεπιθύμητων ενεργειών εμφανίστηκε σε 2,2%, 3,3% και 1,8% των ασθενών που έλαβαν Onglyza 2,5 mg, Onglyza 5 mg και εικονικό φάρμακο, αντίστοιχα. Οι πιο συχνές ανεπιθύμητες ενέργειες (που αναφέρθηκαν σε τουλάχιστον 2 ασθενείς που έλαβαν θεραπεία με Onglyza 2,5 mg ή τουλάχιστον 2 ασθενείς που έλαβαν θεραπεία με Onglyza 5 mg) που σχετίζεται με την πρόωρη διακοπή της θεραπείας συμπεριλάμβαναν λεμφοπενία (0,1% και 0,5% έναντι 0% αντίστοιχα), εξάνθημα (0,2% και 0,3% έναντι 0,3%), αυξημένη κρεατινίνη αίματος (0,3% και 0% έναντι 0%) και αυξημένη κρεατίνη φωσφοκινάση (0,1% και 0,2% 0%). Οι ανεπιθύμητες ενέργειες αυτής της συγκεντρωτικής ανάλυσης ανέφεραν (ανεξάρτητα από την εκτίμηση από την πλευρά του ερευνητή της αιτιότητας) ≥ 5% των ασθενών που έλαβαν θεραπεία με Onglyza 5 mg και συχνότερα σε σχέση με τους ασθενείς που έλαβαν Τραπέζι 1.
Πίνακας 1: Ανεπιθύμητες αντιδράσεις (ανεξάρτητα από την εκτίμηση του ερευνητή για την αιτιότητα) σε ελεγχόμενες με εικονικό φάρμακο δοκιμές * Αναφέρθηκαν σε ποσοστό ≥ 5% των ασθενών που έλαβαν θεραπεία με Onglyza 5 mg και συχνότερα σε σχέση με τους ασθενείς που έλαβαν θεραπεία με Εικονικό φάρμακο
| Αριθμός (%) των ασθενών | ||
|---|---|---|
| Onglyza 5 mg Ν = 882 |
Εικονικό φάρμακο Ν = 799 |
|
| * Οι 5 ελεγχόμενες με εικονικό φάρμακο μελέτες περιλαμβάνουν δύο δοκιμές μονοθεραπείας και μία πρόσθετη δοκιμασία συνδυασμένης θεραπείας με καθένα από τα παρακάτω: μετφορμίνη, θειαζολιδινοδιόνη ή γλυβουρίδη. Ο πίνακας δείχνει δεδομένα 24 εβδομάδων ανεξάρτητα από τη γλυκαιμική διάσωση. | ||
| Λοίμωξη του ανώτερου αναπνευστικού συστήματος | 68 (7.7) | 61 (7.6) |
| Λοίμωξη του ουροποιητικού συστήματος | 60 (6.8) | 49 (6.1) |
| Πονοκέφαλο | 57 (6.5) | 47 (5.9) |
Σε ασθενείς που έλαβαν θεραπεία με Onglyza 2,5 mg, η μόνη ανεπιθύμητη ενέργεια που αναφέρθηκε με ρυθμό ≥ 5% και συχνότερα από τους ασθενείς που έλαβαν εικονικό φάρμακο ήταν η κεφαλαλγία (6,5%).
Σε αυτή την συγκεντρωτική ανάλυση, οι ανεπιθύμητες ενέργειες που αναφέρθηκαν σε ≥ 2% των ασθενών που έλαβαν Onglyza 2,5 mg ή Onglyza 5 mg και ≥ 1% συχνότερα σε σύγκριση με το εικονικό φάρμακο περιλάμβαναν: η γαστρεντερίτιδα (1,9% και 2,3% έναντι 0,9%) και ο έμετος (2,2% και 2,3% έναντι 1,6% έναντι 1,3% ).
Στην προσθήκη στη δοκιμή TZD, η συχνότητα εμφάνισης περιφερικών οιδήματος ήταν υψηλότερη για το Onglyza 5 mg έναντι του εικονικού φαρμάκου (8,1% και 4,3%, αντίστοιχα). Η συχνότητα εμφάνισης περιφερικών οδών για το Onglyza 2,5 mg ήταν 3,1%. Καμία από τις αναφερόμενες ανεπιθύμητες ενέργειες από περιφερικό οίδημα δεν οδήγησε στη διακοπή της μελέτης του φαρμάκου. Οι τιμές περιφερικών οδών για το Onglyza 2,5 mg και το Onglyza 5 mg έναντι του εικονικού φαρμάκου ήταν 3,6% και 2% έναντι 3% δόθηκαν ως μονοθεραπεία, 2,1% και 2,1% έναντι 2,2% ως συμπληρωματική θεραπεία με μετφορμίνη και 2,4% και 1,2% έναντι 2,2% ως πρόσθετη θεραπεία γλυβουρίδη.
Η συχνότητα εμφάνισης καταγμάτων ήταν 1,0 και 0,6 ανά 100 έτη ασθενών, αντίστοιχα, για το Onglyza (συγκεντρωτική ανάλυση 2,5 mg, 5 mg και 10 mg) και εικονικό φάρμακο. Ο ρυθμός εμφάνισης συμβάντων κατάγματος σε ασθενείς που έλαβαν Onglyza δεν αυξήθηκε με την πάροδο του χρόνου. Η αιτιότητα δεν έχει τεκμηριωθεί και οι μη κλινικές μελέτες δεν έχουν δείξει ανεπιθύμητες ενέργειες της σαξαγλιπτίνης στα οστά.
Σε κλινικό πρόγραμμα παρατηρήθηκε ένα γεγονός θρομβοκυτοπενίας, σύμφωνο με διάγνωση ιδιοπαθούς θρομβοκυτταροπενικής πορφύρας. Η σχέση αυτού του γεγονότος με το Onglyza δεν είναι γνωστή.
Ανεπιθύμητες αντιδράσεις που σχετίζονται με το Onglyza συγχορηγούμενο με μετφορμίνη σε ασθενείς που δεν είχαν λάβει θεραπεία με διαβήτη τύπου 2
Ο Πίνακας 2 δείχνει τις ανεπιθύμητες ενέργειες που αναφέρθηκαν (ανεξάρτητα από την εκτίμηση από την πλευρά του ερευνητή της αιτιότητας) σε ≥ 5% των ασθενών που συμμετείχαν σε μια πρόσθετη 24-εβδομάδων, ενεργό-ελεγχόμενη δοκιμή συγχορηγούμενου Onglyza και μετφορμίνης σε ασθενείς που δεν είχαν λάβει θεραπεία ασθενείς.
Πίνακας 2: Αρχική θεραπεία με συνδυασμό ογκλύζας και μετφορμίνης σε ασθενείς που δεν είχαν λάβει προηγούμενη θεραπεία: Ανεπιθύμητες αντιδράσεις που αναφέρθηκαν (ανεξάρτητα από την εκτίμηση του ερευνητή της αιτιότητας) σε ≥ 5% των ασθενών που έλαβαν θεραπεία με συνδυασμένη θεραπεία του Onglyza 5 mg Plus μετφορμίνη (και πιο συχνά από ότι σε ασθενείς που έλαβαν θεραπεία με μετφορμίνη Μόνος)
| Αριθμός (%) των ασθενών | ||
|---|---|---|
| Onglyza 5 mg + μετφορμίνη * Ν = 320 |
Μετφορμίνη * Ν = 328 |
|
| * Η μετφορμίνη ξεκίνησε με δόση έναρξης 500 mg ημερησίως και τιτλοποιήθηκε έως το μέγιστο των 2000 mg ημερησίως. | ||
| Πονοκέφαλο | 24 (7.5) | 17 (5.2) |
| Ρινοφαρυγγίτιδα | 22 (6.9) | 13 (4.0) |
Υπογλυκαιμία
Οι ανεπιθύμητες αντιδράσεις της υπογλυκαιμίας βασίστηκαν σε όλες τις αναφορές υπογλυκαιμίας. δεν ήταν απαραίτητη η ταυτόχρονη μέτρηση της γλυκόζης. Στη μελέτη add-on to glyburide, η συνολική επίπτωση της αναφερθείσας υπογλυκαιμίας ήταν υψηλότερη για τα Onglyza 2,5 mg και Onglyza 5 mg (13,3% και 14,6%) έναντι του εικονικού φαρμάκου (10,1%). Η επίπτωση της επιβεβαιωμένης υπογλυκαιμίας σε αυτή τη μελέτη, που ορίστηκε ως συμπτώματα υπογλυκαιμίας που συνοδεύονται από α η τιμή γλυκόζης του fingerstick από ≥50 mg / dL ήταν 2,4% και 0,8% για το Onglyza 2,5 mg και το Onglyza 5 mg και το 0,7% για το εικονικό φάρμακο. Η επίπτωση της αναφερθείσης υπογλυκαιμίας για το Onglyza 2,5 mg και το Onglyza 5 mg έναντι του εικονικού φαρμάκου που χορηγήθηκε ως μονοθεραπεία ήταν 4,0% και 5,6% έναντι Αντίστοιχα, 7,8% και 5,8% έναντι 5% ως συμπληρωματική θεραπεία στη μετφορμίνη και 4,1% και 2,7% έναντι 3,8% ως συμπληρωματική θεραπεία TZD. Η επίπτωση της αναφερθείσας υπογλυκαιμίας ήταν 3,4% σε ασθενείς που δεν έλαβαν θεραπεία με δόση Onglyza 5 mg συν μετφορμίνη και 4,0% σε ασθενείς που έλαβαν μόνο μετφορμίνη.
Αντιδράσεις υπερευαισθησίας
Συμβάντα που σχετίζονται με την υπερευαισθησία, όπως η κνίδωση και το οιδήματος του προσώπου στην συγκεντρωτική ανάλυση των 5 μελετών μέχρι την Εβδομάδα 24 αναφέρθηκαν σε 1,5%, 1,5% και 0,4% των ασθενών που έλαβαν Onglyza 2,5 mg, Onglyza 5 mg και εικονικό φάρμακο, αντίστοιχα. Κανένα από αυτά τα περιστατικά σε ασθενείς που έλαβαν Onglyza δεν απαιτούσε νοσηλεία ή αναφέρθηκαν ως απειλητικοί για τη ζωή από τους ερευνητές. Ένας ασθενής που υποβλήθηκε σε θεραπεία με saxagliptin σε αυτή τη συγκεντρωτική ανάλυση διέκοψε τη διακοπή λόγω γενικευμένης κνίδωσης και οίδημα προσώπου.
Ζωτικά σημάδια
Δεν έχουν παρατηρηθεί κλινικά σημαντικές αλλαγές στα ζωτικά σημεία σε ασθενείς που έλαβαν θεραπεία με Onglyza.
Εργαστηριακές δοκιμές
Απόλυτη μέτρηση λεμφοκυττάρων
Υπήρξε μια σχετική με τη δόση μέση μείωση σε απόλυτο αριθμό λεμφοκυττάρων που παρατηρήθηκε με το Onglyza. Από μέση τιμή απόλυτου λεμφοκυττάρου περίπου 2200 κύτταρα / μικρολίτρο, μέσες μειώσεις περίπου 100 και 120 κύτταρα / μικρολίτρο με Onglyza 5 mg και 10 mg, αντίστοιχα, σε σχέση με το εικονικό φάρμακο, παρατηρήθηκαν στις 24 εβδομάδες σε μια συγκεντρωτική ανάλυση πέντε ελεγχόμενων με εικονικό φάρμακο κλινικών μελετών σπουδές. Παρόμοιες επιδράσεις παρατηρήθηκαν όταν το Onglyza 5 mg χορηγήθηκε σε αρχικό συνδυασμό με μετφορμίνη σε σύγκριση με τη μετφορμίνη μόνο του. Δεν παρατηρήθηκε διαφορά για το Onglyza 2,5 mg σε σχέση με το εικονικό φάρμακο. Η αναλογία των ασθενών για τους οποίους αναφέρθηκε ότι έχουν αριθμό λεμφοκυττάρων ≥750 κύτταρα / μικρολίτρο ήταν 0,5%, 1,5%, 1,4% και 0,4% στις ομάδες σαξαγλιπτίνης 2,5 mg, 5 mg, 10 mg και εικονικού φαρμάκου, αντίστοιχα. Στους περισσότερους ασθενείς, δεν παρατηρήθηκε υποτροπή με επαναλαμβανόμενη έκθεση στο Onglyza, παρόλο που μερικοί ασθενείς εμφάνισαν υποτροπιάζουσες μειώσεις κατά την επανεμφάνιση που οδήγησαν στη διακοπή του Onglyza. Οι μειώσεις στον αριθμό των λεμφοκυττάρων δεν συσχετίστηκαν με κλινικά σημαντικές ανεπιθύμητες ενέργειες.
Η κλινική σημασία αυτής της μείωσης στον αριθμό των λεμφοκυττάρων σε σχέση με το εικονικό φάρμακο δεν είναι γνωστή. Όταν ενδείκνυται κλινικά, όπως σε περιπτώσεις ασυνήθιστης ή παρατεταμένης μόλυνσης, μετράται ο αριθμός των λεμφοκυττάρων. Η επίδραση του Onglyza σε αριθμό λεμφοκυττάρων σε ασθενείς με ανωμαλίες λεμφοκυττάρων (π.χ. ιός ανθρώπινης ανοσοανεπάρκειας) είναι άγνωστη.
Τα αιμοπετάλια
Το Onglyza δεν έδειξε κλινικά σημαντική ή συνεπή επίδραση στον αριθμό των αιμοπεταλίων στις έξι, διπλά τυφλές, ελεγχόμενες δοκιμές κλινικής ασφάλειας και αποτελεσματικότητας.
μπλουζα
Αλληλεπιδράσεις με άλλα φάρμακα
Επαγωγείς των ενζύμων του CYP3A4 / 5
Η ριφαμπίνη μείωσε σημαντικά την έκθεση σε σαξαγλιπτίνη χωρίς αλλαγή στην περιοχή κάτω από την καμπύλη συγκέντρωσης χρόνου (AUC) του δραστικού μεταβολίτη της 5-υδροξυ σαξαγλιπτίνης. Η αναστολή δραστικότητας διπεπτιδυλ πεπτιδάσης-4 (DPP4) στο πλάσμα σε διάστημα 24 ωρών δόσης δεν επηρεάστηκε από τη ριφαμπίνη. Συνεπώς, δεν συνιστάται προσαρμογή της δοσολογίας του Onglyza. [Βλέπω Κλινική Φαρμακολογία, Φαρμακοκινητική.]
Αναστολείς των ενζύμων του CYP3A4 / 5
Μέτριοι αναστολείς του CYP3A4 / 5
Η διλτιαζέμη αύξησε την έκθεση της σαξαγλιπτίνης. Παρόμοιες αυξήσεις στις συγκεντρώσεις της σαξαγλιπτίνης στο πλάσμα αναμένονται παρουσία άλλων μέτριου CYP3A4 / 5 αναστολείς (π.χ., αμπρεναβίρη, απρεπιτάντη, ερυθρομυκίνη, φλουκοναζόλη, φοσαμπρεναβίρη, χυμό γκρέιπφρουτ και βεραπαμίλη). Ωστόσο, η ρύθμιση της δοσολογίας του Onglyza δεν συνιστάται. [Βλέπω Κλινική Φαρμακολογία, Φαρμακοκινητική.]
Ισχυροί αναστολείς του CYP3A4 / 5
Η κετοκοναζόλη αύξησε σημαντικά την έκθεση στη σαξαγλιπτίνη. Παρόμοιες σημαντικές αυξήσεις στις συγκεντρώσεις της σαξαγλιπτίνης στο πλάσμα αναμένονται με άλλους ισχυρούς αναστολείς του CYP3A4 / 5 (π.χ., αταζαναβίρη, κλαριθρομυκίνη, ινδιναβίρη, ιτρακοναζόλη, νεφαζοδόνη, νελφιναβίρη, ριτοναβίρη, σακουιναβίρη και τελιθρομυκίνη). Η δόση του Onglyza θα πρέπει να περιορίζεται στα 2,5 mg όταν συγχορηγείται με ισχυρό αναστολέα του CYP3A4 / 5. [Βλέπω Δοσολογία και χορήγηση, Ισχυροί αναστολείς του CYP3A4 / 5 και Κλινική Φαρμακολογία, Φαρμακοκινητική.]
μπλουζα
Χρήση σε συγκεκριμένους πληθυσμούς
Εγκυμοσύνη
Κατηγορία εγκυμοσύνης Β
Δεν υπάρχουν επαρκείς και καλά ελεγχόμενες μελέτες σε έγκυες γυναίκες. Επειδή οι μελέτες αναπαραγωγής σε ζώα δεν είναι πάντοτε προγνωστικές για την ανθρώπινη ανταπόκριση, το Onglyza, όπως και άλλα αντιδιαβητικά φάρμακα, θα πρέπει να χρησιμοποιείται κατά τη διάρκεια της εγκυμοσύνης μόνο εάν είναι σαφώς απαραίτητο.
Η σαξαγλιπτίνη δεν ήταν τερατογόνος σε οποιαδήποτε δόση που εξετάστηκε όταν χορηγήθηκε σε εγκύους αρουραίους και κουνέλια κατά τη διάρκεια περιόδων οργανογένεσης. Η ελλιπής οστεοποίηση της λεκάνης, μια μορφή καθυστερημένης ανάπτυξης, εμφανίστηκε σε αρουραίους σε δόση 240 mg / kg ή περίπου 1503 και 66 φορές την έκθεση του ανθρώπου στη σαξαγλιπτίνη και στον ενεργό μεταβολίτη, αντίστοιχα, στη μέγιστη συνιστώμενη δόση στον άνθρωπο (MRHD) 5 mg. Η μητρική τοξικότητα και τα μειωμένα σωματικά βάρη του εμβρύου παρατηρήθηκαν σε 7986 και 328 φορές την έκθεση του ανθρώπου στο MRHD για τη σαξαγλιπτίνη και τον ενεργό μεταβολίτη, αντίστοιχα. Μικρές σκελετικές μεταβολές σε κουνέλια εμφανίστηκαν σε δόση τοξικής για τη μητέρα των 200 mg / kg, ή περίπου 1432 και 992 φορές το MRHD. Όταν χορηγήθηκε σε αρουραίους σε συνδυασμό με μετφορμίνη, η σαξαγλιπτίνη δεν ήταν τερατογόνος ούτε εμβρυϊκή σε εκθέσεις 21 φορές μεγαλύτερη από τη σαξαγλιπτίνη MRHD. Η συνδυασμένη χορήγηση μετφορμίνης με υψηλότερη δόση σαξαγλιπτίνης (109 φορές η σαξαγλιπτίνη MRHD) συσχετίστηκε με craniorachischisis (σπάνιο ελάττωμα νευρικού σωλήνα που χαρακτηρίζεται από ατελές κλείσιμο του κρανίου και της σπονδυλικής στήλης) σε δύο έμβρυα από ένα μόνο φράγμα. Οι εκθέσεις μετφορμίνης σε κάθε συνδυασμό ήταν 4 φορές υψηλότερες από την έκθεση του ανθρώπου στα 2000 mg ημερησίως.
Η σαξαγλιπτίνη που χορηγήθηκε σε θηλυκούς αρουραίους από την ημέρα της κύησης 6 έως την ημέρα της γαλουχίας 20 είχε ως αποτέλεσμα μειωμένα βάρη σώματος σε αρσενικούς και θηλυκών απογόνων μόνο σε τοξικές για τη μητέρα δόσεις (εκθέσεις ≥ 1629 και 53 φορές σαξαγλιπτίνη και ο ενεργός μεταβολίτης MRHD). Δεν παρατηρήθηκε λειτουργική ή συμπεριφοριστική τοξικότητα στους απογόνους αρουραίων που έλαβαν σαξαγλιπτίνη σε οποιαδήποτε δόση.
Η σαξαγλιπτίνη διασχίζει τον πλακούντα στο έμβρυο μετά τη χορήγηση σε έγκυες αρουραίους.
Θηλάζουσες μητέρες
Η σαξαγλιπτίνη εκκρίνεται στο γάλα θηλαζόντων αρουραίων σε αναλογία περίπου 1: 1 με τις συγκεντρώσεις φαρμάκου στο πλάσμα. Δεν είναι γνωστό αν η σαξαγλιπτίνη εκκρίνεται στο ανθρώπινο γάλα. Επειδή πολλά φάρμακα εκκρίνονται στο ανθρώπινο γάλα, πρέπει να δίνεται προσοχή όταν το Onglyza χορηγείται σε μια θηλάζουσα γυναίκα.
Παιδιατρική χρήση
Η ασφάλεια και η αποτελεσματικότητα του Onglyza σε παιδιατρικούς ασθενείς δεν έχουν τεκμηριωθεί.
Γηριατρική χρήση
Στις έξι, διπλά τυφλές, ελεγχόμενες δοκιμές κλινικής ασφάλειας και αποτελεσματικότητας του Onglyza, 634 (15,3%) από τους 4148 τυχαιοποιημένους ασθενείς ήταν 65 ετών και άνω και 59 (1,4%) ασθενείς ήταν 75 ετών και άνω. Δεν παρατηρήθηκαν γενικές διαφορές στην ασφάλεια ή την αποτελεσματικότητα μεταξύ ασθενών ηλικίας ≥ 65 ετών και νεότερων ασθενών. Ενώ αυτή η κλινική εμπειρία δεν έχει εντοπίσει διαφορές στις αντιδράσεις μεταξύ ηλικιωμένων και νεότερων ασθενών, δεν μπορεί να αποκλειστεί η μεγαλύτερη ευαισθησία ορισμένων ηλικιωμένων ατόμων.
Η σαξαγλιπτίνη και ο ενεργός μεταβολίτης της εξουδετερώνεται εν μέρει από τα νεφρά. Επειδή οι ηλικιωμένοι ασθενείς είναι πιο πιθανό να έχουν μειωμένη νεφρική λειτουργία, θα πρέπει να λαμβάνεται μέριμνα για την επιλογή της δόσης στους ηλικιωμένους με βάση τη νεφρική λειτουργία. [Βλέπω Δοσολογία και χορήγηση, Ασθενείς με νεφρική δυσλειτουργία και Κλινική Φαρμακολογία, Φαρμακοκινητική.]
μπλουζα
Υπερδοσολογία
Σε ελεγχόμενη κλινική δοκιμή, μία φορά την ημέρα, χορηγούμενη από το στόμα Onglyza σε υγιή άτομα σε δόσεις μέχρι 400 mg ημερησίως για 2 εβδομάδες (80 φορές το MRHD) δεν είχαν κλινικές ανεπιθύμητες αντιδράσεις σχετιζόμενες με τη δόση και καμία κλινικά σημαντική επίδραση στο διάστημα QTc ή στην καρδιά τιμή.
Σε περίπτωση υπερδοσολογίας, πρέπει να ξεκινήσει κατάλληλη υποστηρικτική θεραπεία όπως υπαγορεύεται από την κλινική κατάσταση του ασθενούς. Η σαξαγλιπτίνη και ο δραστικός μεταβολίτης της απομακρύνονται με αιμοκάθαρση (23% της δόσης σε 4 ώρες).
μπλουζα
Περιγραφή
Η σαξαγλιπτίνη είναι ένας από του στόματος δραστικός αναστολέας του ενζύμου DPP4.
Η μονοϋδρική σαξαγλιπτίνη περιγράφεται χημικά ως (1S, 3S, 5S) -2 - [(2S) -2-αμινο-2- (3-υδροξυτρικυκλο [3.3.1.13,7(1S, 3S, 5S) -2 - [(2S) -2-ακετυλο] -2-αζαδικυκλο [3.1.0] Αμινο-2- (3-υδροξυδαμανταν-1-υλο) ακετυλο] -2-αζαδικυκλο [3.1.0] εξαν-3- ένυδρο. Ο εμπειρικός τύπος είναι ο C18H25Ν3Ο2-Η2Ο και το μοριακό βάρος είναι 333,43. Ο δομικός τύπος είναι:
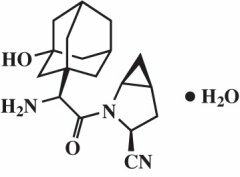
Η μονοϋδρική σαξαγλιπτίνη είναι μία λευκή έως ανοικτό κίτρινη ή ανοιχτό καφέ, μη υγροσκοπική κρυσταλλική σκόνη. Είναι ελάχιστα διαλυτό στο νερό στους 24 ° C ± 3 ° C, ελαφρώς διαλυτό σε οξικό αιθυλεστέρα και διαλυτό σε μεθανόλη, αιθανόλη, ισοπροπυλική αλκοόλη, ακετονιτρίλιο, ακετόνη και πολυαιθυλενογλυκόλη 400 (PEG 400).
Κάθε επικαλυμμένο με λεπτό υμένιο δισκίο Onglyza για από του στόματος χρήση περιέχει είτε 2,79 mg υδροχλωρικής σαξαγλιπτίνης (άνυδρο) ισοδύναμης με 2,5 mg σαξαγλιπτίνης ή 5,58 mg σαξαγλιπτίνης υδροχλωρικό (άνυδρο) ισοδύναμο με 5 mg σαξαγλιπτίνης και των ακόλουθων αδρανών συστατικών: μονοϋδρική λακτόζη, μικροκρυσταλλική κυτταρίνη, νατριούχος κροσκαρμελλόζη και στεατικό μαγνήσιο. Επιπλέον, η επίστρωση μεμβράνης περιέχει τα ακόλουθα αδρανή συστατικά: πολυβινυλική αλκοόλη, πολυαιθυλενογλυκόλη, διοξείδιο τιτανίου, τάλκη και οξείδια σιδήρου.
μπλουζα
Κλινική Φαρμακολογία
Μηχανισμός δράσης
Αυξημένες συγκεντρώσεις των ορμονών ινκρετίνης όπως το πεπτίδιο-1 (GLP-1) που μοιάζει με γλυκογόνο και το εξαρτώμενο από τη γλυκόζη ινσουλινοτροπικό πολυπεπτίδιο (GIP) απελευθερώνονται στο ρεύμα του αίματος από το λεπτό έντερο σε απάντηση τα γεύματα. Αυτές οι ορμόνες προκαλούν απελευθέρωση ινσουλίνης από τα βήτα παγκρεατικά κύτταρα με τρόπο εξαρτώμενο από τη γλυκόζη αλλά αδρανοποιούνται από το ένζυμο διπεπτιδυλ πεπτιδάσης-4 (DPP4) μέσα σε λίγα λεπτά. Το GLP-1 μειώνει επίσης την έκκριση γλυκαγόνης από τα παγκρεατικά άλφα κύτταρα, μειώνοντας την παραγωγή ηπατικής γλυκόζης. Σε ασθενείς με διαβήτη τύπου 2, οι συγκεντρώσεις του GLP-1 μειώνονται, αλλά η ανταπόκριση της ινσουλίνης στο GLP-1 διατηρείται. Η σαξαγλιπτίνη είναι ανταγωνιστικός αναστολέας DPP4 που επιβραδύνει την απενεργοποίηση των ορμονών ινκρετίνης, αυξάνοντας έτσι την κυκλοφορία του αίματος και μειώνοντας τις συγκεντρώσεις γλυκόζης νηστείας και μεταγευματίας με τρόπο εξαρτώμενο από τη γλυκόζη σε ασθενείς με διαβήτη τύπου 2 σακχαρώδη διαβήτη.
Φαρμακοδυναμική
Σε ασθενείς με σακχαρώδη διαβήτη τύπου 2, η χορήγηση του Onglyza αναστέλλει τη δραστικότητα του ενζύμου DPP4 για 24 ώρες. Μετά από ένα από του στόματος φορτίο γλυκόζης ή ένα γεύμα, αυτή η αναστολή DPP4 είχε ως αποτέλεσμα μία 2- έως 3-πλάσια αύξηση στα επίπεδα κυκλοφορίας των δραστικών GLP-1 και GIP, μειωμένες συγκεντρώσεις γλυκαγόνης και αυξημένη έκκριση ινσουλίνης εξαρτώμενη από γλυκόζη από βήτα παγκρεατικά κύτταρα. Η αύξηση της ινσουλίνης και η μείωση στη γλυκαγόνη συσχετίστηκαν με χαμηλότερες συγκεντρώσεις γλυκόζης στη νηστεία και μειωμένη εκδρομή γλυκόζης μετά από στοματικό φορτίο γλυκόζης ή γεύμα.
Καρδιακή Ηλεκτροφυσιολογία
Σε μια τυχαιοποιημένη, διπλή-τυφλή, ελεγχόμενη με εικονικό φάρμακο, διασταύρωση 4 κατευθύνσεων, μελέτη ενεργού συγκριτή με χρήση μοξιφλοξασίνης σε 40 υγιή άτομα, Το Onglyza δεν συσχετίστηκε με κλινικά σημαντική παράταση του διαστήματος QTc ή του καρδιακού ρυθμού σε ημερήσιες δόσεις έως 40 mg (8 φορές MRHD).
Φαρμακοκινητική
Η φαρμακοκινητική της σαξαγλιπτίνης και του δραστικού μεταβολίτη της 5-υδροξυ σαξαγλιπτίνης ήταν παρόμοια σε υγιή άτομα και σε ασθενείς με σακχαρώδη διαβήτη τύπου 2. Το CΜέγιστη και οι τιμές AUC της σαξαγλιπτίνης και του ενεργού μεταβολίτη της αυξήθηκαν αναλογικά στο εύρος δόσης 2,5 έως 400 mg. Μετά από δόση 5 mg απλής από του στόματος saxagliptin σε υγιή άτομα, οι μέσες τιμές AUC του πλάσματος για τη σαξαγλιπτίνη και τον ενεργό μεταβολίτη ήταν 78 ng-h / mL και 214 ng-h / mL, αντίστοιχα. Το αντίστοιχο πλάσμα CΜέγιστη οι τιμές ήταν 24 ng / mL και 47 ng / mL, αντίστοιχα. Η μέση μεταβλητότητα (% CV) για την AUC και CΜέγιστη τόσο για τη σαξαγλιπτίνη όσο και για τον ενεργό μεταβολίτη της ήταν λιγότερο από 25%.
Δεν παρατηρήθηκε σημαντική συσσώρευση είτε της σαξαγλιπτίνης είτε του ενεργού μεταβολίτη της με επαναλαμβανόμενη δοσολογία μία φορά ημερησίως σε οποιοδήποτε επίπεδο δόσης. Δεν παρατηρήθηκε εξάρτηση από τη δόση και το χρόνο κατά την κάθαρση της σαξαγλιπτίνης και του ενεργού μεταβολίτη της σε διάστημα 14 ημερών δοσολογίας άπαξ ημερησίως με saxagliptin σε δόσεις κυμαινόμενες από 2,5 έως 400 mg.
Απορρόφηση
Ο διάμεσος χρόνος μέχρι τη μέγιστη συγκέντρωση (TΜέγιστη) μετά τη δόση των 5 mg μία φορά την ημέρα ήταν 2 ώρες για τη σαξαγλιπτίνη και 4 ώρες για τον ενεργό μεταβολίτη. Η χορήγηση με γεύμα με υψηλή περιεκτικότητα σε λιπαρά είχε ως αποτέλεσμα την αύξηση του ΤΜέγιστη της σαξαγλιπτίνης κατά περίπου 20 λεπτά σε σύγκριση με τις συνθήκες νηστείας. Υπήρξε αύξηση κατά 27% της AUC της σαξαγλιπτίνης όταν χορηγήθηκε με ένα γεύμα σε σύγκριση με τις συνθήκες νηστείας. Το Onglyza μπορεί να χορηγηθεί με ή χωρίς τροφή.
Διανομή
Η in vitro πρωτεϊνική σύνδεση της σαξαγλιπτίνης και του ενεργού μεταβολίτη της στον ανθρώπινο ορό είναι αμελητέα. Συνεπώς, οι αλλαγές στα επίπεδα πρωτεϊνών του αίματος σε διάφορες καταστάσεις ασθενειών (π.χ. νεφρική ή ηπατική ανεπάρκεια) δεν αναμένεται να μεταβάλλουν τη διάθεση της σαξαγλιπτίνης.
Μεταβολισμός
Ο μεταβολισμός της σαξαγλιπτίνης προκαλείται κυρίως από το κυτόχρωμα P450 3A4 / 5 (CYP3A4 / 5). Ο κύριος μεταβολίτης της σαξαγλιπτίνης είναι επίσης ένας αναστολέας DPP4, ο οποίος είναι μισός τόσο ισχυρός όσο η σαξαγλιπτίνη. Συνεπώς, ισχυροί αναστολείς και επαγωγείς του CYP3A4 / 5 θα μεταβάλλουν τη φαρμακοκινητική της σαξαγλιπτίνης και του δραστικού μεταβολίτη της. [Βλέπω Αλληλεπιδράσεις με άλλα φάρμακα.]
Απέκκριση
Η σαξαγλιπτίνη εξαλείφεται τόσο με νεφρική όσο και με ηπατική οδό. Μετά από μία δόση των 50 mg 14Η C-σαξαγλιπτίνη, 24%, 36% και 75% της δόσης απεκκρίθηκε στα ούρα ως σαξαγλιπτίνη, ενεργό μεταβολίτη και ολική ραδιενέργεια αντίστοιχα. Η μέση νεφρική κάθαρση της σαξαγλιπτίνης (~ 230 mL / min) ήταν μεγαλύτερη από τη μέση εκτιμώμενη ταχύτητα σπειραματικής διήθησης (~ 120 mL / min), γεγονός που υποδηλώνει κάποια ενεργή νεφρική απέκκριση. Συνολικά, το 22% της χορηγούμενης ραδιενέργειας ανακτήθηκε σε κόπρανα που αντιπροσωπεύουν το κλάσμα της δόσης saxagliptin που απεκκρίνεται στη χολή και / ή στο μη απορροφούμενο φάρμακο από τη γαστρεντερική οδό. Μετά από μία δόση Onglyza 5 mg από το στόμα σε υγιή άτομα, ο μέσος τελικός χρόνος ημίσειας ζωής στο πλάσμα (t1/2) για τη σαξαγλιπτίνη και τον ενεργό μεταβολίτη της ήταν 2,5 και 3,1 ώρες αντίστοιχα.
Ειδικοί Πληθυσμοί
Νεφρική δυσλειτουργία
Διεξήχθη μια ανοικτή μελέτη μιας δόσης για την αξιολόγηση της φαρμακοκινητικής της σαξαγλιπτίνης (δόση 10 mg) άτομα με διαφόρους βαθμούς χρόνιας νεφρικής δυσλειτουργίας (N = 8 ανά ομάδα) σε σύγκριση με άτομα με φυσιολογική νεφρική λειτουργία λειτουργία. Η μελέτη περιελάμβανε ασθενείς με νεφρική ανεπάρκεια που ταξινομήθηκαν με βάση την κάθαρση κρεατινίνης ως ήπια (> 50 έως ≥80 mL / λεπτό), μέτρια (30 έως ≥ 50 mL / λεπτό) και σοβαρή (<30 mL / min), καθώς και ασθενείς με νεφρική νόσο τελικού σταδίου αιμοκάθαρση. Η κάθαρση κρεατινίνης υπολογίστηκε από κρεατινίνη ορού με βάση τον τύπο Cockcroft-Gault:
CrCl = [140 ετών (έτη)] - βάρος (kg) {Ã- 0,85 για γυναίκες ασθενείς}
[72 ° - κρεατινίνη ορού (mg / dL)]
Ο βαθμός νεφρικής ανεπάρκειας δεν επηρέασε το CΜέγιστη της σαξαγλιπτίνης ή του ενεργού μεταβολίτη της. Σε άτομα με ήπια νεφρική δυσλειτουργία, οι τιμές AUC της σαξαγλιπτίνης και του δραστικού μεταβολίτη της ήταν 20% και 70% υψηλότερες, αντίστοιχα, από τις τιμές AUC σε άτομα με φυσιολογική νεφρική λειτουργία. Επειδή οι αυξήσεις αυτού του μεγέθους δεν θεωρούνται κλινικά σχετικές, δεν συνιστάται η προσαρμογή της δοσολογίας σε ασθενείς με ήπια νεφρική δυσλειτουργία. Σε άτομα με μέτρια ή σοβαρή νεφρική δυσλειτουργία, οι τιμές AUC της σαξαγλιπτίνης και της δραστικής ουσίας αυτής μεταβολίτη ήταν έως 2,1- και 4,5 φορές υψηλότερες, αντίστοιχα, από τις τιμές AUC σε άτομα με φυσιολογική νεφρική λειτουργία λειτουργία. Για να επιτευχθούν εκθέσεις στο πλάσμα της σαξαγλιπτίνης και του δραστικού μεταβολίτη της παρόμοιες με αυτές σε ασθενείς με φυσιολογική νεφρική λειτουργία, η συνιστώμενη δόση είναι 2,5 mg μία φορά την ημέρα σε ασθενείς με μέτρια και σοβαρή νεφρική δυσλειτουργία, καθώς και σε ασθενείς με νεφρική νόσο τελικού σταδίου που απαιτούν αιμοκάθαρση. Η σαξαγλιπτίνη απομακρύνεται με αιμοκάθαρση.
Ηπατική ανεπάρκεια
Σε άτομα με ηπατική δυσλειτουργία (κλάσεις A, B και C του Child-Pugh), η μέση τιμή CΜέγιστη και η AUC της σαξαγλιπτίνης ήταν έως 8% και 77% υψηλότερα, αντίστοιχα, σε σύγκριση με τους υγιείς συνδυασμένους ελέγχους μετά τη χορήγηση μιας εφάπαξ δόσης σαξαγλιπτίνης 10 mg. Η αντίστοιχη CΜέγιστη και η AUC του ενεργού μεταβολίτη ήταν έως και 59% και 33% χαμηλότερα, αντίστοιχα, συγκριτικά με τους υγιείς συνδυασμούς ελέγχου. Αυτές οι διαφορές δεν θεωρούνται κλινικά σημαντικές. Δεν συνιστάται προσαρμογή της δοσολογίας σε ασθενείς με ηπατική δυσλειτουργία.
Δείκτη μάζας σώματος
Δεν συνιστάται προσαρμογή της δοσολογίας με βάση τον δείκτη μάζας σώματος (ΔΜΣ), ο οποίος δεν προσδιορίστηκε ως σημαντικός μεταβάλλεται στη φαινομενική κάθαρση της σαξαγλιπτίνης ή του ενεργού μεταβολίτη της στη φαρμακοκινητική του πληθυσμού ανάλυση.
Γένος
Δεν συνιστάται προσαρμογή της δοσολογίας με βάση το φύλο. Δεν παρατηρήθηκαν διαφορές στη φαρμακοκινητική της σαξαγλιπτίνης μεταξύ ανδρών και γυναικών. Σε σύγκριση με τους άνδρες, τα θηλυκά είχαν περίπου 25% υψηλότερες τιμές έκθεσης για τον ενεργό μεταβολίτη από τους άνδρες, αλλά αυτή η διαφορά είναι απίθανο να έχει κλινική σημασία. Το φύλο δεν αναγνωρίστηκε ως σημαντική μεταβλητή στην εμφανή κάθαρση της σαξαγλιπτίνης και του ενεργού μεταβολίτη της στη φαρμακοκινητική ανάλυση πληθυσμού.
Γηριατρική
Δεν συνιστάται προσαρμογή της δοσολογίας με βάση μόνο την ηλικία. Τα ηλικιωμένα άτομα (65-80 ετών) είχαν 23% και 59% υψηλότερη γεωμετρική μέση τιμή CΜέγιστη και των γεωμετρικών μέσων τιμών AUC, αντίστοιχα, για τη σαξαγλιπτίνη από ό, τι τα νεαρά άτομα (18-40 ετών). Οι διαφορές στη φαρμακοκινητική του ενεργού μεταβολίτη μεταξύ ηλικιωμένων και νεαρών ατόμων αντανακλούσαν γενικά τις διαφορές που παρατηρήθηκαν στη φαρμακοκινητική της σαξαγλιπτίνης. Η διαφορά μεταξύ της φαρμακοκινητικής της σαξαγλιπτίνης και του ενεργού μεταβολίτη σε νέους και ηλικιωμένους υποκείμενα πιθανώς οφείλονται σε πολλαπλούς παράγοντες, όπως η πτώση της νεφρικής λειτουργίας και η μεταβολική ικανότητα με αυξανόμενη ηλικία. Η ηλικία δεν αναγνωρίστηκε ως σημαντική συνάφεια στην εμφανή κάθαρση της saxagliptin και του ενεργού μεταβολίτη της στην φαρμακοκινητική ανάλυση του πληθυσμού
Παιδιατρικός
Δεν έχουν διεξαχθεί μελέτες που χαρακτηρίζουν τη φαρμακοκινητική της σαξαγλιπτίνης σε παιδιατρικούς ασθενείς.
Φυλή και εθνικότητα
Δεν συνιστάται προσαρμογή της δοσολογίας με βάση τη φυλή. Η φαρμακοκινητική ανάλυση πληθυσμού συνέκρινε τη φαρμακοκινητική της σαξαγλιπτίνης και της δραστικής ουσίας μεταβολίτη σε 309 καυκάσιους με 105 μη καυκάσιους (που αποτελείται από έξι φυλετικές ομάδες). Δεν παρατηρήθηκε σημαντική διαφορά στη φαρμακοκινητική της σαξαγλιπτίνης και του ενεργού μεταβολίτη μεταξύ αυτών των δύο πληθυσμών.
Αλληλεπιδράσεις φαρμάκων-φαρμάκων
In Vitro αξιολόγηση των αλληλεπιδράσεων φαρμάκων
Ο μεταβολισμός της σαξαγλιπτίνης προκαλείται κυρίως από το CYP3A4 / 5.
Σε μελέτες in vitro, η σαξαγλιπτίνη και ο δραστικός μεταβολίτης της δεν ανέστειλαν τα CYP1A2, 2Α6, 2Β6, 2C9, 2C19, 2D6, 2E1 ή 3Α4 ή προκάλεσαν CYP1A2, 2B6, 2C9 ή 3Α4. Συνεπώς, η σαξαγλιπτίνη δεν αναμένεται να μεταβάλει τη μεταβολική κάθαρση των συγχορηγούμενων φαρμάκων που μεταβολίζονται από αυτά τα ένζυμα. Η σαξαγλιπτίνη είναι ένα υπόστρωμα της Ρ-γλυκοπρωτεΐνης (P-gp) αλλά δεν είναι σημαντικός αναστολέας ή επαγωγέας της P-gp.
Η in vitro πρωτεϊνική σύνδεση της σαξαγλιπτίνης και του ενεργού μεταβολίτη της στον ανθρώπινο ορό είναι αμελητέα. Έτσι, η δέσμευση πρωτεΐνης δεν θα είχε σημαντική επίδραση στη φαρμακοκινητική της σαξαγλιπτίνης ή άλλων φαρμάκων.
Αξιολόγηση in vivo των αλληλεπιδράσεων φαρμάκων
Επιδράσεις της σαξαγλιπτίνης σε άλλα φάρμακα
Σε μελέτες που διεξήχθησαν σε υγιή άτομα, όπως περιγράφεται παρακάτω, η σαξαγλιπτίνη δεν μετέβαλε ουσιαστικά το φαρμακοκινητική της μετφορμίνης, γλυβουρίδη, πιογλιταζόνη, διγοξίνη, σιμβαστατίνη, διλτιαζέμη ή κετοκοναζόλη.
Μετφορμίνη: Η συγχορήγηση μιας δόσης σαξαγλιπτίνης (100 mg) και μετφορμίνης (1000 mg), ενός υποστρώματος hOCT-2, δεν άλλαξε τη φαρμακοκινητική της μετφορμίνης σε υγιή άτομα. Ως εκ τούτου, το Onglyza δεν αποτελεί αναστολέα της μεσολαβούμενης από hOCT-2 μεταφοράς.
Γλυβουρίδη: Η συγχορήγηση μιας εφάπαξ δόσης σαξαγλιπτίνης (10 mg) και γλυβουρίδης (5 mg), ενός υποστρώματος του CYP2C9, αύξησε το πλάσμα CΜέγιστη της γλυβουρίδης κατά 16%. Ωστόσο, η AUC της γλυβουρίδης παρέμεινε αμετάβλητη. Συνεπώς, το Onglyza δεν αναστέλλει σημαντικά το μεταβολισμό που προκαλείται από το CYP2C9.
Πιογλιταζόνη: Η συγχορήγηση πολλαπλών δόσεων σαξαγλιπτίνης (10 mg) μία φορά την ημέρα και της πιογλιταζόνης (45 mg), ενός υποστρώματος του CYP2C8, αύξησε το πλάσμα CΜέγιστη της πιογλιταζόνης κατά 14%. Ωστόσο, η AUC της πιογλιταζόνης παρέμεινε αμετάβλητη.
Διγοξίνη: Η συγχορήγηση πολλαπλών δόσεων σαξαγλιπτίνης (10 mg) και διγοξίνης (0,25 mg), ενός υποστρώματος P-gp, δεν αλλοίωσε τη φαρμακοκινητική της διγοξίνης. Ως εκ τούτου, το Onglyza δεν είναι αναστολέας ή επαγωγέας μεταφοράς μέσω της P-gp.
Σιμβαστατίνη: Η συγχορήγηση πολλαπλών δόσεων σαξαγλιπτίνης (10 mg) και σιμβαστατίνης (40 mg), ενός υποστρώματος του CYP3A4 / 5, δεν αλλοίωσε τη φαρμακοκινητική της σιμβαστατίνης. Επομένως, το Onglyza δεν είναι αναστολέας ή επαγωγέας μεταβολισμού μέσω του CYP3A4 / 5.
Diltiazem: Η συγχορήγηση πολλαπλών δόσεων σαξαγλιπτίνης (10 mg) και διλτιαζέμης (360 mg παρατεταμένης δράσης σε σταθερή κατάσταση), ενός μέτριου αναστολέα του CYP3A4 / 5, αύξησε το πλάσμα CΜέγιστη του diltiazem κατά 16%. Ωστόσο, η AUC του diltiazem παρέμεινε αμετάβλητη.
Κετοκοναζόλη: Η συγχορήγηση μιας εφάπαξ δόσης σαξαγλιπτίνης (100 mg) και πολλαπλών δόσεων κετοκοναζόλης (200 mg κάθε 12 ώρες σε σταθερή κατάσταση), ένας ισχυρός αναστολέας των CYP3A4 / 5 και P-gp, μείωσε τη Cmax και την AUC της κετοκοναζόλης στο πλάσμα κατά 16% και 13%, αντίστοιχα.
Επιδράσεις άλλων φαρμάκων στη σαξαγλιπτίνη
Μετφορμίνη: Η συγχορήγηση μίας δόσης σαξαγλιπτίνης (100 mg) και μετφορμίνης (1000 mg), ενός υποστρώματος hOCT-2, μείωσε το CΜέγιστη της σαξαγλιπτίνης κατά 21%. Ωστόσο, η AUC παρέμεινε αμετάβλητη.
Γλυβουρίδη: Η συγχορήγηση μίας δόσης σαξαγλιπτίνης (10 mg) και γλυβουρίδης (5 mg), ενός υποστρώματος του CYP2C9, αύξησε το CΜέγιστη της σαξαγλιπτίνης κατά 8%. Ωστόσο, η AUC της σαξαγλιπτίνης παρέμεινε αμετάβλητη.
Πιογλιταζόνη: Συγχορήγηση πολλαπλών δόσεων σαξαγλιπτίνης (10 mg) μία φορά την ημέρα και πιογλιταζόνης (45 mg), ένα CYP2C8 (μείζον) και CYP3A4 (δευτερεύον) υπόστρωμα, δεν άλλαξαν τη φαρμακοκινητική του σαξαγλιπτίνη.
Διγοξίνη: Η συγχορήγηση πολλαπλών δόσεων σαξαγλιπτίνης (10 mg) και διγοξίνης (0,25 mg), ενός υποστρώματος P-gp, δεν άλλαξε τη φαρμακοκινητική της σαξαγλιπτίνης.
Σιμβαστατίνη: Η συγχορήγηση πολλαπλών δόσεων σαξαγλιπτίνης (10 mg) και σιμβαστατίνης (40 mg), ενός υποστρώματος του CYP3A4 / 5, αυξήθηκε το CΜέγιστη της σαξαγλιπτίνης κατά 21%. Ωστόσο, η AUC της σαξαγλιπτίνης παρέμεινε αμετάβλητη.
Διλτιαζέμη: Συγχορήγηση μίας δόσης σαξαγλιπτίνης (10 mg) και διλτιαζέμης (360 mg παρατεταμένης δράσης σε σταθερή κατάσταση), ενός μέτριου αναστολέα του CYP3A4 / 5, αύξησε το CΜέγιστη της σαξαγλιπτίνης κατά 63% και της AUC κατά 2,1 φορές. Αυτό συνδέθηκε με μια αντίστοιχη μείωση του CΜέγιστη και της AUC του ενεργού μεταβολίτη κατά 44% και 36% αντίστοιχα.
Κετοκοναζόλη: Η συγχορήγηση μίας δόσης σαξαγλιπτίνης (100 mg) και κετοκοναζόλης (200 mg κάθε 12 ώρες σε σταθερή κατάσταση), ένας ισχυρός αναστολέας των CYP3A4 / 5 και P-gp, αύξησε την CΜέγιστη για τη σαξαγλιπτίνη κατά 62% και την AUC κατά 2,5 φορές. Αυτό συνδέθηκε με μια αντίστοιχη μείωση του CΜέγιστη και της AUC του ενεργού μεταβολίτη κατά 95% και 91% αντίστοιχα.
Σε άλλη μελέτη, η συγχορήγηση μιας εφάπαξ δόσης σαξαγλιπτίνης (20 mg) και κετοκοναζόλης (200 mg κάθε 12 ώρες σε σταθερή κατάσταση) αύξησε την CΜέγιστη και της AUC της σαξαγλιπτίνης κατά 2,4 φορές και 3,7 φορές αντίστοιχα. Αυτό συνδέθηκε με μια αντίστοιχη μείωση του CΜέγιστη και AUC του δραστικού μεταβολίτη κατά 96% και 90% αντίστοιχα.
Ριφαμπίνη: Η συγχορήγηση μιας δόσης σαξαγλιπτίνης (5 mg) και ριφαμπίνης (600 mg QD σε σταθερή κατάσταση) μείωσε το CΜέγιστη και της AUC της σαξαγλιπτίνης κατά 53% και 76% αντίστοιχα, με αντίστοιχη αύξηση της CΜέγιστη (39%) αλλά καμία σημαντική αλλαγή στην AUC του δραστικού μεταβολίτη στο πλάσμα.
Ομεπραζόλη: Συγχορήγηση πολλαπλών δόσεων σαξαγλιπτίνης (10 mg) και ομεπραζόλης (40 mg), CYP2C19 (μείζονες) και το υπόστρωμα του CYP3A4, ένας αναστολέας του CYP2C19 και ένας επαγωγέας του MRP-3, δεν άλλαξαν τη φαρμακοκινητική του σαξαγλιπτίνη.
Υδροξείδιο του αργιλίου + υδροξείδιο του μαγνησίου + σιμεθικόνη: Συγχορήγηση μιας εφάπαξ δόσης σαξαγλιπτίνης (10 mg) και ενός το υγρό που περιείχε υδροξείδιο του αργιλίου (2400 mg), το υδροξείδιο του μαγνησίου (2400 mg) και η σιμεθικόνη (240 mg) μείωσαν το CΜέγιστη της σαξαγλιπτίνης κατά 26%. Ωστόσο, η AUC της σαξαγλιπτίνης παρέμεινε αμετάβλητη.
Famotidine: Η χορήγηση μιας δόσης σαξαγλιπτίνης (10 mg) 3 ώρες μετά από μία δόση φαμοτιδίνης (40 mg), ενός αναστολέα των hOCT-1, hOCT-2 και hOCT-3,Μέγιστη της σαξαγλιπτίνης κατά 14%. Ωστόσο, η AUC της σαξαγλιπτίνης παρέμεινε αμετάβλητη.
μπλουζα
Μη κλινική τοξικολογία
Καρκινογένεση, Μεταλλαξογένεση, Βλάβη της Γονιμότητας
Η σαξαγλιπτίνη δεν προκάλεσε όγκους σε ποντίκια (50, 250 και 600 mg / kg) ή αρουραίους (25, 75, 150 και 300 mg / kg) στις υψηλότερες δόσεις που αξιολογήθηκαν. Οι υψηλότερες δόσεις που αξιολογήθηκαν σε ποντίκια ήταν ισοδύναμες με περίπου 870 (αρσενικά) και 1165 (θηλυκά) φορές την έκθεση του ανθρώπου στο MRHD των 5 mg / ημέρα. Σε αρουραίους, οι εκθέσεις ήταν περίπου 355 (αρσενικά) και 2217 (θηλυκά) φορές το MRHD.
Η σαξαγλιπτίνη δεν ήταν μεταλλαξιογόνος ή κλαστογόνος με ή χωρίς μεταβολική ενεργοποίηση σε ίη vitro βακτηριακή δοκιμασία Ames, μία in vitro κυτταρογενετική δοκιμασία σε πρωτογενή ανθρώπινη λεμφοκυττάρων, σε δοκιμασία ίπ νίνο από του στόματος μικροπυρήνων σε αρουραίους, σε in vivo μελέτη επιδιόρθωσης στοματικού ϋΝΑ σε αρουραίους και σε από του στόματος in vivo / in vitro μελέτη κυτταρογενετικής σε περιφερικό αίμα αρουραίου λεμφοκύτταρα. Ο δραστικός μεταβολίτης δεν ήταν μεταλλαξιογόνος σε έναν in vitro βακτηριακό προσδιορισμό Ames.
Σε μια μελέτη γονιμότητας σε αρουραίους, τα αρσενικά υποβλήθηκαν σε θεραπεία με δόσεις από το στόμα για 2 εβδομάδες πριν από το ζευγάρωμα, κατά τη διάρκεια του ζευγαρώματος και μέχρι τα προγραμματισμένα τερματισμού (περίπου 4 εβδομάδες συνολικά) και οι γυναίκες υποβλήθηκαν σε θεραπεία με στοματικές δόσεις για 2 εβδομάδες πριν από το ζευγάρωμα κατά τη διάρκεια της κύησης ημέρα 7. Δεν παρατηρήθηκαν ανεπιθύμητες ενέργειες στη γονιμότητα σε εκθέσεις περίπου 603 (αρσενικά) και 776 (θηλυκά) φορές το MRHD. Οι υψηλότερες δόσεις που προκάλεσαν μητρική τοξικότητα επίσης αύξησαν την απορρόφηση του εμβρύου (περίπου 2069 και 6138 φορές το MRHD). Επιπρόσθετες επιδράσεις στην κυτταρική οιστρογόνο, γονιμότητα, ωορρηξία και εμφύτευση παρατηρήθηκαν σε περίπου 6138 φορές το MRHD.
Τοξικολογία των ζώων
Η σαξαγλιπτίνη προκάλεσε ανεπιθύμητες αλλαγές στο δέρμα στα άκρα των πιθήκων cynomolgus (ψώρα και / ή εξέλκωση της ουράς, ψηφία, όσχεο και / ή μύτη). Οι δερματικές βλάβες ήταν αναστρέψιμες σε ± 20 φορές το MRHD, αλλά σε ορισμένες περιπτώσεις ήταν μη αναστρέψιμες και νεκρωτικές σε υψηλότερες εκθέσεις. Δεν παρατηρήθηκαν ανεπιθύμητες αλλαγές του δέρματος σε εκθέσεις παρόμοιες με (1 έως 3 φορές) το MRHD των 5 mg. Κλινικές συσχετίσεις με δερματικές αλλοιώσεις σε πιθήκους δεν έχουν παρατηρηθεί σε κλινικές δοκιμές σαξαγλιπτίνης στον άνθρωπο.
μπλουζα
Κλινικές μελέτες
Το Onglyza μελετήθηκε ως μονοθεραπεία και σε συνδυασμό με τη θεραπεία με μετφορμίνη, γλυβουρίδη και θειαζολιδινοδιόνη (πιογλιταζόνη και ροσιγλιταζόνη). Το Onglyza δεν έχει μελετηθεί σε συνδυασμό με ινσουλίνη.
Συνολικά 4148 ασθενείς με σακχαρώδη διαβήτη τύπου 2 τυχαιοποιήθηκαν σε έξι, διπλά τυφλές, ελεγχόμενες κλινικές δοκιμές που διεξήχθησαν για την αξιολόγηση της ασφάλειας και της γλυκαιμικής αποτελεσματικότητας του Onglyza. Συνολικά 3021 ασθενείς σε αυτές τις μελέτες υποβλήθηκαν σε θεραπεία με Onglyza. Σε αυτές τις μελέτες, η μέση ηλικία ήταν 54 έτη, και το 71% των ασθενών ήταν Καυκάσιοι, το 16% ήταν ασιατικοί, το 4% ήταν μαύροι και το 9% από άλλες φυλετικές ομάδες. Ένας επιπλέον 423 ασθενείς, συμπεριλαμβανομένων των 315 που έλαβαν Onglyza, συμμετείχαν σε ελεγχόμενη με εικονικό φάρμακο δοσολογική μελέτη διάρκειας 6 έως 12 εβδομάδων.
Σε αυτές τις έξι, διπλά τυφλές δοκιμές, το Onglyza αξιολογήθηκε σε δόσεις των 2,5 mg και 5 mg μία φορά την ημέρα. Τρεις από αυτές τις μελέτες αξιολόγησαν επίσης μια δόση σαξαγλιπτίνης 10 mg ημερησίως. Η ημερήσια δόση 10 mg σαξαγλιπτίνης δεν παρείχε μεγαλύτερη αποτελεσματικότητα από την ημερήσια δόση των 5 mg. Η θεραπεία με Onglyza σε όλες τις δόσεις παρήγαγε κλινικά σημαντικές και στατιστικά σημαντικές βελτιώσεις στην αιμοσφαιρίνη A1c (A1C), γλυκόζης πλάσματος νηστείας (FPG) και 2-ωρης μεταγευματικής γλυκόζης (PPG) μετά από πρότυπο από του στόματος δοκιμή ανοχής γλυκόζης (OGTT), σε σύγκριση με έλεγχος. Μειώσεις της A1C παρατηρήθηκαν σε όλες τις υποομάδες, συμπεριλαμβανομένων του φύλου, της ηλικίας, της φυλής και του BMI βασικής γραμμής.
Το Onglyza δεν συσχετίστηκε με σημαντικές αλλαγές από το αρχικό βάρος του σωματικού βάρους ή λιπίδια ορού νηστείας σε σύγκριση με το εικονικό φάρμακο.
Μονοθεραπεία
Συνολικά, 766 ασθενείς με διαβήτη τύπου 2 δεν ελέγχθηκαν επαρκώς με τη διατροφή και την άσκηση (A1C ± 7% έως ± 10%) συμμετείχαν σε δύο ελεγχόμενες με εικονικό φάρμακο 24 εβδομάδες, διπλά τυφλές, ελεγχόμενες μελέτες για την αξιολόγηση της αποτελεσματικότητας και της ασφάλειας του Onglyza μονοθεραπεία.
Στην πρώτη δοκιμή, μετά από μία μονοπαθή δίαιτα, άσκηση και εικονικό φάρμακο διάρκειας 2 εβδομάδων, 401 ασθενείς τυχαιοποιήθηκαν σε 2,5 mg, 5 mg ή 10 mg Onglyza ή εικονικό φάρμακο. Οι ασθενείς που δεν κατάφεραν να ανταποκριθούν σε συγκεκριμένους γλυκαιμικούς στόχους κατά τη διάρκεια της μελέτης υποβλήθηκαν σε θεραπεία με θεραπεία διάσωσης με μετφορμίνη, η οποία προστέθηκε στο εικονικό φάρμακο ή στο Onglyza. Η αποτελεσματικότητα αξιολογήθηκε κατά την τελευταία μέτρηση πριν από τη θεραπεία διάσωσης για ασθενείς που χρειάστηκαν διάσωση. Η τιτλοποίηση της δόσης του Onglyza δεν επιτρέπεται.
Η θεραπεία με Onglyza 2,5 mg και 5 mg ημερησίως παρείχε σημαντικές βελτιώσεις στην A1C, FPG και PPG σε σύγκριση με το εικονικό φάρμακο (Πίνακας 3). Το ποσοστό των ασθενών που διέκοψαν λόγω έλλειψης ελέγχου γλυκόζης ή οι οποίοι διασώθηκαν για την προκαθορισμένη συνεδρίαση γλυκαιμικά κριτήρια ήταν 16% στην ομάδα θεραπείας με Onglyza 2,5 mg, 20% στην ομάδα θεραπείας με Onglyza 5 mg και 26% στην ομάδα ομάδα εικονικού φαρμάκου.
Πίνακας 3: Γλυκαιμικές Παράμετροι την Εβδομάδα 24 σε ελεγχόμενη με εικονικό φάρμακο Μελέτη Μονοθεραπείας Onglyza σε Ασθενείς με Διαβήτη Τύπου 2 *
| Παράμετρος αποτελεσματικότητας | Onglyza 2,5 mg Ν = 102 |
Onglyza 5 mg Ν = 106 |
Εικονικό φάρμακο Ν = 95 |
|---|---|---|---|
| * Ο πληθυσμός με σκοπό την θεραπεία με χρήση τελευταίας παρατήρησης στη μελέτη ή την τελευταία παρατήρηση πριν τη θεραπεία διάσωσης με μετφορμίνη για ασθενείς που χρειάζονται διάσωση. | |||
| â€ Η μέση τιμή των τετραγώνων είναι ρυθμισμένη ως προς τη βασική τιμή. | |||
| ντο τιμή ρ <0,0001 σε σύγκριση με το εικονικό φάρμακο | |||
| § p-τιμή <0.05 σε σύγκριση με το εικονικό φάρμακο | |||
| ¶ Η σημασία δεν εξετάστηκε για το 2-ωρο PPG για τη δόση των 2,5 mg Onglyza. | |||
| Αιμοσφαιρίνη A1C (%) | Ν = 100 | Ν = 103 | Ν = 92 |
| Βασική γραμμή (μέση τιμή) | 7.9 | 8.0 | 7.9 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | −0.4 | −0.5 | +0.2 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο†) | −0.6ντο | −0.6ντο | |
| 95% διάστημα εμπιστοσύνης | (−0.9, −0.3) | (−0.9, −0.4) | |
| Το ποσοστό των ασθενών που επιτυγχάνουν A1C <7% | 35% (35/100) | 38% §(39/103) | 24% (22/92) |
| Γλυκόζη πλάσματος νηστείας (mg / dL) | Ν = 101 | Ν = 105 | Ν = 92 |
| Βασική γραμμή (μέση τιμή) | 178 | 171 | 172 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | −15 | −9 | +6 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο†) | −21 § | −15 § | |
| 95% διάστημα εμπιστοσύνης | (−31, −10) | (−25, −4) | |
| 2-ωρη μεταγευματική γλυκόζη (mg / dL) | Ν = 78 | Ν = 84 | Ν = 71 |
| Βασική γραμμή (μέση τιμή) | 279 | 278 | 283 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | −45 | −43 | −6 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο†) | −39 ¶ | −37 § | |
| 95% διάστημα εμπιστοσύνης | (−61, −16) | (−59, −15) |
Μια δεύτερη δοκιμή μονοθεραπείας διάρκειας 24 εβδομάδων διεξήχθη για να εκτιμηθεί μια σειρά δοσολογιών για το Onglyza. Οι ασθενείς που δεν έλαβαν θεραπεία με ανεπαρκώς ελεγχόμενο διαβήτη (A1C ± 7% έως ≥ 10%) υποβλήθηκαν σε δίωρες, μονο-τυφλές διατροφές, άσκηση και εικονικό φάρμακο. Συνολικά 365 ασθενείς τυχαιοποιήθηκαν σε 2,5 mg κάθε πρωί, 5 mg κάθε πρωί, 2,5 mg με πιθανή τιτλοποίηση έως 5 mg κάθε πρωί ή 5 mg κάθε βράδυ του Onglyza ή εικονικό φάρμακο. Οι ασθενείς που δεν κατάφεραν να ανταποκριθούν σε συγκεκριμένους γλυκαιμικούς στόχους κατά τη διάρκεια της μελέτης υποβλήθηκαν σε θεραπεία με θεραπεία διάσωσης με μετφορμίνη που προστέθηκε στο εικονικό φάρμακο ή στο Onglyza. ο αριθμός των ασθενών που τυχαιοποιήθηκαν ανά ομάδα θεραπείας κυμάνθηκε από 71 έως 74.
Η θεραπεία είτε με Onglyza 5 mg κάθε πρωί είτε με 5 mg κάθε βράδυ, παρείχε σημαντικές βελτιώσεις στην A1C έναντι του εικονικού φαρμάκου (μέσες με το placebo διορθωμένες μειώσεις κατά 0,4% και 0,3% αντίστοιχα). Η θεραπεία με Onglyza 2,5 mg κάθε πρωί παρείχε επίσης σημαντική βελτίωση στην A1C έναντι του εικονικού φαρμάκου (μέση μείωση με διόρθωση κατά 0,4%).
Συνδυαστική Θεραπεία
Πρόσθετη θεραπεία συνδυασμού με μετφορμίνη
Συνολικά 743 ασθενείς με διαβήτη τύπου 2 συμμετείχαν σε αυτήν την τυχαιοποιημένη, διπλή-τυφλή, ελεγχόμενη με εικονικό φάρμακο μελέτη, διάρκειας 24 εβδομάδων, για την αξιολόγηση της την αποτελεσματικότητα και την ασφάλεια του Onglyza σε συνδυασμό με μετφορμίνη σε ασθενείς με ανεπαρκή γλυκαιμικό έλεγχο (A1C ≥ 7% και ≥ 10%) στη μετφορμίνη μόνος. Για να είναι κατάλληλη η εγγραφή, οι ασθενείς έπρεπε να βρίσκονται σε σταθερή δόση μετφορμίνης (1500-2550 mg ημερησίως) για τουλάχιστον 8 εβδομάδες.
Οι ασθενείς που πληρούσαν τα κριτήρια επιλεξιμότητας εγγράφηκαν σε μία τυφλή, διάρκειας 2 εβδομάδων, δίαιτα και άσκηση placebo περίοδο κατά την οποία οι ασθενείς έλαβαν μετφορμίνη στη δόση τους πριν από τη μελέτη, μέχρι 2500 mg ημερησίως, για τη διάρκεια της θεραπείας μελέτη. Μετά την περίοδο εισαγωγής, οι επιλέξιμοι ασθενείς τυχαιοποιήθηκαν σε 2,5 mg, 5 mg ή 10 mg Onglyza ή εικονικό φάρμακο επιπλέον της τρέχουσας δόσης ανοιχτής μετφορμίνης. Οι ασθενείς που δεν κατάφεραν να ανταποκριθούν σε συγκεκριμένους γλυκαιμικούς στόχους κατά τη διάρκεια της μελέτης υποβλήθηκαν σε θεραπεία με θεραπεία διάσωσης με πιογλιταζόνη, η οποία προστέθηκε στα υπάρχοντα φάρμακα μελέτης. Δεν επιτρέπονται τιτλοποιήσεις δόσης του Onglyza και της μετφορμίνης.
Η προσθήκη Onglyza 2,5 mg και 5 mg στη μεφορμίνη προκάλεσε σημαντικές βελτιώσεις στην A1C, FPG και PPG σε σύγκριση με την προσθήκη εικονικού φαρμάκου στη μετφορμίνη (Πίνακας 4). Οι μέσες μεταβολές από την αρχική τιμή για την A1C με την πάροδο του χρόνου και στο τελικό σημείο παρουσιάζονται στο Σχήμα 1. Η αναλογία ασθενών που διέκοψαν λόγω έλλειψης γλυκαιμικού ελέγχου ή οι οποίοι διασώθηκαν για την ικανοποίηση προκαθορισμένων γλυκαιμικών κριτηρίων ήταν 15% στην ομάδα του Onglyza 2,5 mg σε ομάδα μετφορμίνης, 13% στην ομάδα του Onglyza 5 mg στην ομάδα της μετφορμίνης και 27% στην προσθήκη εικονικού φαρμάκου στη μετφορμίνη ομάδα.
Πίνακας 4: Γλυκαιμικές παράμετροι την Εβδομάδα 24 σε ελεγχόμενη με εικονικό φάρμακο μελέτη του Onglyza ως συνδυασμένη θεραπεία με μετφορμίνη *
| Παράμετρος αποτελεσματικότητας | Onglyza 2,5 mg + Μετφορμίνη Ν = 192 |
Onglyza 5 mg + Μετφορμίνη Ν = 191 |
Εικονικό φάρμακο + Μετφορμίνη Ν = 179 |
|---|---|---|---|
| * Πληθυσμός με στόχο την θεραπεία με τελευταία παρατήρηση κατά τη διάρκεια της μελέτης ή την τελευταία παρατήρηση πριν τη θεραπεία διάσωσης με πιογλιταζόνη για ασθενείς που χρειάζονται διάσωση. | |||
| â€ Η μέση τιμή των τετραγώνων είναι ρυθμισμένη ως προς τη βασική τιμή. | |||
| ντο τιμή ρ <0,0001 συγκριτικά με το εικονικό φάρμακο + μετφορμίνη | |||
| § τιμή ρ <0,05 σε σύγκριση με το εικονικό φάρμακο + μετφορμίνη | |||
| Αιμοσφαιρίνη A1C (%) | Ν = 186 | Ν = 186 | Ν = 175 |
| Βασική γραμμή (μέση τιμή) | 8.1 | 8.1 | 8.1 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | −0.6 | −0.7 | +0.1 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο†) | −0.7ντο | −0.8ντο | |
| 95% διάστημα εμπιστοσύνης | (−0.9, −0.5) | (−1.0, −0.6) | |
| Το ποσοστό των ασθενών που επιτυγχάνουν A1C <7% | 37% §(69/186) | 44% §(81/186) | 17% (29/175) |
| Γλυκόζη πλάσματος νηστείας (mg / dL) | Ν = 188 | Ν = 187 | Ν = 176 |
| Βασική γραμμή (μέση τιμή) | 174 | 179 | 175 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | −14 | −22 | +1 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο†) | −16 § | −23 § | |
| 95% διάστημα εμπιστοσύνης | (−23, −9) | (−30, −16) | |
| 2-ωρη μεταγευματική γλυκόζη (mg / dL) | Ν = 155 | Ν = 155 | Ν = 135 |
| Βασική γραμμή (μέση τιμή) | 294 | 296 | 295 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | −62 | −58 | −18 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο†) | −44 § | −40 § | |
| 95% διάστημα εμπιστοσύνης | (−60, −27) | (−56, −24) |
Εικόνα 1: Μέση μεταβολή από την αρχική τιμή της A1C σε ελεγχόμενη με εικονικό φάρμακο δοκιμή του Onglyza ως συνδυασμένη θεραπεία με μεθοφορμίνη *

* Περιλαμβάνει ασθενείς με τιμή βάσης και εβδομάδα 24.
Η εβδομάδα 24 (LOCF) περιλαμβάνει πληθυσμό με πρόθεση θεραπείας χρησιμοποιώντας τελευταία παρατήρηση σε μελέτη πριν από τη θεραπεία διάσωσης με πιογλιταζόνη για ασθενείς που χρειάζονται διάσωση. Η μέση αλλαγή από τη γραμμή βάσης προσαρμόζεται για την τιμή βάσης.
Πρόσθετη Θεραπεία Συνδυασμού με Θειαζολιδινεδιόνη
Συνολικά 565 ασθενείς με διαβήτη τύπου 2 συμμετείχαν σε αυτήν την τυχαιοποιημένη, διπλή-τυφλή, ελεγχόμενη με εικονικό φάρμακο μελέτη 24 εβδομάδων για την αξιολόγηση της την αποτελεσματικότητα και την ασφάλεια του Onglyza σε συνδυασμό με μια θειαζολιδινεδιόνη (TZD) σε ασθενείς με ανεπαρκή γλυκαιμικό έλεγχο (A1C ± 7% έως ± 10,5%) Μόνο TZD. Για να είναι κατάλληλη η εγγραφή, οι ασθενείς έπρεπε να είναι σε σταθερή δόση πιογλιταζόνης (30-45 mg μία φορά την ημέρα) ή ροσιγλιταζόνη (4 mg άπαξ ημερησίως ή 8 mg είτε μία φορά ημερησίως ή σε δύο διαιρεμένες δόσεις των 4 mg) για τουλάχιστον 12 εβδομάδες.
Οι ασθενείς που πληρούσαν τα κριτήρια επιλεξιμότητας εγγράφηκαν σε μία μόνο τυφλή δίαιτα και άσκηση διάρκειας 2 εβδομάδων κατά τη διάρκεια της οποίας οι ασθενείς έλαβαν TZD στη δόση τους πριν από τη μελέτη για όλη τη διάρκεια της θεραπείας μελέτη. Μετά την περίοδο εισαγωγής, οι επιλέξιμοι ασθενείς τυχαιοποιήθηκαν σε 2,5 mg ή 5 mg Onglyza ή εικονικό φάρμακο μαζί με την τρέχουσα δόση του TZD. Οι ασθενείς που δεν κατάφεραν να ανταποκριθούν σε συγκεκριμένους γλυκαιμικούς στόχους κατά τη διάρκεια της μελέτης υποβλήθηκαν σε θεραπεία με τη διάσωση με μετφορμίνη, η οποία προστέθηκε στα υπάρχοντα φάρμακα μελέτης. Η τιτλοποίηση της δόσης του Onglyza ή του TZD δεν επιτρέπεται κατά τη διάρκεια της μελέτης. Μία αλλαγή στο σχήμα TZD από τη ροσιγλιταζόνη στην πιογλιταζόνη σε συγκεκριμένες, ισοδύναμες θεραπευτικές δόσεις επιτράπηκε κατά την κρίση του ερευνητή εάν θεωρήθηκε ότι ήταν ιατρικά κατάλληλη.
Τα πρόσθετα Onglyza 2,5 mg και 5 mg στο TZD παρείχαν σημαντικές βελτιώσεις στους ασθενείς με A1C, FPG και PPG σε σύγκριση με το εικονικό φάρμακο που προστέθηκε στο TZD (Πίνακας 5). Το ποσοστό των ασθενών που διέκοψαν λόγω έλλειψης γλυκαιμικού ελέγχου ή οι οποίοι διασώθηκαν για την ικανοποίηση προκαθορισμένων γλυκαιμικών κριτηρίων ήταν 10% στην ομάδα του Onglyza 2,5 mg στην ομάδα TZD, 6% στην προσθήκη Onglyza 5 mg στην ομάδα TZD και 10% στο πρόσθετο placebo στο TZD ομάδα.
Πίνακας 5: Γλυκαιμικές παράμετροι την εβδομάδα 24 σε ελεγχόμενη με εικονικό φάρμακο μελέτη του Onglyza ως συνδυασμένη θεραπεία με θειαζολιδινεδιόνη *
| Παράμετρος αποτελεσματικότητας | Onglyza 2,5 mg + TZD Ν = 195 |
Onglyza 5 mg + TZD Ν = 186 |
Εικονικό φάρμακο + TZD Ν = 184 |
|---|---|---|---|
| * Ο πληθυσμός με σκοπό την θεραπεία με χρήση τελευταίας παρατήρησης στη μελέτη ή την τελευταία παρατήρηση πριν τη θεραπεία διάσωσης με μετφορμίνη για ασθενείς που χρειάζονται διάσωση. | |||
| â€ Η μέση τιμή των τετραγώνων είναι ρυθμισμένη ως προς τη βασική τιμή. | |||
| ντο τιμή ρ <0,0001 συγκριτικά με το εικονικό φάρμακο + TZD | |||
| § p-τιμή <0.05 σε σύγκριση με το εικονικό φάρμακο + TZD | |||
| Αιμοσφαιρίνη A1C (%) | Ν = 192 | Ν = 183 | Ν = 180 |
| Βασική γραμμή (μέση τιμή) | 8.3 | 8.4 | 8.2 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | −0.7 | −0.9 | −0.3 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο†) | −0.4 § | −0.6ντο | |
| 95% διάστημα εμπιστοσύνης | (−0.6, −0.2) | (−0.8, −0.4) | |
| Το ποσοστό των ασθενών που επιτυγχάνουν A1C <7% | 42% §(81/192) | 42% §(77/184) | 26% (46/180) |
| Γλυκόζη πλάσματος νηστείας (mg / dL) | Ν = 193 | Ν = 185 | Ν = 181 |
| Βασική γραμμή (μέση τιμή) | 163 | 160 | 162 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | −14 | −17 | −3 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο†) | −12 § | −15 § | |
| 95% διάστημα εμπιστοσύνης | (−20, −3) | (−23, −6) | |
| 2-ωρη μεταγευματική γλυκόζη (mg / dL) | Ν = 156 | Ν = 134 | Ν = 127 |
| Βασική γραμμή (μέση τιμή) | 296 | 303 | 291 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | −55 | −65 | −15 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο†) | −40 § | −50 § | |
| 95% διάστημα εμπιστοσύνης | (−56, −24) | (−66, −34) |
Πρόσθετη Θεραπεία Συνδυασμού με Γλυβουρίδη
Συνολικά 768 ασθενείς με διαβήτη τύπου 2 συμμετείχαν σε αυτήν την τυχαιοποιημένη, διπλά τυφλή, ελεγχόμενη με εικονικό φάρμακο μελέτη, διάρκειας 24 εβδομάδων, για την αξιολόγηση της αποτελεσματικότητας και της ασφάλειας του Onglyza σε συνδυασμό με μια σουλφονυλουρία (SU) σε ασθενείς με ανεπαρκή γλυκαιμικό έλεγχο κατά την εγγραφή (A1C ± 7,5% έως ± 10%) σε υπομέγιστη δόση SU μόνος. Προκειμένου να πληρούν τις προϋποθέσεις για εγγραφή, οι ασθενείς έπρεπε να βρίσκονται σε υπομέγιστη δόση SU για 2 μήνες ή και περισσότερο. Σε αυτή τη μελέτη, το Onglyza σε συνδυασμό με μια σταθερή, ενδιάμεση δόση του SU συγκρίθηκε με την τιτλοποίηση σε υψηλότερη δόση SU.
Οι ασθενείς που πληρούσαν τα κριτήρια επιλεξιμότητας εγγράφηκαν σε μία τυφλή, διάρκειας 4 εβδομάδων, δίαιτα και άσκηση, και τοποθετήθηκαν σε γλυβουρίδη 7,5 mg μία φορά την ημέρα. Μετά την περίοδο αναφοράς, οι επιλέξιμοι ασθενείς με A1C ± 7% έως ± 10% τυχαιοποιήθηκαν σε 2,5 ή 5 mg προσθήκης Onglyza σε 7,5 mg γλυβουρίδης ή σε εικονικό φάρμακο συν 10 mg συνολική ημερήσια δόση γλυβουρίδη. Οι ασθενείς που έλαβαν εικονικό φάρμακο ήταν επιλέξιμοι να αυξήσουν την τιτλοποίηση της γλυβουρίδης σε συνολική ημερήσια δόση των 15 mg. Η υπέρ-τιτλοποίηση της γλυβουρίδης δεν επιτρέπεται σε ασθενείς που έλαβαν Onglyza 2,5 mg ή 5 mg. Η γλυβουρίδη θα μπορούσε να τιτλοποιηθεί σε οποιαδήποτε ομάδα θεραπείας μία φορά κατά τη διάρκεια της περιόδου μελέτης 24 εβδομάδων λόγω υπογλυκαιμίας, όπως έκρινε απαραίτητο ο ερευνητής. Περίπου το 92% των ασθενών στην ομάδα του εικονικού φαρμάκου και της γλυβουρίδης αυξήθηκαν στην τελική συνολική ημερήσια δόση των 15 mg κατά τη διάρκεια των πρώτων 4 εβδομάδων της περιόδου μελέτης. Οι ασθενείς που δεν κατάφεραν να ανταποκριθούν σε συγκεκριμένους γλυκαιμικούς στόχους κατά τη διάρκεια της μελέτης υποβλήθηκαν σε θεραπεία με τη διάσωση με μετφορμίνη, η οποία προστέθηκε στην υπάρχουσα φαρμακευτική αγωγή της μελέτης. Η τιτλοποίηση της δόσης του Onglyza δεν επιτρέπεται κατά τη διάρκεια της μελέτης.
Σε συνδυασμό με γλυβουρίδη, το Onglyza 2,5 mg και 5 mg παρείχε σημαντικές βελτιώσεις στην A1C, FPG και PPG σε σύγκριση με την ομάδα εικονικού φαρμάκου με αυξημένη τιτλοποίηση της γλυβουρίδης (Πίνακας 6). Το ποσοστό των ασθενών που διέκοψαν λόγω έλλειψης γλυκαιμικού ελέγχου ή οι οποίοι διασώθηκαν για την ικανοποίηση προκαθορισμένων γλυκαιμικών κριτηρίων ήταν 18% το πρόσθετο Onglyza 2,5 mg στην ομάδα γλυβουρίδης, το 17% στην ομάδα προσθήκης Οnglyza 5 mg σε γλυβουρίδη και το 30% στο εικονικό φάρμακο συν αυξημένη τιτλοποίηση της γλυβουρίδης ομάδα.
Πίνακας 6: Γλυκαιμικές παράμετροι την Εβδομάδα 24 σε ελεγχόμενη με εικονικό φάρμακο μελέτη του Onglyza ως συνδυασμένη θεραπεία με Glyburide *
| Παράμετρος αποτελεσματικότητας | Onglyza 2,5 mg + Γλυβουρίδη 7,5 mg Ν = 248 |
Onglyza 5 mg + Γλυβουρίδη 7,5 mg Ν = 253 |
Εικονικό φάρμακο + Ανώτατη τιτλοφορούμενη γλυβουρίδη Ν = 267 |
|---|---|---|---|
| * Ο πληθυσμός με σκοπό την θεραπεία με χρήση τελευταίας παρατήρησης στη μελέτη ή την τελευταία παρατήρηση πριν τη θεραπεία διάσωσης με μετφορμίνη για ασθενείς που χρειάζονται διάσωση. | |||
| â€ Η μέση τιμή των τετραγώνων είναι ρυθμισμένη ως προς τη βασική τιμή. | |||
| ντο τιμή ρ <0,0001 συγκριτικά με το εικονικό φάρμακο + αυξημένη τιτλοποίηση της γλυβουρίδης | |||
| § τιμή ρ <0,05 σε σύγκριση με εικονικό φάρμακο + αυξημένη τιτλοποίηση γλυβουρίδης | |||
| Αιμοσφαιρίνη A1C (%) | Ν = 246 | Ν = 250 | Ν = 264 |
| Βασική γραμμή (μέση τιμή) | 8.4 | 8.5 | 8.4 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | −0.5 | −0.6 | +0.1 |
| Η διαφορά από την αυξημένη τιτλοποίηση της γλυβουρίδης (προσαρμοσμένη μέση τιμή†) | −0.6ντο | −0.7ντο | |
| 95% διάστημα εμπιστοσύνης | (−0.8, −0.5) | (−0.9, −0.6) | |
| Το ποσοστό των ασθενών που επιτυγχάνουν A1C <7% | 22% §(55/246) | 23% §(57/250) | 9% (24/264) |
| Γλυκόζη πλάσματος νηστείας (mg / dL) | Ν = 247 | Ν = 252 | Ν = 265 |
| Βασική γραμμή (μέση τιμή) | 170 | 175 | 174 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | −7 | −10 | +1 |
| Η διαφορά από την αυξημένη τιτλοποίηση της γλυβουρίδης (προσαρμοσμένη μέση τιμή†) | −8 § | −10 § | |
| 95% διάστημα εμπιστοσύνης | (−14, −1) | (−17, −4) | |
| 2-ωρη μεταγευματική γλυκόζη (mg / dL) | Ν = 195 | Ν = 202 | Ν = 206 |
| Βασική γραμμή (μέση τιμή) | 309 | 315 | 323 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | −31 | −34 | +8 |
| Η διαφορά από την αυξημένη τιτλοποίηση της γλυβουρίδης (προσαρμοσμένη μέση τιμή†) | −38 § | −42 § | |
| 95% διάστημα εμπιστοσύνης | (−50, −27) | (−53, −31) |
Συγχορήγηση με μετφορμίνη σε ασθενείς που δεν είχαν λάβει προηγούμενη θεραπεία
Συνολικά 1306 ασθενείς με σακχαρώδη διαβήτη τύπου 2 συμμετείχαν σε αυτήν την τυχαιοποιημένη, διπλή-τυφλή, ελεγχόμενη με εικονικό φάρμακο δοκιμή διάρκειας 24 εβδομάδων αξιολογεί την αποτελεσματικότητα και την ασφάλεια του Onglyza συγχορηγούμενου με μετφορμίνη σε ασθενείς με ανεπαρκή γλυκαιμικό έλεγχο (A1C ± 8% έως ± 12%) στη διατροφή και την άσκηση μόνος. Οι ασθενείς έπρεπε να είναι αρχικά για θεραπεία για να εγγραφούν σε αυτή τη μελέτη.
Οι ασθενείς που πληρούσαν τα κριτήρια επιλεξιμότητας εγγράφηκαν σε μια περίοδο τυφλών, 1 εβδομάδων, δίαιτα και άσκηση placebo. Οι ασθενείς τυχαιοποιήθηκαν σε ένα από τα τέσσερα σκέλη θεραπείας: Onglyza 5 mg + μετφορμίνη 500 mg, σαξαγλιπτίνη 10 mg + μετφορμίνη 500 mg, σαξαγλιπτίνη 10 mg + εικονικό φάρμακο ή μετφορμίνη 500 mg + εικονικό φάρμακο. Το Onglyza χορηγήθηκε μία φορά ημερησίως. Στις 3 ομάδες θεραπείας που χρησιμοποίησαν μετφορμίνη, η δόση της μετφορμίνης αυξήθηκε εβδομαδιαίως σε δόσεις των 500 mg ημερησίως, ως ανεκτές, σε μέγιστο ποσό των 2000 mg ημερησίως με βάση την FPG. Ασθενείς που δεν κατάφεραν να εκπληρώσουν συγκεκριμένους στόχους γλυκεϊκής κατά τη διάρκεια των μελετών, υποβλήθηκαν σε θεραπεία με τη θεραπεία διάσωσης πιογλιταζόνης ως πρόσθετη θεραπεία.
Η συγχορήγηση του Onglyza 5 mg μαζί με μετφορμίνη έδωσε σημαντικές βελτιώσεις στην A1C, FPG και PPG σε σύγκριση με το εικονικό φάρμακο συν μετφορμίνη (Πίνακας 7).
Πίνακας 7: Γλυκαιμικές παράμετροι την Εβδομάδα 24 σε ελεγχόμενη με εικονικό φάρμακο δοκιμή συγχορήγησης Onglyza με μετφορμίνη σε ασθενείς που δεν είχαν λάβει θεραπεία
| Παράμετρος αποτελεσματικότητας | Onglyza 5 mg + Μετφορμίνη Ν = 320 |
Εικονικό φάρμακο + Μετφορμίνη Ν = 328 |
|---|---|---|
| * Πληθυσμός με στόχο την θεραπεία με τελευταία παρατήρηση κατά τη διάρκεια της μελέτης ή την τελευταία παρατήρηση πριν τη θεραπεία διάσωσης με πιογλιταζόνη για ασθενείς που χρειάζονται διάσωση. | ||
| â€ Η μέση τιμή των τετραγώνων είναι ρυθμισμένη ως προς τη βασική τιμή. | ||
| ντο τιμή ρ <0,0001 συγκριτικά με το εικονικό φάρμακο + μετφορμίνη | ||
| § τιμή ρ <0,05 σε σύγκριση με το εικονικό φάρμακο + μετφορμίνη | ||
| Αιμοσφαιρίνη A1C (%) | Ν = 306 | Ν = 313 |
| Βασική γραμμή (μέση τιμή) | 9.4 | 9.4 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | −2.5 | −2.0 |
| Διαφορά από εικονικό φάρμακο + μετφορμίνη (προσαρμοσμένη μέση τιμή)†) | −0.5ντο | |
| 95% διάστημα εμπιστοσύνης | (−0.7, −0.4) | |
| Το ποσοστό των ασθενών που επιτυγχάνουν A1C <7% | 60% §(185/307) | 41% (129/314) |
| Γλυκόζη πλάσματος νηστείας (mg / dL) | Ν = 315 | Ν = 320 |
| Βασική γραμμή (μέση τιμή) | 199 | 199 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | −60 | −47 |
| Διαφορά από εικονικό φάρμακο + μετφορμίνη (προσαρμοσμένη μέση τιμή)†) | −13 § | |
| 95% διάστημα εμπιστοσύνης | (−19, −6) | |
| 2-ωρη μεταγευματική γλυκόζη (mg / dL) | Ν = 146 | Ν = 141 |
| Βασική γραμμή (μέση τιμή) | 340 | 355 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | −138 | −97 |
| Διαφορά από εικονικό φάρμακο + μετφορμίνη (προσαρμοσμένη μέση τιμή)†) | −41 § | |
| 95% διάστημα εμπιστοσύνης | (−57, −25) |
μπλουζα
Πώς παρέχεται
Τα δισκία Onglyza ™ (σαξαγλιπτίνη) φέρουν σημάνσεις και από τις δύο πλευρές και διατίθενται στις δυνάμεις και τις συσκευασίες που παρατίθενται στον πίνακα 8.
| Δισκίο Δύναμη |
Ταινία με επικάλυψη Χρώμα / Σχήμα |
Δισκίο Σημάνσεις |
μέγεθος πακέτου | Κωδικός NDC |
|---|---|---|---|---|
| 5 mg | ροζ αμφίκυρτη, στρογγυλή |
"5" στη μία πλευρά και "4215" στο πίσω μέρος, με μπλε μελάνι | Φιάλες των 30 Φιάλες του 90 Φιάλες των 500 Κυψέλη των 100 |
0003-4215-11 0003-4215-21 0003-4215-31 0003-4215-41 |
| 2,5 mg | ανοικτό κίτρινο έως ανοικτό κίτρινο αμφίκυρτη, στρογγυλή |
"2,5" στη μία πλευρά και "4214" στο πίσω μέρος, με μπλε μελάνι | Φιάλες των 30 Φιάλες του 90 |
0003-4214-11 0003-4214-21 |
Αποθήκευση και χειρισμός
Φυλάσσεται στους 20 ° -25 ° C (68 ° -77 ° F). επιτρέπονται εκδρομές στους 15 ° -30 ° C (59 ° -86 ° F) [βλέπε USP Ελεγχόμενη θερμοκρασία δωματίου].
μπλουζα
Τελευταία ενημέρωση: 07/09
Ε. R. Squibb & Sons, L.L.C.
Onglyza πληροφορίες για τους ασθενείς
Λεπτομερείς πληροφορίες για σημεία, συμπτώματα, αιτίες, θεραπείες διαβήτη
Οι πληροφορίες σε αυτή τη μονογραφία δεν προορίζονται να καλύψουν όλες τις πιθανές χρήσεις, οδηγίες, προφυλάξεις, αλληλεπιδράσεις φαρμάκων ή ανεπιθύμητες ενέργειες. Αυτές οι πληροφορίες είναι γενικευμένες και δεν προορίζονται ως συγκεκριμένες ιατρικές συμβουλές. Εάν έχετε απορίες σχετικά με τα φάρμακα που παίρνετε ή θέλετε περισσότερες πληροφορίες, επικοινωνήστε με το γιατρό σας, το φαρμακοποιό ή τη νοσοκόμα σας.
πίσω στο: Περιηγηθείτε σε όλα τα φάρμακα για τον διαβήτη



