Janumet για τη θεραπεία του διαβήτη
Εμπορικό σήμα: Janumet
Γενικό όνομα: Σιταγλιπτίνη και υδροχλωρική μετφορμίνη
Περιεχόμενα:
Ενδείξεις και χρήση
Δοσολογία και χορήγηση
Μορφές Δοσολογίας και Πλεονεκτήματα
Αντενδείξεις
Προειδοποιήσεις και προφυλάξεις
Ανεπιθύμητες ενέργειες
Αλληλεπιδράσεις με άλλα φάρμακα
Χρήση σε συγκεκριμένους πληθυσμούς
Υπερβολική δόση
Περιγραφή
Φαρμακολογία
Μη κλινική τοξικολογία
Κλινικές μελέτες
Πώς παρέχεται
Πληροφορίες για την παροχή συμβουλών σε ασθενείς
Janumet, σιταγλιπτίνη και υδροχλωρική μετφορμίνη, πληροφορίες για τους ασθενείς (στην απλή αγγλική γλώσσα)
ΠΡΟΕΙΔΟΠΟΙΗΣΗ: ΛΑΚΤΙΚΗ ΟΞΕΙΔΩΣΗ
Η γαλακτική οξέωση είναι μια σπάνια, αλλά σοβαρή επιπλοκή που μπορεί να συμβεί λόγω συσσώρευσης μετφορμίνης. Ο κίνδυνος αυξάνεται με καταστάσεις όπως σηψαιμία, αφυδάτωση, υπερβολική πρόσληψη αλκοόλ, ηπατική ανεπάρκεια, νεφρική δυσλειτουργία και οξεία συμφορητική καρδιακή ανεπάρκεια.
Η έναρξη είναι συχνά λεπτή, συνοδευόμενη μόνο από μη ειδικά συμπτώματα όπως αίσθημα κακουχίας, μυαλγίες, αναπνευστική δυσχέρεια, αυξημένη υπνηλία και μη ειδική κοιλιακή δυσφορία. Οι εργαστηριακές ανωμαλίες περιλαμβάνουν χαμηλό pH, αυξημένο χάσμα ανιόντων και αυξημένο γαλακτικό αίμα.
Εάν υπάρχει υποψία ύπαρξης οξέωσης, Janumet1 θα πρέπει να διακόπτεται και ο ασθενής να νοσηλεύεται αμέσως. [Βλέπω Προειδοποιήσεις και προφυλάξεις]
Ενδείξεις και χρήση
Το Janumet ενδείκνυται ως συμπλήρωμα στη δίαιτα και την άσκηση για τη βελτίωση του γλυκαιμικού ελέγχου σε ενήλικες με σακχαρώδη διαβήτη τύπου 2 όταν η θεραπεία με σιταγλιπτίνη και μετφορμίνη είναι κατάλληλη. [Βλέπω Κλινικές μελέτες.]
Σημαντικοί Περιορισμοί Χρήσης
Το Janumet δεν πρέπει να χορηγείται σε ασθενείς με διαβήτη τύπου 1 ή για τη θεραπεία της διαβητικής κετοξέωσης, καθώς δεν θα ήταν αποτελεσματικό σε αυτές τις ρυθμίσεις.
Το Janumet δεν έχει μελετηθεί σε συνδυασμό με ινσουλίνη.
μπλουζα
Δοσολογία και χορήγηση
Συνιστώμενη δοσολογία
Η δοσολογία της αντιυπεργλυκαιμικής θεραπείας με το Janumet θα πρέπει να εξατομικεύεται με βάση την τρέχουσα θεραπευτική αγωγή του ασθενούς, αποτελεσματικότητα και ανεκτικότητα, ενώ δεν υπερβαίνει τη μέγιστη συνιστώμενη ημερήσια δόση των 100 mg σιταγλιπτίνης και 2000 mg μετφορμίνη. Η αρχική θεραπεία συνδυασμού ή η συντήρηση της συνδυασμένης θεραπείας θα πρέπει να εξατομικεύεται και να αφήνεται στη διακριτική ευχέρεια του παρόχου υγειονομικής περίθαλψης.
Το Janumet πρέπει γενικά να χορηγείται δύο φορές την ημέρα με γεύματα, με σταδιακή κλιμάκωση της δόσης, για τη μείωση των παρενεργειών του γαστρεντερικού (GI) που οφείλονται στη μετφορμίνη.
Η δόση έναρξης του Janumet πρέπει να βασίζεται στο τρέχον θεραπευτικό σχήμα του ασθενούς. Το Janumet πρέπει να χορηγείται δύο φορές την ημέρα με γεύματα. Οι ακόλουθες δόσεις είναι διαθέσιμες:
50 mg σιταγλιπτίνης / 500 mg υδροχλωρικής μετφορμίνης
50 mg σιταγλιπτίνης / 1000 mg υδροχλωρικής μετφορμίνης.
Οι ασθενείς δεν ελέγχονται επαρκώς με δίαιτα και άσκηση μόνο
Εάν η θεραπεία με δισκίο συνδυασμού που περιέχει σιταγλιπτίνη και μετφορμίνη θεωρείται κατάλληλη για έναν ασθενή με σακχαρώδη διαβήτη τύπου 2 ανεπαρκώς ελεγχόμενη με δίαιτα και άσκηση μόνο, η συνιστώμενη δόση έναρξης είναι 50 mg σιταγλιπτίνης / 500 mg υδροχλωρικής μετφορμίνης δύο φορές καθημερινά. Ασθενείς με ανεπαρκή γλυκαιμικό έλεγχο αυτής της δόσης μπορούν να τιτλοποιηθούν έως και 50 mg σιταγλιπτίνης / 1000 mg υδροχλωρικής μετφορμίνης δύο φορές την ημέρα.
Οι ασθενείς δεν ελέγχονται επαρκώς με τη μονοθεραπεία με μετφορμίνη
Εάν η θεραπεία με δισκίο συνδυασμού που περιέχει σιταγλιπτίνη και μετφορμίνη θεωρείται κατάλληλη για έναν ασθενή που δεν ελέγχεται επαρκώς μόνο με μετφορμίνη, η συνιστώμενη δόση έναρξης του Janumet θα πρέπει να παρέχει σιταγλιπτίνη σε δόση 50 mg δύο φορές την ημέρα (συνολική ημερήσια δόση 100 mg) και η δόση μετφορμίνης ληφθεί. Για τους ασθενείς που λαμβάνουν μετφορμίνη 850 mg δύο φορές την ημέρα, η συνιστώμενη αρχική δόση του Janumet είναι 50 mg σιταγλιπτίνης / 1000 mg υδροχλωρικής μετφορμίνης δύο φορές την ημέρα.
Οι ασθενείς δεν ελέγχονται επαρκώς με μονοθεραπεία με σιταγλιπτίνη
Εάν η θεραπεία με ένα δισκίο συνδυασμού που περιέχει σιταγλιπτίνη και μετφορμίνη θεωρείται κατάλληλη για τον ασθενή ανεπαρκώς ελεγχόμενη μόνο με σιταγλιπτίνη, η συνιστώμενη αρχική δόση του Janumet είναι 50 mg σιταγλιπτίνης / 500 mg υδροχλωρικής μετφορμίνης δύο φορές καθημερινά. Οι ασθενείς με ανεπαρκή έλεγχο αυτής της δόσης μπορούν να τιτλοφορηθούν έως και 50 mg σιταγλιπτίνης / 1000 mg υδροχλωρικής μετφορμίνης δύο φορές την ημέρα. Οι ασθενείς που λαμβάνουν μονοθεραπεία σιταγλιπτίνης με δοσοεξαρτώμενη δόση για νεφρική ανεπάρκεια δεν πρέπει να μεταβούν στο Janumet [βλ. Αντενδείξεις].
Ασθενείς που αλλάζουν από τη συγχορήγηση σιταγλιπτίνης και μετφορμίνης
Για τους ασθενείς που αλλάζουν από τη σιταγλιπτίνη που συγχορηγείται με μετφορμίνη, το Janumet μπορεί να ξεκινήσει με τη δόση σιταγλιπτίνης και μετφορμίνης που λαμβάνεται ήδη.
Ασθενείς ανεπαρκώς ελεγχόμενοι από διπλή θεραπεία συνδυασμού με οποιονδήποτε από τους ακόλουθους αντιυπεργλυκαιμικούς παράγοντες: σιταγλιπτίνη, μετφορμίνη ή σουλφονυλουρία
Εάν η θεραπεία με ένα δισκίο συνδυασμού που περιέχει σιταγλιπτίνη και μετφορμίνη θεωρείται κατάλληλη σε αυτό η συνήθης αρχική δόση του Janumet θα πρέπει να παρέχει σιταγλιπτίνη σε δόση 50 mg δύο φορές την ημέρα (συνολικά 100 mg ημερήσια δόση). Κατά τον προσδιορισμό της δόσης έναρξης της συνιστώσας μετφορμίνης, πρέπει να λαμβάνεται υπόψη το επίπεδο γλυκαιμικού ελέγχου του ασθενούς και η τρέχουσα δόση (εάν υπάρχει) της μετφορμίνης. Πρέπει να ληφθεί υπόψη η σταδιακή κλιμάκωση της δόσης για τη μείωση των παρενεργειών στο γαστρεντερικό (γαστρεντερικό) (GI) που σχετίζονται με τη μετφορμίνη. Οι ασθενείς που βρίσκονται επί του παρόντος ή εκκινούν μια σουλφονυλουρία μπορεί να απαιτούν χαμηλότερες δόσεις σουλφονυλουρίας για να μειώσουν τον κίνδυνο υπογλυκαιμίας [βλ. Προειδοποιήσεις και προφυλάξεις].
Δεν έχουν διεξαχθεί μελέτες που να εξετάζουν συγκεκριμένα την ασφάλεια και αποτελεσματικότητα του Janumet σε ασθενείς που έχουν προηγουμένως υποβληθεί σε θεραπεία με άλλους αντιυπεργλυκαιμικούς παράγοντες από το στόμα και να έχουν αλλάξει σε Janumet. Οποιαδήποτε αλλαγή στη θεραπεία του διαβήτη τύπου 2 πρέπει να γίνεται με προσοχή και κατάλληλη παρακολούθηση, καθώς μπορεί να εμφανιστούν μεταβολές στον γλυκαιμικό έλεγχο.
μπλουζα
Μορφές Δοσολογίας και Πλεονεκτήματα
- Τα δισκία των 50 mg / 500 mg είναι ανοιχτό ροζ, σε σχήμα κάψουλας, επικαλυμμένα με λεπτό υμένιο δισκία με χαραγμένη στη μία πλευρά "575".
- Τα δισκία των 50 mg / 1000 mg είναι κόκκινα, επικαλυμμένα με λεπτό υμένιο δισκία με σχήμα κάψουλας, με χαραγμένη στη μία πλευρά "577".
μπλουζα
Αντενδείξεις
Το Janumet (σιταγλιπτίνη / μετφορμίνη HCl) αντενδείκνυται σε ασθενείς με:
- Η νεφρική νόσο ή η νεφρική δυσλειτουργία, όπως υποδηλώνεται από τα επίπεδα κρεατινίνης ορού ≥ 1,5 mg / dL [αρσενικά], ≥ 1,4 mg / dL [θηλυκά] ή μη φυσιολογικά η κάθαρση κρεατινίνης που μπορεί επίσης να προκύψει από καταστάσεις όπως η καρδιαγγειακή κατάρρευση (σοκ), το οξύ έμφραγμα του μυοκαρδίου και η σηψαιμία [βλέπω Προειδοποιήσεις και προφυλάξεις].
- Οξεία ή χρόνια μεταβολική οξέωση, συμπεριλαμβανομένης της διαβητικής κετοξέωσης, με ή χωρίς κώμα.
- Ιστορικό σοβαρής αντίδρασης υπερευαισθησίας στο Janumet ή σε σιταγλιπτίνη (ένα από τα συστατικά του Janumet), όπως αναφυλαξία ή αγγειοοίδημα. [Βλέπω Προειδοποιήσεις και προφυλάξεις και Ανεπιθύμητες ενέργειες.]
Το Janumet θα πρέπει να διακόπτεται προσωρινά σε ασθενείς που υποβάλλονται σε ακτινολογικές μελέτες που αφορούν ενδοαγγειακό χορήγηση ιωδιούχων υλικών αντίθεσης, επειδή η χρήση τέτοιων προϊόντων μπορεί να οδηγήσει σε οξεία αλλοίωση των νεφρών λειτουργία [βλ Προειδοποιήσεις και προφυλάξεις].
μπλουζα
Προειδοποιήσεις και προφυλάξεις
Γαλακτική οξείδωση
Υδροχλωρική μετφορμίνη
Η γαλακτική οξέωση είναι μια σπάνια αλλά σοβαρή μεταβολική επιπλοκή που μπορεί να εμφανιστεί λόγω συσσώρευσης μετφορμίνης κατά τη διάρκεια της θεραπείας με Janumet. όταν συμβαίνει, είναι θανατηφόρο σε περίπου 50% των περιπτώσεων. Η γαλακτική οξέωση μπορεί επίσης να συμβεί σε συνδυασμό με μια σειρά παθοφυσιολογικών καταστάσεων, συμπεριλαμβανομένου του σακχαρώδους διαβήτη, και κάθε φορά που υπάρχει σημαντική υπο-διήθηση ιστού και υποξαιμία. Η γαλακτική οξέωση χαρακτηρίζεται από αυξημένα επίπεδα γαλακτικού αίματος (> 5 mmol / L), μειωμένο pH αίματος, διαταραχές ηλεκτρολυτών με αυξημένο χάσμα ανιόντων και αυξημένη αναλογία γαλακτικού / πυροσταφυλικού. Όταν η μετφορμίνη εμπλέκεται ως η αιτία της γαλακτικής οξέωσης, τα επίπεδα της μετφορμίνης στο πλάσμα> 5 μg / ml γενικά βρίσκονται.
Η συχνότητα εμφάνισης της γαλακτικής οξέωσης σε ασθενείς που λαμβάνουν υδροχλωρική μετφορμίνη είναι πολύ χαμηλή (περίπου 0,03 περιπτώσεις / 1000 ασθενείς-έτη, με περίπου 0,015 θανατηφόρες περιπτώσεις / 1000 έτη ασθενών). Σε περισσότερες από 20.000 ασθενείς-έτη έκθεσης στη μετφορμίνη σε κλινικές δοκιμές, δεν υπήρξαν αναφορές γαλακτικής οξέωσης. Οι αναφερθείσες περιπτώσεις εμφανίστηκαν κυρίως σε διαβητικούς ασθενείς με σημαντική νεφρική ανεπάρκεια, συμπεριλαμβανομένων και των δύο ενδογενών νεφρών της νόσου και της νεφρικής υποπερατότητας, συχνά στη ρύθμιση πολλαπλών ταυτόχρονων ιατρικών / χειρουργικών προβλημάτων και πολλαπλών συνακόλουθων φάρμακα. Ασθενείς με συμφορητική καρδιακή ανεπάρκεια που απαιτούν φαρμακολογική διαχείριση, ιδίως εκείνοι με ασταθή ή οξεία συμφορητική καρδιακή ανεπάρκεια, οι οποίοι κινδυνεύουν από υποδιήθηση και υποξαιμία, διατρέχουν αυξημένο κίνδυνο να παρουσιάσουν γαλακτική αλκαλική ύφεσις αίματος. Ο κίνδυνος γαλακτικής οξέωσης αυξάνεται με το βαθμό νεφρικής δυσλειτουργίας και την ηλικία του ασθενούς. Συνεπώς, ο κίνδυνος γαλακτικής οξέωσης μπορεί να μειωθεί σημαντικά με την τακτική παρακολούθηση της νεφρικής λειτουργίας σε ασθενείς που λαμβάνουν μετφορμίνη και με τη χρήση της ελάχιστης αποτελεσματικής δόσης μετφορμίνης. Ειδικότερα, η θεραπεία των ηλικιωμένων πρέπει να συνοδεύεται από προσεκτική παρακολούθηση της νεφρικής λειτουργίας. Η θεραπεία με μετφορμίνη δεν πρέπει να ξεκινά σε ασθενείς ηλικίας ≥ 80 ετών, εκτός εάν μετρηθεί η κάθαρση κρεατινίνης αποδεικνύει ότι η νεφρική λειτουργία δεν μειώνεται, καθώς αυτοί οι ασθενείς είναι πιο ευάλωτοι στην ανάπτυξη γαλακτικής οξέωσης. Επιπλέον, η μετφορμίνη πρέπει να παρακρατείται αμέσως, υπό την παρουσία οποιασδήποτε κατάστασης που σχετίζεται με υποξαιμία, αφυδάτωση ή σήψη. Επειδή η εξασθενημένη ηπατική λειτουργία μπορεί να περιορίσει σημαντικά την ικανότητα καθαρισμού του γαλακτικού οξέος, η μετφορμίνη πρέπει γενικά να αποφεύγεται σε ασθενείς με κλινικές ή εργαστηριακές ενδείξεις ηπατικής νόσου. Οι ασθενείς θα πρέπει να προειδοποιούνται για υπερβολική κατανάλωση αλκοόλ, είτε οξείες είτε χρόνιες, όταν λαμβάνουν μετφορμίνη, καθώς το αλκοόλ ενισχύει τις επιδράσεις της υδροχλωρικής μετφορμίνης στον μεταβολισμό των γαλακτικών. Επιπλέον, η μετφορμίνη θα πρέπει να διακόπτεται προσωρινά πριν από οποιαδήποτε ενδοαγγειακή μελέτη ραδιομετατροπής και για οποιαδήποτε χειρουργική επέμβαση [βλ. Προειδοποιήσεις και προφυλάξεις].
Η εμφάνιση γαλακτικής οξέωσης συχνά είναι λεπτή και συνοδεύεται μόνο από μη ειδικά συμπτώματα όπως αίσθημα κακουχίας, μυαλγίες, αναπνευστική δυσχέρεια, αυξημένη υπνηλία και μη ειδική κοιλιακή δυσφορία. Μπορεί να υπάρχει σχετική υποθερμία, υπόταση και ανθεκτικές βραδυαρρυθμίες με πιο έντονη οξέωση. Ο ασθενής και ο γιατρός του ασθενούς πρέπει να γνωρίζουν την πιθανή σημασία αυτών των συμπτωμάτων και ο ασθενής θα πρέπει να ενημερώνεται για να ειδοποιήσει αμέσως τον γιατρό εάν εμφανιστούν [βλ. Προειδοποιήσεις και προφυλάξεις]. Η μετφορμίνη θα πρέπει να αποσυρθεί έως ότου διασαφηνιστεί η κατάσταση. Οι ηλεκτρολύτες στον ορό, οι κετόνες, η γλυκόζη στο αίμα και, εάν ενδείκνυται, το pH του αίματος, τα επίπεδα γαλακτικού οξέος και ακόμη και τα επίπεδα μετφορμίνης στο αίμα μπορεί να είναι χρήσιμα. Μόλις ο ασθενής σταθεροποιηθεί σε οποιοδήποτε επίπεδο δόσης μετφορμίνης, τα γαστρεντερικά συμπτώματα, τα οποία είναι κοινά κατά την έναρξη της θεραπείας, είναι απίθανο να σχετίζονται με το φάρμακο. Η μεταγενέστερη εμφάνιση γαστρεντερικών συμπτωμάτων μπορεί να οφείλεται σε γαλακτική οξέωση ή άλλη σοβαρή νόσο.
Τα επίπεδα του φλεβικού γαλακτικού πλάσματος με νηστεία πάνω από το ανώτατο όριο του φυσιολογικού αλλά λιγότερο από 5 mmol / L σε ασθενείς που λαμβάνουν μετφορμίνη δεν δείχνουν απαραίτητα επικείμενη γαλακτική και μπορεί να εξηγηθεί από άλλους μηχανισμούς, όπως ο κακώς ελεγχόμενος διαβήτης ή η παχυσαρκία, η έντονη σωματική δραστηριότητα ή τα τεχνικά προβλήματα στη διαχείριση του δείγματος [βλέπω Προειδοποιήσεις και προφυλάξεις].
Θα πρέπει να υπάρχει υποψία γαλακτικής οξέωσης σε οποιονδήποτε διαβητικό ασθενή με μεταβολική οξέωση χωρίς στοιχεία κετοξέωσης (κετονουρία και κετοναιμία).
Η γαλακτική οξέωση είναι ιατρική κατάσταση που πρέπει να αντιμετωπιστεί σε νοσοκομειακό περιβάλλον. Σε έναν ασθενή με γαλακτική οξέωση που παίρνει μετφορμίνη, το φάρμακο θα πρέπει να διακόπτεται αμέσως και να λαμβάνονται άμεσα γενικά υποστηρικτικά μέτρα. Επειδή η υδροχλωρική μετφορμίνη είναι διαλυτή (με κάθαρση μέχρι 170 mL / min υπό καλή αιμοδυναμική συνθήκες), συνιστάται η ταχεία αιμοδιύλιση για να διορθωθεί η οξέωση και να απομακρυνθεί η συσσωρευμένη μετφορμίνη. Μια τέτοια διαχείριση συχνά οδηγεί σε άμεση αναστροφή των συμπτωμάτων και ανάκαμψη [βλ Αντενδείξεις; Προειδοποιήσεις και προφυλάξεις].
Βλάβη της ηπατικής λειτουργίας
Επειδή η μειωμένη ηπατική λειτουργία έχει συσχετιστεί με κάποιες περιπτώσεις γαλακτικής οξέωσης, το Janumet πρέπει γενικά να αποφεύγεται σε ασθενείς με κλινικές ή εργαστηριακές ενδείξεις ηπατικής νόσου.
Αξιολόγηση της νεφρικής λειτουργίας
Η μετφορμίνη και η σιταγλιπτίνη είναι γνωστό ότι ουσιαστικά απεκκρίνονται από το νεφρό. Ο κίνδυνος συσσώρευσης μετφορμίνης και γαλακτικής οξέωσης αυξάνεται με τον βαθμό εξασθένισης της νεφρικής λειτουργίας. Έτσι, οι ασθενείς με επίπεδα κρεατινίνης ορού πάνω από το ανώτερο φυσιολογικό όριο για την ηλικία τους δεν πρέπει να λαμβάνουν Janumet. Στους ηλικιωμένους, το Janumet πρέπει να τιτλοφορείται προσεκτικά για να καθοριστεί η ελάχιστη δόση για επαρκή γλυκαιμική δράση, επειδή η γήρανση μπορεί να συσχετιστεί με μειωμένη νεφρική λειτουργία. [Βλέπω Προειδοποιήσεις και προφυλάξεις και Χρήση σε συγκεκριμένους πληθυσμούς.]
Πριν από την έναρξη της θεραπείας με Janumet και τουλάχιστον ετησίως μετά από αυτήν, η νεφρική λειτουργία θα πρέπει να αξιολογείται και να επαληθεύεται κανονικά. Σε ασθενείς στους οποίους αναμένεται ανάπτυξη νεφρικής δυσλειτουργίας, ιδιαίτερα σε ηλικιωμένους ασθενείς, νεφρική πρέπει να αξιολογείται συχνότερα και το Janumet να διακόπτεται εάν υπάρχουν ενδείξεις νεφρικής ανεπάρκειας παρόν.
Βιταμίνη Β12 Επίπεδα
Σε ελεγχόμενες κλινικές δοκιμές με μετφορμίνη διάρκειας 29 εβδομάδων, μείωση σε υποθετικά επίπεδα προηγουμένως φυσιολογικού ορού Βιταμίνης Β12 επίπεδα, χωρίς κλινικές εκδηλώσεις, παρατηρήθηκε σε περίπου 7% των ασθενών. Μια τέτοια μείωση, πιθανώς λόγω παρεμβολής με το Β12 απορρόφηση από το Β12-συγκεντρωτικού παράγοντα, πολύ σπάνια συσχετίζεται με αναιμία και φαίνεται να είναι ταχέως αναστρέψιμη με διακοπή της μετφορμίνης ή της βιταμίνης Β12 συμπλήρωση. Η μέτρηση των αιματολογικών παραμέτρων σε ετήσια βάση συνιστάται σε ασθενείς με Janumet και οι προφανείς ανωμαλίες θα πρέπει να διερευνηθούν και να αντιμετωπιστούν κατάλληλα. [Βλέπω Ανεπιθύμητες ενέργειες.]
Ορισμένα άτομα (τα άτομα με ανεπαρκή βιταμίνη Β12 ή πρόσληψη ή απορρόφηση ασβεστίου) φαίνεται να είναι προδιάθεση για την ανάπτυξη υπο-φυσιολογικής βιταμίνης Β12 επίπεδα. Σε αυτούς τους ασθενείς, η συνηθισμένη βιταμίνη Β ορού12 οι μετρήσεις σε διαστήματα δύο έως τριών ετών μπορεί να είναι χρήσιμες.
Η πρόσληψη αλκοόλ
Το αλκοόλ είναι γνωστό ότι ενισχύει την επίδραση της μετφορμίνης στον μεταβολισμό του γαλακτικού οξέος. Συνεπώς, οι ασθενείς θα πρέπει να προειδοποιούνται για υπερβολική πρόσληψη αλκοόλ, οξεία ή χρόνια, ενώ λαμβάνουν Janumet.
Χειρουργικές διαδικασίες
Η χρήση του Janumet θα πρέπει να αναστέλλεται προσωρινά για οποιαδήποτε χειρουργική επέμβαση (εκτός από μικρές διαδικασίες που δεν σχετίζονται με περιορισμένη πρόσληψη των τροφίμων και των υγρών) και δεν θα πρέπει να ξεκινάει πάλι μέχρις ότου η στοματική λήψη του ασθενούς επανέλθει και η νεφρική λειτουργία αξιολογήθηκε ως κανονικός.
Αλλαγή της κλινικής κατάστασης των ασθενών με προηγουμένως ελεγχόμενο διαβήτη τύπου 2
Ένας ασθενής με διαβήτη τύπου 2 προηγουμένως καλά ελεγχόμενος με το Janumet που αναπτύσσει εργαστηριακές ανωμαλίες ή κλινικές η ασθένεια (ιδιαίτερα ασαφής και κακώς καθορισμένη ασθένεια) θα πρέπει να αξιολογείται έγκαιρα για ενδείξεις κετοξέωσης ή γαλακτικού οξέος αλκαλική ύφεσις αίματος. Η αξιολόγηση θα πρέπει να περιλαμβάνει ηλεκτρολύτες και κετόνες στον ορό, γλυκόζη αίματος και, εάν ενδείκνυται, επίπεδα ρΗ στο αίμα, γαλακτικό, πυροσταφυλικό και μετφορμίνη. Εάν παρουσιαστεί οξέωση οποιασδήποτε μορφής, το Janumet πρέπει να διακοπεί αμέσως και να ξεκινήσουν άλλα κατάλληλα διορθωτικά μέτρα.
Χρήση με φάρμακα που είναι γνωστό ότι προκαλούν υπογλυκαιμία
Σιταγλιπτίνη
Όπως συμβαίνει με άλλους αντιυπεργλυκαιμικούς παράγοντες που χρησιμοποιούνται σε συνδυασμό με σουλφονυλουρία, όταν η σιταγλιπτίνη χρησιμοποιήθηκε σε συνδυασμό με μετφορμίνη και σουλφονυλουρία, ένα φάρμακο που είναι γνωστό ότι προκαλεί υπογλυκαιμία, η συχνότητα εμφάνισης υπογλυκαιμίας αυξήθηκε σε σχέση με εκείνη του εικονικού φαρμάκου σε συνδυασμό με μετφορμίνη και σουλφονυλουρία [βλέπε Ανεπιθύμητες ενέργειες]. Ως εκ τούτου, οι ασθενείς που λαμβάνουν επίσης ένα έκκριμα της ινσουλίνης (π.χ. σουλφονυλουρία, μεγλιλινίδη) μπορεί να απαιτούν χαμηλότερη δόση του εκκριταγωγού ινσουλίνης για τη μείωση του κινδύνου υπογλυκαιμίας [βλ. Δοσολογία και χορήγηση].
Υδροχλωρική μετφορμίνη
Η υπογλυκαιμία δεν εμφανίζεται σε ασθενείς που λαμβάνουν μετφορμίνη μόνο υπό συνήθεις συνθήκες χρήσης, αλλά μπορεί να παρουσιαστεί όταν η πρόσληψη θερμίδων είναι ανεπαρκής, όταν η έντονη άσκηση δεν αντισταθμίζεται με θερμιδική συμπλήρωση ή κατά τη διάρκεια ταυτόχρονης χρήσης με άλλους παράγοντες μείωσης της γλυκόζης (όπως σουλφονυλουρίες και ινσουλίνη) ή αιθανόλη. Οι ηλικιωμένοι, οι εξασθενημένοι ή οι υποσιτισμένοι ασθενείς και οι ασθενείς με ανεπάρκεια επινεφριδίων ή υπόφυσης ή δηλητηρίαση με οινόπνευμα είναι ιδιαίτερα ευαίσθητοι σε υπογλυκαιμικά αποτελέσματα. Η υπογλυκαιμία μπορεί να είναι δύσκολο να αναγνωριστεί στους ηλικιωμένους και σε άτομα που λαμβάνουν β2-αδρενεργικά φάρμακα αποκλεισμού.
Συγχορηγούμενα φάρμακα που επηρεάζουν τη λειτουργία των νεφρών ή τη διάθεση της μετφορμίνης
Τα συγχορηγούμενα φάρμακα που μπορεί να επηρεάσουν τη νεφρική λειτουργία ή να οδηγήσουν σε σημαντική αιμοδυναμική αλλαγή ή μπορεί παρεμποδίζουν τη διάθεση της μετφορμίνης, όπως τα κατιονικά φάρμακα που εξαλείφονται από τη νεφρική σωληναριακή έκκριση [βλέπω Αλληλεπιδράσεις με άλλα φάρμακα], θα πρέπει να χρησιμοποιείται με προσοχή.
Ραδιολογικές μελέτες με ενδοαγγειακά ιωδιωμένα υλικά αντίθεσης
Ενδοαγγειακές μελέτες αντίθεσης με ιωδιωμένα υλικά (για παράδειγμα, ενδοφλέβια ουρογράμματα, ενδοφλέβια χολαγγειογραφία, αγγειογραφία και αξονική τομογραφία (CT) με ενδοαγγειακά υλικά αντίθεσης) μπορεί να οδηγήσει σε οξεία αλλοίωση της νεφρικής λειτουργίας και έχουν συσχετιστεί με γαλακτική οξέωση σε ασθενείς που λαμβάνουν μετφορμίνη [βλ. Αντενδείξεις]. Συνεπώς, σε ασθενείς στους οποίους σχεδιάζεται οποιαδήποτε τέτοια μελέτη, το Janumet θα πρέπει να διακόπτεται προσωρινά κατά την διαδικασία και παρακρατήθηκε για 48 ώρες μετά τη διαδικασία και επαναφέρθηκε μόνο μετά την εκ νέου αξιολόγηση της νεφρικής λειτουργίας και να είναι φυσιολογική.
Υποξικά κράτη
Καρδιαγγειακή κατάρρευση (σοκ) από οποιαδήποτε αιτία, οξεία συμφορητική καρδιακή ανεπάρκεια, οξύ έμφραγμα του μυοκαρδίου και άλλες καταστάσεις που χαρακτηρίζονται από υποξαιμία έχουν συσχετιστεί με γαλακτική οξέωση και μπορεί επίσης να προκαλέσουν υπεραιμία αζοτεμία. Όταν συμβαίνουν τέτοια συμβάντα σε ασθενείς που λαμβάνουν θεραπεία με Janumet, το φάρμακο πρέπει να διακόπτεται αμέσως.
Απώλεια ελέγχου της γλυκόζης του αίματος
Όταν ένας ασθενής σταθεροποιημένος σε οποιοδήποτε διαβητικό σχήμα εκτίθεται σε στρες όπως πυρετός, τραύμα, λοίμωξη ή χειρουργική επέμβαση, μπορεί να εμφανιστεί προσωρινή απώλεια γλυκαιμικού ελέγχου. Σε αυτές τις περιπτώσεις μπορεί να χρειαστεί να παρακρατήσετε το Janumet και να χορηγήσετε προσωρινά ινσουλίνη. Το Janumet μπορεί να επαναληφθεί μετά την επίλυση του οξειδαινού επεισοδίου.
Αντιδράσεις υπερευαισθησίας
Έχουν υπάρξει μετά την κυκλοφορία του φαρμάκου αναφορές για σοβαρές αντιδράσεις υπερευαισθησίας σε ασθενείς που έλαβαν σιταγλιπτίνη, ένα από τα συστατικά του Janumet. Αυτές οι αντιδράσεις περιλαμβάνουν αναφυλαξία, αγγειοοίδημα και εκφυλιστικές δερματικές παθήσεις συμπεριλαμβανομένου του συνδρόμου Stevens-Johnson. Επειδή αυτές οι αντιδράσεις αναφέρονται εκουσίως από πληθυσμό αβέβαιου μεγέθους, είναι γενικά δεν είναι δυνατή η αξιόπιστη εκτίμηση της συχνότητάς τους ή η καθιέρωση αιτιώδους συνάφειας με την έκθεση σε φάρμακα. Η έναρξη αυτών των αντιδράσεων συνέβη εντός των πρώτων 3 μηνών μετά την έναρξη της θεραπείας με σιταγλιπτίνη, με μερικές αναφορές να εμφανίστηκαν μετά την πρώτη δόση. Εάν υπάρχει υπόνοια αντίδρασης υπερευαισθησίας, διακόψτε το Janumet, αξιολογήστε για άλλες πιθανές αιτίες του συμβάντος και προχωρήστε σε εναλλακτική θεραπεία για τον διαβήτη. [Βλέπω Ανεπιθύμητες ενέργειες.]
Μακροαγγειακά αποτελέσματα
Δεν έχουν υπάρξει κλινικές μελέτες που να αποδεικνύουν την ύπαρξη τεκμηριωμένων ενδείξεων για μείωση του μακροαγγειακού κινδύνου με το Janumet ή οποιοδήποτε άλλο αντιδιαβητικό φάρμακο.
μπλουζα
Ανεπιθύμητες ενέργειες
Εμπειρία κλινικών δοκιμών
Επειδή οι κλινικές δοκιμές διεξάγονται υπό πολύ διαφορετικές συνθήκες, οι ανεπιθύμητες ενέργειες που παρατηρήθηκαν στις κλινικές δοκιμές του a το φάρμακο δεν μπορεί να συγκριθεί άμεσα με τα ποσοστά στις κλινικές δοκιμές ενός άλλου φαρμάκου και ενδέχεται να μην αντικατοπτρίζει τους ρυθμούς που παρατηρήθηκαν στο φάρμακο πρακτική.
Συγκέντρωση σιταγλιπτίνης και μετφορμίνης σε ασθενείς με διαβήτη τύπου 2 ανεπαρκώς ελεγχόμενοι στη δίαιτα και την άσκηση
Ο Πίνακας 1 συνοψίζει τις πιο συχνές (± 5% των ασθενών) ανεπιθύμητες ενέργειες που αναφέρθηκαν (ανεξάρτητα από την αξιολόγηση της αιτιότητας από τον ερευνητή) σε μια 24-εβδομάδα ελεγχόμενη με εικονικό φάρμακο παραγοντική μελέτη στην οποία η σιταγλιπτίνη και η μετφορμίνη συγχορηγήθηκαν σε ασθενείς με διαβήτη τύπου 2 ανεπαρκώς ελεγχόμενοι με δίαιτα και την άσκηση.
Πίνακας 1: Σιταγλιπτίνη και μετφορμίνη συγχορηγούμενη σε ασθενείς με διαβήτη τύπου 2 ανεπαρκώς ελεγχόμενοι στη διατροφή και την άσκηση: Ανεπιθύμητες αντιδράσεις Αναφέρεται (ανεξάρτητα από την εκτίμηση του ερευνητή για την αιτιότητα) σε ≥ 5% των ασθενών που λαμβάνουν συνδυασμένη θεραπεία (και μεγαλύτερη από ό, τι στους ασθενείς που λαμβάνουν Εικονικό φάρμακο) *
| Αριθμός ασθενών (%) | ||||
Εικονικό φάρμακο |
Σιταγλιπτίνη 100 mg QD |
Μετφορμίνη 500 mg / Μετφορμίνη 1000 mg δύο φορές την ημέρα†|
Σιταγλιπτίνη 50 mg bid + Μετφορμίνη 500 mg / Μετφορμίνη 1000 mg δύο φορές την ημέρα†|
|
| Ν = 176 | Ν = 179 | Ν = 364†| Ν = 372†| |
| ||||
| Διάρροια | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) |
| Οίδημα της άνω αναπνευστικής οδού | 9 (5.1) | 8 (4.5) | 19 (5.2) | 23 (6.2) |
| Πονοκέφαλο | 5 (2.8) | 2 (1.1) | 14 (3.8) | 22 (5.9) |
Σιταγλιπτίνη συμπληρωματική θεραπεία σε ασθενείς με διαβήτη τύπου 2 ανεπαρκώς ελεγχόμενοι με μετφορμίνη μόνο
Σε μια ελεγχόμενη με εικονικό φάρμακο μελέτη ελεγχόμενη με εικονικό φάρμακο (placebo) 100 mg σιταγλιπτίνης που χορηγήθηκε μία φορά ημερησίως σε μια δοσολογία μετφορμίνης δύο φορές ημερησίως, δεν ανεπιθύμητες ενέργειες που αναφέρθηκαν ανεξάρτητα από την εκτίμηση από την πλευρά του ερευνητή της αιτιώδους συνάφειας σε ≥ 5% των ασθενών και συχνότερα από ό, τι στους χορηγούμενους ασθενείς εικονικό φάρμακο. Η διακοπή της θεραπείας λόγω κλινικών ανεπιθύμητων ενεργειών ήταν παρόμοια με την ομάδα θεραπείας με placebo (σιταγλιπτίνη και μετφορμίνη, 1,9%; εικονικό φάρμακο και μετφορμίνη, 2,5%).
Υπογλυκαιμία
Οι ανεπιθύμητες αντιδράσεις της υπογλυκαιμίας βασίστηκαν σε όλες τις αναφορές υπογλυκαιμίας. δεν ήταν απαραίτητη η ταυτόχρονη μέτρηση της γλυκόζης. Η συνολική συχνότητα εμφάνισης προκαθορισμένων ανεπιθύμητων ενεργειών της υπογλυκαιμίας σε ασθενείς με διαβήτη τύπου 2 ανεπαρκώς ελεγχόμενες με δίαιτα και άσκηση ήταν 0,6% στους ασθενείς που έλαβαν εικονικό φάρμακο, 0,6% σε ασθενείς που έλαβαν μόνο σιταγλιπτίνη, 0,8% σε ασθενείς που έλαβαν μόνο μετφορμίνη και 1,6% σε ασθενείς που έλαβαν σιταγλιπτίνη σε συνδυασμό με μετφορμίνη. Σε ασθενείς με διαβήτη τύπου 2 ανεπαρκώς ελεγχόμενοι μόνο με μετφορμίνη, η συνολική επίπτωση των ανεπιθύμητων ενεργειών οι αντιδράσεις της υπογλυκαιμίας ήταν 1,3% σε ασθενείς στους οποίους χορηγήθηκε πρόσθετη σιταγλιπτίνη και 2,1% στους ασθενείς στους οποίους χορηγήθηκε πρόσθετο εικονικό φάρμακο.
Γαστρεντερικές Ανεπιθύμητες Αντιδράσεις
Οι συχνότητες των προεπιλεγμένων ανεπιθύμητων ενεργειών του γαστρεντερικού σωλήνα σε ασθενείς που έλαβαν σιταγλιπτίνη και μετφορμίνη ήταν παρόμοιες με εκείνες που αναφέρθηκαν για ασθενείς που έλαβαν μόνο μετφορμίνη. Βλ. Πίνακα 2.
Πίνακας 2: Προεπιλεγμένες ανεπιθύμητες αντιδράσεις του γαστρεντερικού σωλήνα (ανεξάρτητα από την εκτίμηση του ερευνητή για την αιτιότητα) που αναφέρεται σε ασθενείς με διαβήτη τύπου 2 που λαμβάνουν σιταγλιπτίνη και μετφορμίνη.
| Αριθμός ασθενών (%) | ||||||
| Μελέτη της σιταγλιπτίνης και της μετφορμίνης σε ασθενείς ανεπαρκώς ελεγχόμενους για τη Διατροφή και την Άσκηση |
Μελέτη της προσθήκης σιταγλιπτίνης σε ασθενείς ανεπαρκώς ελεγχόμενους με μετφορμίνη μόνο | |||||
Εικονικό φάρμακο |
Σιταγλιπτίνη 100 mg QD |
Μετφορμίνη 500 mg / Μετφορμίνη 1000 mg δύο φορές την ημέρα* |
Σιταγλιπτίνη 50 mg bid + Μετφορμίνη 500 mg / Μετφορμίνη 1000 mg δύο φορές την ημέρα* |
Το εικονικό φάρμακο και η μετφορμίνη â ‰ ¥ 1500 mg ημερησίως |
Σιταγλιπτίνη 100 mg QD και μετφορμίνη â ‰ ¥ 1500 mg ημερησίως |
|
| Ν = 176 | Ν = 179 | Ν = 364 | Ν = 372 | Ν = 237 | Ν = 464 | |
| ||||||
| Διάρροια | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) | 6 (2.5) | 11 (2.4) |
| Ναυτία | 2 (1.1) | 2 (1.1) | 20 (5.5) | 18 (4.8) | 2 (0.8) | 6 (1.3) |
| Έμετος | 1 (0.6) | 0 (0.0) | 2 (0.5) | 8 (2.2) | 2 (0.8) | 5 (1.1) |
| Κοιλιακός πόνος†| 4 (2.3) | 6 (3.4) | 14 (3.8) | 11 (3.0) | 9 (3.8) | 10 (2.2) |
Σιταγλιπτίνη σε συνδυασμό με μετφορμίνη και γλιμεπιρίδη
Σε ελεγχόμενη με εικονικό φάρμακο μελέτη διάρκειας 24 εβδομάδων με σιταγλιπτίνη 100 mg ως πρόσθετη θεραπεία σε ασθενείς με διαβήτη τύπου 2 ανεπαρκώς ελεγχόμενες με μετφορμίνη και γλιμεπιρίδη (σιταγλιπτίνη, Ν = 116, εικονικό φάρμακο, N = 113), οι ανεπιθύμητες ενέργειες που αναφέρθηκαν ανεξάρτητα από την εκτίμηση από την πλευρά του ερευνητή της αιτιότητας στο ≥ 5% των ασθενών με σιταγλιπτίνη και πιο συχνά από ότι σε ασθενείς που έλαβαν εικονικό φάρμακο ήταν: υπογλυκαιμία (σιταγλιπτίνη, 16,4%; εικονικό φάρμακο, 0,9%) και κεφαλαλγία (6,9%, 2,7%).
Δεν παρατηρήθηκαν κλινικά σημαντικές αλλαγές στα ζωτικά σημεία ή στο ΗΚΓ (συμπεριλαμβανομένου του διαστήματος QTc) με το συνδυασμό σιταγλιπτίνης και μετφορμίνης.
Η πιο συχνή ανεπιθύμητη εμπειρία στη μονοθεραπεία με σιταγλιπτίνη ανέφερε ανεξάρτητα από τον ερευνητή η αξιολόγηση της αιτιότητας σε ≥ 5% των ασθενών και συχνότερα από ό, τι στους ασθενείς στους οποίους χορηγήθηκε εικονικό φάρμακο ήταν ρινοφαρυγγίτιδα.
Οι πιο συχνές (> 5%) ανεπιθύμητες αντιδράσεις που οφείλονται στην έναρξη της θεραπείας με μετφορμίνη είναι διάρροια, ναυτία / έμετος, μετεωρισμός, κοιλιακή δυσφορία, δυσπεψία, εξασθένιση και κεφαλαλγία.
Εργαστηριακές δοκιμές
Σιταγλιπτίνη
Η επίπτωση των εργαστηριακών ανεπιθύμητων ενεργειών ήταν παρόμοια σε ασθενείς που έλαβαν σιταγλιπτίνη και μετφορμίνη (7,6%) σε σύγκριση με ασθενείς που έλαβαν εικονικό φάρμακο και μετφορμίνη (8,7%). Στις περισσότερες, αλλά όχι σε όλες τις μελέτες, μικρή αύξηση του αριθμού των λευκών αιμοσφαιρίων (περίπου 200 κύτταρα / μικρογραμ. Διαφορά σε WBC έναντι εικονικού φαρμάκου. μέση τιμή WBC κατά προσέγγιση 6600 κύτταρα / μικρογραμ.) παρατηρήθηκε λόγω μικρής αύξησης των ουδετεροφίλων. Αυτή η αλλαγή στις εργαστηριακές παραμέτρους δεν θεωρείται κλινικά σημαντική.
Υδροχλωρική μετφορμίνη
Σε ελεγχόμενες κλινικές δοκιμές με μετφορμίνη διάρκειας 29 εβδομάδων, μείωση σε υποθετικά επίπεδα προηγουμένως φυσιολογικού ορού Βιταμίνης Β12 επίπεδα, χωρίς κλινικές εκδηλώσεις, παρατηρήθηκε σε περίπου 7% των ασθενών. Μια τέτοια μείωση, πιθανώς λόγω παρεμβολής με το Β12 απορρόφηση από το Β12-συγκεντρωτικού παράγοντα, πολύ σπάνια συσχετίζεται με αναιμία και φαίνεται να είναι ταχέως αναστρέψιμη με διακοπή της μετφορμίνης ή της βιταμίνης Β12 συμπλήρωση. [Βλέπω Προειδοποιήσεις και προφυλάξεις.]
Εμπειρία μετά την κυκλοφορία
Οι ακόλουθες επιπρόσθετες ανεπιθύμητες ενέργειες έχουν εντοπιστεί κατά τη χρήση μετά από έγκριση του Janumet ή σιταγλιπτίνης, ενός από τα συστατικά του Janumet. Επειδή αυτές οι αντιδράσεις αναφέρονται εκουσίως από πληθυσμό αβέβαιου μεγέθους, είναι γενικά δεν είναι δυνατή η αξιόπιστη εκτίμηση της συχνότητάς τους ή η καθιέρωση αιτιώδους συνάφειας με την έκθεση σε φάρμακα.
Οι αντιδράσεις υπερευαισθησίας περιλαμβάνουν αναφυλαξία, αγγειοοίδημα, εξάνθημα, κνίδωση, δερματική αγγειίτιδα και εκφυλιστικές παθήσεις του δέρματος συμπεριλαμβανομένου του συνδρόμου Stevens-Johnson [βλέπε Προειδοποιήσεις και προφυλάξεις]; λοίμωξη του ανώτερου αναπνευστικού συστήματος. αύξηση των ηπατικών ενζύμων. παγκρεατίτιδα.
μπλουζα
Αλληλεπιδράσεις με άλλα φάρμακα
Κατιονικά φάρμακα
Τα κατιονικά φάρμακα (π.χ., αμιλορίδη, διγοξίνη, μορφίνη, προκαϊναμίδη, κινιδίνη, κινίνη, ρανιτιδίνη, τριαμτερένη, τριμεθοπρίμη ή βανκομυκίνη) που είναι που εξαλείφονται από τη νεφρική σωληναριακή έκκριση έχουν θεωρητικά τη δυνατότητα αλληλεπίδρασης με μετφορμίνη ανταγωνιζόμενη την κοινή νεφρική σωληναριακή μεταφορά συστήματα. Αυτή η αλληλεπίδραση μεταξύ μετφορμίνης και από του στόματος σιμετιδίνης έχει παρατηρηθεί σε φυσιολογικούς υγιείς εθελοντές τόσο σε μονομερή όσο και σε πολλαπλές δόσεις μετφορμίνης-σιμετιδίνης με μελέτες αλληλεπίδρασης με φάρμακα, με αύξηση κατά 60% των συγκεντρώσεων στο πλάσμα της μετφορμίνης στο πλάσμα και του πλήρους αίματος και με 40% αύξηση της μετφορμίνης στο πλάσμα και στο πλήρες αίμα AUC. Δεν παρατηρήθηκε καμία αλλαγή στον χρόνο ημίσειας ζωής αποβολής στη μελέτη μιας δόσης. Η μετφορμίνη δεν είχε καμία επίδραση στη φαρμακοκινητική της σιμετιδίνης. Αν και αυτές οι αλληλεπιδράσεις παραμένουν θεωρητικές (εκτός από τη σιμετιδίνη), η προσεκτική παρακολούθηση και ρύθμιση της δόσης του Janumet και / ή το συνιστώμενο φάρμακο συνιστάται σε ασθενείς που λαμβάνουν κατιονικά φάρμακα που απεκκρίνονται μέσω του κεντρικού νεφρικού σωληναριακού εκκρίματος Σύστημα.
Διγοξίνη
Υπήρξε ελαφρά αύξηση στην περιοχή κάτω από την καμπύλη (AUC, 11%) και μέση μέγιστη συγκέντρωση φαρμάκου (CΜέγιστη, 18%) διγοξίνης με τη συγχορήγηση 100 mg σιταγλιπτίνης για 10 ημέρες. Αυτές οι αυξήσεις δεν θεωρούνται πιθανό να είναι κλινικά σημαντικές. Η διγοξίνη, ως κατιονικό φάρμακο, έχει τη δυνατότητα να ανταγωνιστεί τη μετφορμίνη για τα κοινά νεφρικά σωληνοειδή συστήματα μεταφοράς, επηρεάζοντας έτσι τις συγκεντρώσεις ορού είτε της διγοξίνης, της μετφορμίνης είτε και των δύο. Οι ασθενείς που λαμβάνουν διγοξίνη πρέπει να παρακολουθούνται κατάλληλα. Δεν συνιστάται προσαρμογή της δοσολογίας της διγοξίνης ή του Janumet.
Γλυβουρίδη
Σε μια μελέτη αλληλεπίδρασης μίας δόσης σε ασθενείς με διαβήτη τύπου 2, η συγχορήγηση μετφορμίνης και γλυβουρίδης δεν οδήγησε σε αλλαγές στη φαρμακοκινητική ή τη φαρμακοδυναμική της μετφορμίνης. Μειώσεις της AUC και C της γλυβουρίδηςΜέγιστη παρατηρήθηκαν, αλλά ήταν πολύ μεταβλητές. Η φύση μιας δόσης αυτής της μελέτης και η έλλειψη συσχέτισης μεταξύ των επιπέδων γλυβουρίδης στο αίμα και των φαρμακοδυναμικών επιδράσεων καθιστούν αβέβαιη την κλινική σημασία αυτής της αλληλεπίδρασης.
Φουροσεμίδη
Μία μελέτη αλληλεπίδρασης με φάρμακο μίας δόσης, με μετφορμίνη και φουροσεμίδη σε υγιή άτομα, έδειξε ότι οι φαρμακοκινητικές παράμετροι και των δύο ενώσεων επηρεάστηκαν από τη συγχορήγηση. Η φουροσεμίδη αύξησε το πλάσμα και το αίμα της μετφορμίνης CΜέγιστη κατά 22% και AUC αίματος κατά 15%, χωρίς σημαντική μεταβολή στη νεφρική κάθαρση της μετφορμίνης. Όταν χορηγείται με μετφορμίνη, το CΜέγιστη και η AUC της φουροσεμίδης ήταν 31% και 12% μικρότερες, αντίστοιχα, από ό, τι όταν χορηγήθηκαν μόνοι, και το ο τελικός χρόνος ημιζωής μειώθηκε κατά 32%, χωρίς σημαντική μεταβολή στη νεφρική φουροσεμίδη εκτελωνισμός. Δεν υπάρχουν διαθέσιμες πληροφορίες σχετικά με την αλληλεπίδραση της μετφορμίνης και της φουροσεμίδης όταν συγχορηγούνται χρονικά.
Νιφεδιπίνη
Μία μελέτη μελετών αλληλεπίδρασης μετφορμίνης-νιφεδιπίνης μίας δόσης σε φυσιολογικούς υγιείς εθελοντές κατέδειξε ότι η συγχορήγηση της νιφεδιπίνης αύξησε τη μετφορμίνη C του πλάσματοςΜέγιστη και AUC κατά 20% και 9%, αντίστοιχα, και αύξησαν την ποσότητα που απεκκρίνεται στα ούρα. ΤΜέγιστη και ο χρόνος ημίσειας ζωής δεν επηρεάστηκαν. Η νιφεδιπίνη φαίνεται να ενισχύει την απορρόφηση της μετφορμίνης. Η μετφορμίνη είχε ελάχιστες επιδράσεις στη νιφεδιπίνη.
Η χρήση της μετφορμίνης με άλλα φάρμακα
Ορισμένα φάρμακα τείνουν να παράγουν υπεργλυκαιμία και μπορεί να οδηγήσουν σε απώλεια γλυκαιμικού ελέγχου. Αυτά τα φάρμακα περιλαμβάνουν τις θειαζίδες και άλλα διουρητικά, κορτικοστεροειδή, φαινοθειαζίνες, προϊόντα θυρεοειδούς, οιστρογόνα, από του στόματος αντισυλληπτικά, φαινυτοΐνη, νικοτινικό οξύ, συμπαθομιμητικά, φάρμακα αποκλεισμού διαύλων ασβεστίου και ισονιαζίδη. Όταν χορηγούνται τέτοια φάρμακα σε έναν ασθενή που λαμβάνει το Janumet, ο ασθενής θα πρέπει να παρακολουθείται στενά για τη διατήρηση επαρκούς γλυκαιμικού ελέγχου.
Σε υγιείς εθελοντές, οι φαρμακοκινητικές ιδιότητες της μετφορμίνης και της προπρανολόλης και της μετφορμίνης και της ιβουπροφαίνης δεν επηρεάστηκαν όταν συγχορηγήθηκαν σε μελέτες αλληλεπιδράσεων μίας δόσης.
Η μετφορμίνη δεσμεύεται αμελητέα στις πρωτεΐνες του πλάσματος και είναι επομένως λιγότερο πιθανό να αλληλεπιδράσει με φάρμακα που συνδέονται σε μεγάλο βαθμό με πρωτεΐνες όπως το σαλικυλικά, σουλφοναμίδια, χλωραμφενικόλη και προβενεσίδη, σε σύγκριση με τις σουλφονυλουρίες, οι οποίες συνδέονται εκτεταμένα με τον ορό πρωτεΐνες.
μπλουζα
Χρήση σε συγκεκριμένους πληθυσμούς
Εγκυμοσύνη
Εγκυμοσύνη Κατηγορία Β:
Janumet
Δεν υπάρχουν επαρκείς και καλά ελεγχόμενες μελέτες σε έγκυες γυναίκες με το Janumet ή μεμονωμένα συστατικά του. επομένως, η ασφάλεια του Janumet σε έγκυες γυναίκες δεν είναι γνωστή. Το Janumet πρέπει να χρησιμοποιείται κατά τη διάρκεια της εγκυμοσύνης μόνο εάν είναι σαφώς απαραίτητο.
Η Merck & Co., Inc. διατηρεί ένα μητρώο για την παρακολούθηση των αποτελεσμάτων της εγκυμοσύνης των γυναικών που εκτίθενται στο Janumet ενώ είναι έγκυος. Οι πάροχοι υγειονομικής περίθαλψης ενθαρρύνονται να αναφέρουν οποιαδήποτε προγεννητική έκθεση στη Janumet καλώντας το Μητρώο Εγκυμοσύνης στο (800) 986-8999.
Δεν έχουν πραγματοποιηθεί μελέτες σε ζώα με τα συνδυασμένα προϊόντα στο Janumet για την αξιολόγηση των επιδράσεων στην αναπαραγωγή. Τα ακόλουθα δεδομένα βασίζονται σε ευρήματα σε μελέτες που πραγματοποιήθηκαν ξεχωριστά με σιταγλιπτίνη ή μετφορμίνη.
Σιταγλιπτίνη
Έχουν διεξαχθεί μελέτες αναπαραγωγής σε αρουραίους και κουνέλια. Οι δόσεις σιταγλιπτίνης έως 125 mg / kg (περίπου 12 φορές μεγαλύτερη από την έκθεση του ανθρώπου στη μέγιστη συνιστώμενη δόση σε ανθρώπους) δεν βλάπτουν τη γονιμότητα ή βλάπτουν το έμβρυο. Ωστόσο, δεν υπάρχουν επαρκείς και καλά ελεγχόμενες μελέτες με σιταγλιπτίνη σε έγκυες γυναίκες.
Η χορήγηση σιταγλιπτίνης σε εγκύους θηλυκούς αρουραίους και κουνέλια από την ημέρα της κύησης 6 έως 20 (οργανογένεση) δεν ήταν τερατογόνος σε από του στόματος δόσεις μέχρι 250 mg / kg (αρουραίοι) και 125 mg / kg (κουνέλια), ή περίπου 30 και 20 φορές την έκθεση του ανθρώπου στη μέγιστη συνιστώμενη δόση σε ανθρώπους (MRHD) των 100 mg / ημέρα με βάση την AUC συγκρίσεις. Μεγαλύτερες δόσεις αύξησαν την επίπτωση των δυσμορφιών των πλευρών σε απογόνους στα 1000 mg / kg ή περίπου 100 φορές την έκθεση του ανθρώπου στο MRHD.
Η σιταγλιπτίνη που χορηγήθηκε σε θηλυκούς αρουραίους από την ημέρα της κύησης 6 έως την ημέρα γαλουχίας 21, μείωσε το σωματικό βάρος σε αρσενικούς και θηλυκούς απογόνους στα 1000 mg / kg. Δεν παρατηρήθηκε λειτουργική ή συμπεριφορική τοξικότητα στους απογόνους των αρουραίων.
Η μεταφορά πλακουντών σιταγλιπτίνης που χορηγήθηκε σε εγκύους αρουραίους ήταν περίπου 45% στις 2 ώρες και 80% στις 24 ώρες μετά τη χορήγηση. Η μεταφορά με πλακούντα σιταγλιπτίνης που χορηγήθηκε σε έγκυα κουνέλια ήταν περίπου 66% σε 2 ώρες και 30% σε 24 ώρες.
Υδροχλωρική μετφορμίνη
Η μετφορμίνη δεν ήταν τερατογόνος σε αρουραίους και κουνέλια σε δόσεις μέχρι 600 mg / kg / ημέρα. Αυτό αντιπροσωπεύει έκθεση περίπου 2 και 6 φορές τη μέγιστη συνιστώμενη ανθρώπινη ημερήσια δόση 2.000 mg με βάση τις συγκρίσεις επιφάνειας σώματος για αρουραίους και κουνέλια, αντίστοιχα. Ο προσδιορισμός των συγκεντρώσεων του εμβρύου έδειξε ένα μερικό φραγμό του πλακούντα στη μετφορμίνη.
Θηλάζουσες μητέρες
Δεν έχουν διεξαχθεί μελέτες σε γαλακτοπαραγωγά ζώα με τα συνδυασμένα συστατικά του Janumet. Σε μελέτες που διεξήχθησαν με τα μεμονωμένα συστατικά, τόσο η σιταγλιπτίνη όσο και η μετφορμίνη εκκρίνονται στο γάλα θηλαζόντων αρουραίων. Δεν είναι γνωστό αν η σιταγλιπτίνη απεκκρίνεται στο ανθρώπινο γάλα. Επειδή πολλά φάρμακα απεκκρίνονται στο ανθρώπινο γάλα, πρέπει να δίδεται προσοχή όταν το Janumet χορηγείται σε θηλάζουσα γυναίκα.
Παιδιατρική χρήση
Η ασφάλεια και η αποτελεσματικότητα του Janumet σε παιδιατρικούς ασθενείς κάτω των 18 ετών δεν έχουν τεκμηριωθεί.
Γηριατρική χρήση
Janumet
Επειδή η σιταγλιπτίνη και η μετφορμίνη απεκκρίνονται ουσιαστικά από τα νεφρά και επειδή η γήρανση μπορεί να συσχετιστεί με μειωμένη νεφρική λειτουργία, το Janumet πρέπει να χρησιμοποιείται με προσοχή καθώς η ηλικία αυξάνεται. Πρέπει να λαμβάνεται μέριμνα για την επιλογή της δόσης και πρέπει να βασίζεται σε προσεκτική και τακτική παρακολούθηση της νεφρικής λειτουργίας. [Βλέπω Προειδοποιήσεις και προφυλάξεις; Κλινική Φαρμακολογία.]
Σιταγλιπτίνη
Από τον συνολικό αριθμό των ατόμων (N = 3884) στις κλινικές μελέτες φάσης ΙΙ και ΙΙΙ της σιταγλιπτίνης, 725 ασθενείς ήταν 65 ετών και άνω, ενώ οι 61 ασθενείς ήταν 75 ετών και άνω. Δεν παρατηρήθηκαν γενικές διαφορές στην ασφάλεια ή την αποτελεσματικότητα μεταξύ των ατόμων ηλικίας 65 ετών και άνω και των νεότερων ατόμων. Ενώ αυτή και άλλη αναφερθείσα κλινική εμπειρία δεν έχουν εντοπίσει διαφορές στις απαντήσεις μεταξύ των ηλικιωμένων και των νεότερων ασθενών, η μεγαλύτερη ευαισθησία ορισμένων ηλικιωμένων ατόμων δεν μπορεί να είναι αποκλειστεί.
Υδροχλωρική μετφορμίνη
Οι ελεγχόμενες κλινικές μελέτες της μετφορμίνης δεν περιλάμβαναν επαρκή αριθμό ηλικιωμένων ασθενών για να προσδιορίσουν αν ανταποκρίνονται διαφορετικά από νεότερους ασθενείς, παρόλο που άλλη αναφερθείσα κλινική εμπειρία δεν έχει εντοπίσει διαφορές στις αντιδράσεις μεταξύ των ηλικιωμένων και των νέων ασθενείς. Η μετφορμίνη πρέπει να χρησιμοποιείται μόνο σε ασθενείς με φυσιολογική νεφρική λειτουργία. Η αρχική και συντηρητική δοσολόγηση της μετφορμίνης πρέπει να είναι συντηρητική σε ασθενείς με προχωρημένη ηλικία, λόγω της πιθανότητας μειωμένης νεφρικής λειτουργίας σε αυτόν τον πληθυσμό. Κάθε προσαρμογή της δόσης πρέπει να βασίζεται σε προσεκτική αξιολόγηση της νεφρικής λειτουργίας. [Βλέπω Αντενδείξεις; Προειδοποιήσεις και προφυλάξεις; και Κλινική Φαρμακολογία.]
μπλουζα
Υπερβολική δόση
Σιταγλιπτίνη
Κατά τη διάρκεια ελεγχόμενων κλινικών δοκιμών σε υγιή άτομα, χορηγήθηκαν εφάπαξ δόσεις έως και 800 mg σιταγλιπτίνης. Οι μέγιστες μέσες αυξήσεις στο QTc των 8,0 msec παρατηρήθηκαν σε μία μελέτη σε δόση 800 mg σιταγλιπτίνης, μέση επίδραση που δεν θεωρείται κλινικά σημαντική [βλ. Κλινική Φαρμακολογία]. Δεν υπάρχει εμπειρία με δόσεις άνω των 800 mg στους ανθρώπους. Στις μελέτες πολλαπλών δόσεων Φάσης Ι, δεν παρατηρήθηκαν κλινικές ανεπιθύμητες αντιδράσεις σχετιζόμενες με τη δόση με σιταγλιπτίνη με δόσεις μέχρι 400 mg ημερησίως για περιόδους έως 28 ημερών.
Σε περίπτωση υπερδοσολογίας, είναι λογικό να χρησιμοποιηθούν τα συνήθη μέτρα υποστήριξης, π.χ., να αφαιρεθεί το μη απορροφημένο υλικό από το γαστρεντερικό (συμπεριλαμβανομένης της λήψης ηλεκτροκαρδιογραφήματος) και να συστήσουν υποστηρικτική θεραπεία όπως υποδεικνύεται από την κλινική εικόνα του ασθενούς κατάσταση.
Η σιταγλιπτίνη είναι ελάχιστα διαλυτή. Σε κλινικές μελέτες, περίπου το 13,5% της δόσης απομακρύνθηκε σε μια περίοδο αιμοκάθαρσης 3- έως 4 ωρών. Παρατεταμένη αιμοκάθαρση μπορεί να εξεταστεί εάν είναι κλινικά κατάλληλη. Δεν είναι γνωστό εάν η σιταγλιπτίνη μπορεί να υποβληθεί σε διαπίδυση με περιτοναϊκή κάθαρση.
Υδροχλωρική μετφορμίνη
Υπήρξε υπερδοσολογία με υδροχλωρική μετφορμίνη, συμπεριλαμβανομένης της κατάποσης ποσών μεγαλύτερων από 50 γραμμάρια. Η υπογλυκαιμία αναφέρθηκε σε περίπου 10% των περιπτώσεων, αλλά δεν έχει διαπιστωθεί αιτιώδης συνάφεια με την υδροχλωρική μετφορμίνη. Η γαλακτική οξέωση έχει αναφερθεί σε περίπου 32% των περιπτώσεων υπερδοσολογίας με μετφορμίνη [βλ Προειδοποιήσεις και προφυλάξεις]. Η μετφορμίνη μπορεί να υποβληθεί σε διαπίδυση με κάθαρση μέχρι 170 mL / min υπό καλές αιμοδυναμικές συνθήκες. Συνεπώς, η αιμοκάθαρση μπορεί να είναι χρήσιμη για την απομάκρυνση συσσωρευμένου φαρμάκου από ασθενείς στους οποίους υπάρχει υπόνοια υπερδοσολογίας με μετφορμίνη.
μπλουζα
Περιγραφή
Τα δισκία Janumet (σιταγλιπτίνη / μετφορμίνη HCl) περιέχουν δύο από του στόματος αντιυπεργλυκαιμικά φάρμακα που χρησιμοποιούνται στη θεραπεία του διαβήτη τύπου 2: σιταγλιπτίνη και υδροχλωρική μετφορμίνη.
Σιταγλιπτίνη
Η σιταγλιπτίνη είναι ένας από του στόματος δραστικός αναστολέας του ενζύμου διπεπτιδυλ πεπτιδάσης-4 (DPP-4). Η σιταγλιπτίνη είναι παρούσα σε δισκία Janumet με τη μορφή μονοϋδρικής φωσφορικής σιταγλιπτίνης. Η μονοϋδρική φωσφορική σιταγλιπτίνη περιγράφεται χημικά ως 7 - [(3R) -3-αμινο-1-οξο-4- (2,4,5-τριφθοροφαινυλο) βουτυλο] 5,6,7,8-τετραϋδρο-3- (τριφθορομεθυλ) -1,2,4-τριαζολο [4,3-α] πυραζίνης (1: 1) με εμπειρικό τύπο του C16H15φά6Ν5Ο-Η3ΤΑΧΥΔΡΟΜΕΙΟ4-Η2Ο και μοριακό βάρος 523,32. Ο δομικός τύπος είναι:
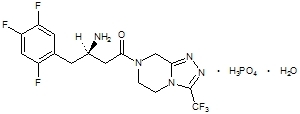
Η μονοϋδρική φωσφορική σιταγλιπτίνη είναι μία λευκή έως υπόλευκη, κρυσταλλική, μη υγροσκοπική σκόνη. Είναι διαλυτό σε νερό και Ν, Ν-διμεθυλοφορμαμίδιο. ελαφρά διαλυτή σε μεθανόλη. πολύ ελαφρώς διαλυτό σε αιθανόλη, ακετόνη και ακετονιτρίλιο. και αδιάλυτο σε ισοπροπανόλη και οξικό ισοπροπυλεστέρα.
Υδροχλωρική μετφορμίνη
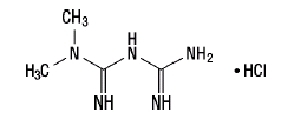
Η υδροχλωρική μετφορμίνη (υδροχλωρική Ν, Ν-διμεθυλιμιδιδοκαρβονιμιδική διαμίδη) δεν σχετίζεται χημικά ή φαρμακολογικά με άλλες κατηγορίες αντιϋπεργλυκαιμικών παραγόντων από του στόματος. Η υδροχλωρική μετφορμίνη είναι μια λευκή έως υπόλευκη κρυσταλλική ένωση με μοριακό τύπο C4H11Ν5-ΗΟΙ και μοριακό βάρος 165,63. Η υδροχλωρική μετφορμίνη είναι ελεύθερα διαλυτή στο νερό και είναι πρακτικά αδιάλυτη σε ακετόνη, αιθέρα και χλωροφόρμιο. Το pKένα της μετφορμίνης είναι 12,4. Το ρΗ ενός υδατικού διαλύματος 1% υδροχλωρικής μετφορμίνης είναι 6,68. Ο δομικός τύπος είναι όπως φαίνεται:
Janumet
Το Janumet είναι διαθέσιμο για χορήγηση από το στόμα, ως δισκία που περιέχουν 64,25 mg μονοϋδρική φωσφορική σιταγλιπτίνη και ισοδύναμο υδροχλωρικής μετφορμίνης σε: 50 mg σιταγλιπτίνη ως ελεύθερη βάση και 500 mg υδροχλωρικής μετφορμίνης (Janumet 50 mg / 500 mg) ή 1000 mg υδροχλωρικής μετφορμίνης (Janumet 50 mg / 1000 mg). Κάθε επικαλυμμένο με λεπτό υμένιο δισκίο του Janumet περιέχει τα ακόλουθα μη δραστικά συστατικά: μικροκρυσταλλική κυτταρίνη, πολυβινυλοπυρρολιδόνη, λαουρυλοθειικό νάτριο και στεαρυλοφουμαρικό νάτριο. Επιπλέον, η επίστρωση μεμβράνης περιέχει τα ακόλουθα αδρανή συστατικά: πολυβινυλική αλκοόλη, πολυαιθυλενογλυκόλη, τάλκη, διοξείδιο του τιτανίου, κόκκινο οξείδιο του σιδήρου και οξείδιο του μαύρου σιδήρου.
μπλουζα
Κλινική Φαρμακολογία
Μηχανισμός δράσης
Janumet
Το Janumet συνδυάζει δύο αντιυπεργλυκαιμικούς παράγοντες με συμπληρωματικούς μηχανισμούς δράσης για τη βελτίωση του γλυκαιμικού ελέγχου σε ασθενείς με διαβήτης τύπου 2: σιταγλιπτίνη, αναστολέας διπεπτιδυλ πεπτιδάσης-4 (DPP-4) και υδροχλωρική μετφορμίνη, μέλος της διγουανίδης τάξη.
Σιταγλιπτίνη
Η σιταγλιπτίνη είναι ένας αναστολέας DPP-4, ο οποίος πιστεύεται ότι ασκεί τις δράσεις του σε ασθενείς με διαβήτη τύπου 2 επιβραδύνοντας την αδρανοποίηση των ορμονών ινκρετίνης. Οι συγκεντρώσεις των ενεργών άθικτων ορμονών αυξάνονται με σιταγλιπτίνη, αυξάνοντας έτσι και παρατείνουν τη δράση αυτών των ορμονών. Οι ορμόνες ινκρετίνης, συμπεριλαμβανομένου του πεπτιδίου-1 τύπου GLG-1 (GLP-1) και του ινσουλινοτροπικού εξαρτώμενου από τη γλυκόζη πολυπεπτίδιο (GIP), απελευθερώνονται από το έντερο καθ 'όλη τη διάρκεια της ημέρας και τα επίπεδα αυξάνονται σε απόκριση σε ένα γεύμα. Αυτές οι ορμόνες απενεργοποιούνται ταχέως από το ένζυμο DPP-4. Οι κρεατίνες είναι μέρος ενός ενδογενούς συστήματος που εμπλέκεται στη φυσιολογική ρύθμιση της ομοιόστασης της γλυκόζης. Όταν οι συγκεντρώσεις γλυκόζης στο αίμα είναι φυσιολογικές ή αυξημένες, το GLP-1 και το GIP αυξάνουν την σύνθεση ινσουλίνης και απελευθερώνουν από παγκρεατικά βήτα κύτταρα με ενδοκυτταρικές οδούς σηματοδότησης που περιλαμβάνουν κυκλικό ΑΜΡ. Το GLP-1 μειώνει επίσης την έκκριση γλυκογόνου από τα παγκρεατικά άλφα κύτταρα, οδηγώντας σε μειωμένη παραγωγή ηπατικής γλυκόζης. Με την αύξηση και την παράταση των ενεργών επιπέδων ινκρετίνης, η σιταγλιπτίνη αυξάνει την απελευθέρωση ινσουλίνης και μειώνει τα επίπεδα γλυκαγόνης στην κυκλοφορία κατά τρόπο εξαρτώμενο από τη γλυκόζη. Η σιταγλιπτίνη επιδεικνύει εκλεκτικότητα για το DPP-4 και δεν αναστέλλει τη δραστικότητα DPP-8 ή DPP-9 in vitro σε συγκεντρώσεις που προσεγγίζουν εκείνες από θεραπευτικές δόσεις.
Υδροχλωρική μετφορμίνη
Η μετφορμίνη είναι ένας αντιυπεργλυκαιμικός παράγοντας που βελτιώνει την ανοχή στη γλυκόζη σε ασθενείς με διαβήτη τύπου 2, μειώνοντας τόσο τη βασική όσο και τη μεταγευματική γλυκόζη πλάσματος. Οι φαρμακολογικοί μηχανισμοί δράσης της είναι διαφορετικοί από άλλες κατηγορίες αντιϋπεργλυκαιμικών παραγόντων από του στόματος. Η μετφορμίνη μειώνει την παραγωγή ηπατικής γλυκόζης, μειώνει την εντερική απορρόφηση της γλυκόζης και βελτιώνει την ευαισθησία στην ινσουλίνη αυξάνοντας την περιφερική πρόσληψη και χρήση της γλυκόζης. Σε αντίθεση με τις σουλφονυλουρίες, η μετφορμίνη δεν προκαλεί υπογλυκαιμία ούτε σε ασθενείς με διαβήτη τύπου 2 ούτε σε φυσιολογικά άτομα (εκτός από ειδικές περιπτώσεις [βλέπε Προειδοποιήσεις και προφυλάξεις]) και δεν προκαλεί υπερινσουλιναιμία. Με τη θεραπεία με μετφορμίνη, η έκκριση ινσουλίνης παραμένει αμετάβλητη, ενώ τα επίπεδα ινσουλίνης νηστείας και η απόκριση ινσουλίνης στο πλάσμα της ημέρας μπορεί να μειωθεί.
12.2 Φαρμακοδυναμική
Σιταγλιπτίνη
Γενικός
Σε ασθενείς με διαβήτη τύπου 2, η χορήγηση σιταγλιπτίνης οδήγησε σε αναστολή της ενζυμικής δραστηριότητας της DPP-4 για 24ωρη περίοδο. Μετά από ένα από του στόματος φορτίο γλυκόζης ή ένα γεύμα, αυτή η αναστολή DPP-4 οδήγησε σε 2- έως 3-πλάσια αύξηση στα επίπεδα κυκλοφορίας των δραστικών GLP-1 και GIP, μειωμένες συγκεντρώσεις γλυκαγόνου και αυξημένη ανταπόκριση της απελευθέρωσης ινσουλίνης στη γλυκόζη, οδηγώντας σε υψηλότερο Ο-πεπτίδιο και ινσουλίνη συγκεντρώσεις. Η αύξηση της ινσουλίνης με τη μείωση της γλυκαγόνης συσχετίστηκε με χαμηλότερες συγκεντρώσεις γλυκόζης στη νηστεία και μειωμένη εκδρομή γλυκόζης μετά από ένα από του στόματος φορτίο γλυκόζης ή ένα γεύμα.
Σιταγλιπτίνη και υδροχλωρική μετφορμίνη Συν-χορήγηση
Σε μια μελέτη διάρκειας δύο ημερών σε υγιή άτομα, μόνο η σιταγλιπτίνη αύξησε τις συγκεντρώσεις της ενεργού GLP-1, ενώ η μετφορμίνη μόνο αύξησε τις δραστικές και τις ολικές συγκεντρώσεις του GLP-1 σε παρόμοιες περιπτώσεις. Η συγχορήγηση σιταγλιπτίνης και μετφορμίνης είχε πρόσθετο αποτέλεσμα στις ενεργές συγκεντρώσεις του GLP-1. Η σιταγλιπτίνη, αλλά όχι η μετφορμίνη, αύξησε τις δραστικές συγκεντρώσεις GIP. Δεν είναι σαφές τι σημαίνουν αυτά τα ευρήματα για αλλαγές στον γλυκαιμικό έλεγχο σε ασθενείς με διαβήτη τύπου 2.
Σε μελέτες με υγιή άτομα, η σιταγλιπτίνη δεν μείωσε τη γλυκόζη του αίματος ούτε προκάλεσε υπογλυκαιμία.
Καρδιακή Ηλεκτροφυσιολογία
Σε μια τυχαιοποιημένη, ελεγχόμενη με εικονικό φάρμακο διασταύρωση μελέτη, σε 79 υγιή άτομα χορηγήθηκε μια εφάπαξ από του στόματος δόση σιταγλιπτίνης 100 mg, σιταγλιπτίνης 800 mg (8 φορές της συνιστώμενης δόσης) και εικονικού φαρμάκου. Στη συνιστώμενη δόση των 100 mg, δεν παρατηρήθηκε επίδραση στο διάστημα QTc που ελήφθη στη μέγιστη συγκέντρωση στο πλάσμα ή σε οποιαδήποτε άλλη στιγμή κατά τη διάρκεια της μελέτης. Μετά τη δόση των 800 mg, η μέγιστη αύξηση της μέσης μεταβολής της QTc που είχε διορθωθεί με εικονικό φάρμακο από την αρχική τιμή στις 3 ώρες μετά τη χορήγηση ήταν 8,0 msec. Η αύξηση αυτή δεν θεωρείται κλινικά σημαντική. Στη δόση 800 mg, οι μέγιστες συγκεντρώσεις σιταγλιπτίνης στο πλάσμα ήταν περίπου 11 φορές υψηλότερες από τις μέγιστες συγκεντρώσεις μετά από δόση των 100 mg.
Σε ασθενείς με διαβήτη τύπου 2 που έλαβαν σιταγλιπτίνη 100 mg (N = 81) ή σιταγλιπτίνη 200 mg (N = 63) ημερησίως, δεν υπήρξαν ουσιαστικές αλλαγές στο διάστημα QTc με βάση τα δεδομένα ΗΚΓ που λήφθηκαν κατά το χρόνο του αναμενόμενου μέγιστου πλάσματος συγκέντρωση.
Φαρμακοκινητική
Janumet
Τα αποτελέσματα μιας μελέτης βιοϊσοδυναμίας σε υγιή άτομα κατέδειξαν ότι το Janumet (σιταγλιπτίνη / μετφορμίνη HCl) 50 mg / 500 mg και 50 mg / 1000 mg είναι βιοϊσοδύναμα με τη συγχορήγηση αντίστοιχων δόσεων σιταγλιπτίνης (JANUVIA™2) και υδροχλωρική μετφορμίνη ως επιμέρους δισκία.
Απορρόφηση
Σιταγλιπτίνη
Η απόλυτη βιοδιαθεσιμότητα της σιταγλιπτίνης είναι περίπου 87%. Η συγχορήγηση γεύματος υψηλής περιεκτικότητας σε λιπαρά με σιταγλιπτίνη δεν είχε καμία επίδραση στη φαρμακοκινητική της σιταγλιπτίνης.
Υδροχλωρική μετφορμίνη
Η απόλυτη βιοδιαθεσιμότητα ενός δισκίου 500 mg υδροχλωρικής μετφορμίνης που χορηγείται υπό συνθήκες νηστείας είναι περίπου 50-60%. Μελέτες που χρησιμοποιούν μεμονωμένες στοματικές δόσεις δισκίων υδροχλωρικής μετφορμίνης 500 mg έως 1500 mg και 850 mg έως 2550 mg, δείχνουν ότι υπάρχει έλλειψη αναλογικής δόσης με αυξανόμενες δόσεις, η οποία οφείλεται σε μειωμένη απορρόφηση και όχι σε αλλοίωση της αποβολής. Η τροφή μειώνει την έκταση και ελαφρώς καθυστερεί την απορρόφηση της μετφορμίνης, όπως φαίνεται από περίπου 40% χαμηλότερη μέση μέγιστη συγκέντρωση στο πλάσμα (CΜέγιστη), 25% χαμηλότερη περιοχή κάτω από την καμπύλη συγκέντρωσης πλάσματος έναντι χρόνου (AUC) και 35 λεπτά παράταση χρόνου έως μέγιστη συγκέντρωση στο πλάσμα (TΜέγιστη) μετά από τη χορήγηση ενός μεμονωμένου δισκίου μετφορμίνης των 850 mg με τροφή, σε σύγκριση με την ίδια δόση δισκίου που χορηγήθηκε νηστεία. Η κλινική σημασία αυτών των μειώσεων είναι άγνωστη.
Διανομή
Σιταγλιπτίνη
Ο μέσος όγκος κατανομής σε σταθερή κατάσταση μετά από μία μόνο ενδοφλέβια δόση 100 mg σιταγλιπτίνης σε υγιή άτομα είναι περίπου 198 λίτρα. Το κλάσμα της σιταγλιπτίνης που συνδέεται αναστρέψιμα με τις πρωτεΐνες του πλάσματος είναι χαμηλό (38%).
Υδροχλωρική μετφορμίνη
Ο φαινόμενος όγκος κατανομής (V / F) της μετφορμίνης μετά από εφάπαξ δόσεις από το στόμα των δισκίων υδροχλωρικής μετφορμίνης 850 mg κατά μέσο όρο 654 ± 358 L. Η μετφορμίνη δεσμεύεται αμελητέα στις πρωτεΐνες του πλάσματος, σε αντίθεση με τις σουλφονυλουρίες, οι οποίες είναι περισσότερο από 90% δεσμευμένες σε πρωτεΐνες. Η μετφορμίνη χωρίζει σε ερυθροκύτταρα, πιθανότατα ως συνάρτηση του χρόνου. Στις συνηθισμένες κλινικές δόσεις και στα δοσολογικά σχήματα των δισκίων υδροχλωρικής μετφορμίνης, οι σταθερές συγκεντρώσεις της μετφορμίνης στο πλάσμα επιτυγχάνονται εντός 24-48 ωρών και είναι γενικά
Μεταβολισμός
Σιταγλιπτίνη
Περίπου το 79% της σιταγλιπτίνης απεκκρίνεται αμετάβλητα στα ούρα, με μεταβολισμό να είναι μια μικρή οδός εξάλειψης.
Μετά από ένα [14C] σιταγλιπτίνης από το στόμα, περίπου το 16% της ραδιενέργειας απεκκρίνεται ως μεταβολίτες της σιταγλιπτίνης. Έξι μεταβολίτες ανιχνεύθηκαν σε ιχνοστοιχεία και δεν αναμένεται να συνεισφέρουν στην ανασταλτική δράση της σιταγλιπτίνης στο πλάσμα DPP-4. Μελέτες in vitro έδειξαν ότι το κύριο ένζυμο που είναι υπεύθυνο για τον περιορισμένο μεταβολισμό της σιταγλιπτίνης ήταν το CYP3A4, με τη συμβολή του CYP2C8.
Υδροχλωρική μετφορμίνη
Οι ενδοφλέβιες μελέτες μίας δόσης σε φυσιολογικά άτομα αποδεικνύουν ότι η μετφορμίνη απεκκρίνεται αμετάβλητη στο ούρα και δεν υποβάλλονται σε ηπατικό μεταβολισμό (δεν έχουν εντοπιστεί μεταβολίτες στον άνθρωπο) ούτε χοληφόρο απέκκριση.
Απέκκριση
Σιταγλιπτίνη
Μετά τη χορήγηση ενός από του στόματος [14C] σε υγιή άτομα, περίπου το 100% της χορηγούμενης ραδιενέργειας απομακρύνθηκε σε κόπρανα (13%) ή στα ούρα (87%) εντός μίας εβδομάδας από τη δοσολόγηση. Το φαινόμενο τερματικό t1/2 μετά από δόση 100 mg σιταγλιπτίνης από το στόμα ήταν περίπου 12,4 ώρες και η νεφρική κάθαρση ήταν περίπου 350 ml / λεπτό.
Η απομάκρυνση της σιταγλιπτίνης συμβαίνει κυρίως μέσω νεφρικής απέκκρισης και περιλαμβάνει ενεργή σωληναριακή έκκριση. Η σιταγλιπτίνη είναι ένα υπόστρωμα του ανθρώπινου οργανικού ανιόντος μεταφορέα-3 (hOAT-3), το οποίο μπορεί να εμπλέκεται στην νεφρική απομάκρυνση της σιταγλιπτίνης. Η κλινική σημασία της hOAT-3 στη μεταφορά σιταγλιπτίνης δεν έχει τεκμηριωθεί. Η σιταγλιπτίνη είναι επίσης ένα υπόστρωμα της ρ-γλυκοπρωτεΐνης, το οποίο μπορεί επίσης να εμπλέκεται στη μεσολάβηση της νεφρικής αποβολής της σιταγλιπτίνης. Ωστόσο, η κυκλοσπορίνη, ένας αναστολέας ρ-γλυκοπρωτεΐνης, δεν μείωσε τη νεφρική κάθαρση της σιταγλιπτίνης.
Υδροχλωρική μετφορμίνη
Η νεφρική κάθαρση είναι περίπου 3,5 φορές μεγαλύτερη από την κάθαρση κρεατινίνης, πράγμα που δείχνει ότι η σωληναριακή έκκριση είναι η κύρια οδός απομάκρυνσης της μετφορμίνης. Μετά από τη χορήγηση από το στόμα, περίπου το 90% του απορροφημένου φαρμάκου απομακρύνεται μέσω της νεφρικής οδού μέσα στις πρώτες 24 ώρες, με χρόνο ημιζωής αποβολής πλάσματος περίπου 6,2 ώρες. Στο αίμα, ο χρόνος ημίσειας ζωής αποβολής είναι περίπου 17,6 ώρες, γεγονός που υποδηλώνει ότι η μάζα των ερυθροκυττάρων μπορεί να είναι διαμέρισμα διανομής.
Ειδικοί πληθυσμοί
Νεφρική ανεπάρκεια
Janumet
Το Janumet δεν πρέπει να χρησιμοποιείται σε ασθενείς με νεφρική ανεπάρκεια [βλ Αντενδείξεις; Προειδοποιήσεις και προφυλάξεις].
Σιταγλιπτίνη
Μία περίπου 2 φορές αύξηση της AUC της σιταγλιπτίνης στο πλάσμα παρατηρήθηκε σε ασθενείς με μέτρια νεφρική ανεπάρκεια και περίπου 4 φορές αύξηση παρατηρήθηκε σε ασθενείς με σοβαρή νεφρική ανεπάρκεια, συμπεριλαμβανομένων των ασθενών με ESRD σε αιμοκάθαρση, σε σύγκριση με τους φυσιολογικούς υγιείς μάρτυρες μαθήματα.
Υδροχλωρική μετφορμίνη
Σε ασθενείς με μειωμένη νεφρική λειτουργία (με βάση την μετρούμενη κάθαρση κρεατινίνης), το πλάσμα και το χρόνο ημίσειας ζωής στο αίμα της μετφορμίνης παρατείνεται και η νεφρική κάθαρση μειώνεται ανάλογα με τη μείωση της κρεατινίνης εκτελωνισμός.
Ηπατική ανεπάρκεια
Σιταγλιπτίνη
Σε ασθενείς με μέτρια ηπατική ανεπάρκεια (βαθμολογία Child-Pugh 7 έως 9), η μέση AUC και CΜέγιστη της σιταγλιπτίνης αυξήθηκε κατά 21% και 13%, αντίστοιχα, συγκριτικά με τους υγιείς συνδυασμένους ελέγχους μετά από τη χορήγηση μίας μόνο δόσης σιταγλιπτίνης των 100 mg. Αυτές οι διαφορές δεν θεωρούνται κλινικά σημαντικές.
Δεν υπάρχει κλινική εμπειρία σε ασθενείς με σοβαρή ηπατική ανεπάρκεια (βαθμολογία Child-Pugh> 9).
Υδροχλωρική μετφορμίνη
Δεν έχουν διεξαχθεί φαρμακοκινητικές μελέτες με μετφορμίνη σε ασθενείς με ηπατική ανεπάρκεια.
Γένος
Σιταγλιπτίνη
Το φύλο δεν είχε κλινικά σημαντική επίδραση στη φαρμακοκινητική της σιταγλιπτίνης με βάση ένα σύνθετο υλικό ανάλυση φαρμακοκινητικών δεδομένων φάσης Ι και φαρμακοκινητική ανάλυση πληθυσμού της Φάσης Ι και της Φάσης ΙΙ δεδομένα.
Υδροχλωρική μετφορμίνη
Οι φαρμακοκινητικές παράμετροι της μετφορμίνης δεν διέφεραν σημαντικά μεταξύ των φυσιολογικών ατόμων και των ασθενών με διαβήτη τύπου 2 όταν αναλύθηκαν ανάλογα με το φύλο. Παρομοίως, σε ελεγχόμενες κλινικές μελέτες σε ασθενείς με διαβήτη τύπου 2, η αντιυπεργλυκαιμική δράση της μετφορμίνης ήταν συγκρίσιμη σε άνδρες και γυναίκες.
Γηριατρική
Σιταγλιπτίνη
Όταν ληφθούν υπόψη οι επιδράσεις της ηλικίας σε νεφρική λειτουργία, μόνο η ηλικία δεν είχε κλινικά σημαντική επίδραση στη φαρμακοκινητική της σιταγλιπτίνης με βάση τη φαρμακοκινητική του πληθυσμού ανάλυση. Τα ηλικιωμένα άτομα (65 έως 80 έτη) είχαν περίπου 19% υψηλότερες συγκεντρώσεις σιταγλιπτίνης στο πλάσμα σε σύγκριση με νεότερα άτομα.
Υδροχλωρική μετφορμίνη
Περιορισμένα δεδομένα από ελεγχόμενες φαρμακοκινητικές μελέτες μετφορμίνης σε υγιή ηλικιωμένα άτομα υποδηλώνουν ότι η συνολική κάθαρση της μετφορμίνης στο πλάσμα μειώνεται, η ημιζωή παρατείνεται και η CΜέγιστη αυξάνεται, σε σύγκριση με τα υγιή νεαρά άτομα. Από αυτά τα δεδομένα, φαίνεται ότι η αλλαγή στη φαρμακοκινητική της μετφορμίνης με τη γήρανση οφείλεται κατά κύριο λόγο στην αλλαγή της νεφρικής λειτουργίας (βλέπε GLUCOPHAGE3 πληροφορίες συνταγογράφησης: ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ, Ειδικοί Πληθυσμοί, Γηριατρική).
Η θεραπεία με Janumet δεν πρέπει να ξεκινά σε ασθενείς ηλικίας ≥ 80 ετών, εκτός εάν η μέτρηση της κάθαρσης κρεατινίνης καταδείξει ότι η νεφρική λειτουργία δεν μειώνεται [βλ. Προειδοποιήσεις και προφυλάξεις].
Παιδιατρικός
Δεν έχουν πραγματοποιηθεί μελέτες με το Janumet σε παιδιατρικούς ασθενείς.
Αγώνας
Σιταγλιπτίνη
Η φυλή δεν είχε κλινικά σημαντική επίδραση στη φαρμακοκινητική της σιταγλιπτίνης με βάση μια σύνθετη ανάλυση των διαθέσιμων φαρμακοκινητικών δεδομένων, συμπεριλαμβανομένων των ατόμων λευκού, ισπανικού, μαύρου, ασιατικού και άλλων φυλετικών ομάδες.
Υδροχλωρική μετφορμίνη
Δεν έχουν πραγματοποιηθεί μελέτες φαρμακοκινητικών παραμέτρων μετφορμίνης σύμφωνα με τη φυλή. Σε ελεγχόμενες κλινικές μελέτες με μετφορμίνη σε ασθενείς με διαβήτη τύπου 2, το αντιυπεργλυκαιμικό αποτέλεσμα ήταν συγκρίσιμο σε λευκοί (n = 249), μαύροι (n = 51) και ισπανικοί (n = 24).
Δείκτης Μάζας Σώματος (ΔΜΣ)
Σιταγλιπτίνη
Ο δείκτης μάζας σώματος δεν είχε κλινικά σημαντική επίδραση στη φαρμακοκινητική της σιταγλιπτίνης με βάση ένα σύνθετο υλικό ανάλυση φαρμακοκινητικών δεδομένων φάσης Ι και φαρμακοκινητική ανάλυση πληθυσμού της Φάσης Ι και της Φάσης ΙΙ δεδομένα.
Αλληλεπιδράσεις με άλλα φάρμακα
Σιταγλιπτίνη και υδροχλωρική μετφορμίνη
Η συγχορήγηση πολλαπλών δόσεων σιταγλιπτίνης (50 mg) και μετφορμίνης (1000 mg) χορηγούμενων δύο φορές ημερησίως δεν μεταβάλλει σημαντικά τη φαρμακοκινητική είτε της σιταγλιπτίνης είτε της μετφορμίνης σε ασθενείς με τύπο 2 Διαβήτης.
Δεν έχουν πραγματοποιηθεί μελέτες φαρμακοκινητικής αλληλεπίδρασης με το Janumet. Ωστόσο, τέτοιες μελέτες έχουν διεξαχθεί με τα μεμονωμένα συστατικά του Janumet (σιταγλιπτίνη και υδροχλωρική μετφορμίνη).
Σιταγλιπτίνη
In Vitro αξιολόγηση των αλληλεπιδράσεων φαρμάκων
Η σιταγλιπτίνη δεν είναι αναστολέας των ισοενζύμων CYP3A4, 2C8, 2C9, 2D6, 1A2, 2C19 ή 2B6 και δεν είναι επαγωγέας του CYP3A4. Η σιταγλιπτίνη είναι ένα υπόστρωμα ρ-γλυκοπρωτεΐνης, αλλά δεν αναστέλλει τη μεσολαβούμενη από ρ-γλυκοπρωτεΐνη μεταφορά διγοξίνης. Με βάση αυτά τα αποτελέσματα, η σιταγλιπτίνη θεωρείται απίθανο να προκαλέσει αλληλεπιδράσεις με άλλα φάρμακα που χρησιμοποιούν αυτές τις οδούς.
Η σιταγλιπτίνη δεν δεσμεύεται εκτεταμένα στις πρωτεΐνες του πλάσματος. Συνεπώς, η τάση της σιταγλιπτίνης να εμπλέκεται σε κλινικά σημαντικές αλληλεπιδράσεις φαρμάκου-φαρμάκου που προκαλούνται από την μετατόπιση δεσμεύσεως πρωτεΐνης πλάσματος είναι πολύ χαμηλή.
Αξιολόγηση in vivo των αλληλεπιδράσεων φαρμάκων
Επίδραση της σιταγλιπτίνης σε άλλα φάρμακα
Σε κλινικές μελέτες, όπως περιγράφεται παρακάτω, η σιταγλιπτίνη δεν άλλαξε σημαντικά τη φαρμακοκινητική της μετφορμίνης, της γλυβουρίδης, της σιμβαστατίνης, της ροσιγλιταζόνης, της βαρφαρίνης ή της στοματικής αντισυλληπτικά, παρέχοντας in vivo στοιχεία χαμηλής τάσης για την πρόκληση αλληλεπιδράσεων φαρμάκων με υποστρώματα του CYP3A4, του CYP2C8, του CYP2C9 και του οργανικού κατιονικού μεταφορέα (ΥΧΕ).
Διγοξίνη: Η σιταγλιπτίνη είχε ελάχιστη επίδραση στη φαρμακοκινητική της διγοξίνης. Μετά τη χορήγηση 0,25 mg διγοξίνης ταυτόχρονα με 100 mg σιταγλιπτίνης ημερησίως για 10 ημέρες, η AUC της διγοξίνης στο πλάσμα αυξήθηκε κατά 11% και το πλάσμα CΜέγιστη κατά 18%.
Σουλφονυλουρίες: Η φαρμακοκινητική μιας δόσης της γλυβουρίδης, ενός υποστρώματος του CYP2C9, δεν τροποποιήθηκε σημαντικά σε άτομα που έλαβαν πολλαπλές δόσεις σιταγλιπτίνης. Κλινικά σημαντικές αλληλεπιδράσεις δεν θα αναμένονταν με άλλες σουλφονυλουρίες (π.χ., γλιπιζίδη, τολβουταμίδη και γλιμεπιρίδη) οι οποίες, όπως και η γλυβουρίδη, εξαλείφονται κυρίως από το CYP2C9 [βλ. Προειδοποιήσεις και προφυλάξεις].
Σιμβαστατίνη: Η φαρμακοκινητική μιας δόσης σιμβαστατίνης, ενός υποστρώματος του CYP3A4, δεν τροποποιήθηκε σημαντικά σε άτομα που έλαβαν πολλαπλές ημερήσιες δόσεις σιταγλιπτίνης. Επομένως, η σιταγλιπτίνη δεν αποτελεί αναστολέα του μεταβολισμού που προκαλείται από το CYP3A4.
Θειαζολιδινεδιόνες: Η φαρμακοκινητική μιας δόσης ροσιγλιταζόνης δεν μεταβλήθηκε σημαντικά στους ασθενείς λαμβάνουν πολλαπλές ημερήσιες δόσεις σιταγλιπτίνης, υποδεικνύοντας ότι η σιταγλιπτίνη δεν είναι αναστολέας της διαμεσολαβούμενης από το CYP2C8 μεταβολισμός.
Βαρφαρίνη: Πολλαπλές ημερήσιες δόσεις σιταγλιπτίνης δεν άλλαξαν σημαντικά τη φαρμακοκινητική, όπως εκτιμήθηκε με μέτρηση της S (-) ή R (+) εναντιομερή βαρφαρίνης ή φαρμακοδυναμική (όπως αξιολογείται με μέτρηση της προθρομβίνης INR) μίας εφάπαξ δόσης βαρφαρίνη. Επειδή η S (-) βαρφαρίνη μεταβολίζεται κυρίως από το CYP2C9, τα δεδομένα αυτά υποστηρίζουν επίσης το συμπέρασμα ότι η σιταγλιπτίνη δεν είναι αναστολέας του CYP2C9.
Από του στόματος αντισυλληπτικά: Η συγχορήγηση με σιταγλιπτίνη δεν αλλοίωσε σημαντικά τη φαρμακοκινητική σταθερής κατάστασης της νορεθινδρόνης ή της αιθυνυλοιστραδιόλης.
Επίδραση άλλων φαρμάκων στη σιταγλιπτίνη
Τα κλινικά δεδομένα που περιγράφονται παρακάτω υποδεικνύουν ότι η σιταγλιπτίνη δεν είναι ευαίσθητη σε κλινικά σημαντικές αλληλεπιδράσεις με συγχορηγούμενα φάρμακα.
Κυκλοσπορίνη: Διεξήχθη μελέτη για την εκτίμηση της επίδρασης της κυκλοσπορίνης, ενός ισχυρού αναστολέα της ρ-γλυκοπρωτεΐνης, στη φαρμακοκινητική της σιταγλιπτίνης. Η συγχορήγηση μίας εφάπαξ από του στόματος δόσης 100 mg σιταγλιπτίνης και μιας εφάπαξ από του στόματος δόσης 600 mg κυκλοσπορίνης αύξησε την AUC και την CΜέγιστη της σιταγλιπτίνης κατά 29% και 68% αντίστοιχα. Αυτές οι μέτριες αλλαγές στη φαρμακοκινητική της σιταγλιπτίνης δεν θεωρήθηκαν κλινικά σημαντικές. Η νεφρική κάθαρση της σιταγλιπτίνης επίσης δεν τροποποιήθηκε σημαντικά. Επομένως, δεν θα αναμένονταν σημαντικές αλληλεπιδράσεις με άλλους αναστολείς της ρ-γλυκοπρωτεΐνης.
Υδροχλωρική μετφορμίνη
[Βλέπω Αλληλεπιδράσεις με άλλα φάρμακα]
μπλουζα
Μη κλινική τοξικολογία
Καρκινογένεση, μεταλλαξιογένεση, βλάβη της γονιμότητας
Janumet
Δεν έχουν πραγματοποιηθεί μελέτες σε ζώα με τα συνδυασμένα προϊόντα στο Janumet για την αξιολόγηση καρκινογένεσης, μεταλλαξιογένεσης ή βλάβης της γονιμότητας. Τα ακόλουθα δεδομένα βασίζονται στα ευρήματα σε μελέτες με σιταγλιπτίνη και μετφορμίνη μεμονωμένα.
Σιταγλιπτίνη
Διεξήχθη διετής μελέτη καρκινογένεσης σε αρσενικούς και θηλυκούς αρουραίους που έλαβαν σιταγλιπτίνη από το στόμα 50, 150 και 500 mg / kg / ημέρα. Υπήρξε αυξημένη συχνότητα συνδυασμένου αδενώματος ή καρκίνου του ήπατος σε άνδρες και γυναίκες και καρκινώματος ήπατος σε γυναίκες στα 500 mg / kg. Αυτή η δόση έχει ως αποτέλεσμα εκθέσεις περίπου 60 φορές μεγαλύτερη από την έκθεση του ανθρώπου στη μέγιστη συνιστώμενη ημερήσια δόση ανθρώπινης δόσης (HRHD) 100 mg / ημέρα με βάση τις συγκρίσεις AUC. Οι όγκοι του ήπατος δεν παρατηρήθηκαν στα 150 mg / kg, περίπου 20 φορές την έκθεση του ανθρώπου στο MRHD. Διεξήχθη διετής μελέτη καρκινογένεσης σε αρσενικούς και θηλυκούς ποντικούς που έλαβαν δόσεις σιταγλιπτίνης από το στόμα 50, 125, 250 και 500 mg / kg / ημέρα. Δεν παρατηρήθηκε αύξηση της συχνότητας εμφάνισης όγκων σε οποιοδήποτε όργανο έως 500 mg / kg, περίπου 70 φορές την έκθεση του ανθρώπου στο MRHD. Η σιταγλιπτίνη δεν ήταν μεταλλαξιογόνος ή κλαστογόνος με ή χωρίς μεταβολική ενεργοποίηση στη δοκιμασία βακτηριακής μεταλλαξιγένεσης Ames, μια ωοθήκη κινέζικου χάμστερ (CHO) δοκιμασία χρωμοσωματικής εκτροπής, προσδιορισμό κυτταρογενετικής in vitro σε CHO, δοκιμασία αλκαλικής έκλουσης DNA από ηπατοκύτταρα αρουραίου in vitro και in vivo μικροπυρήνα χημική δοκιμή.
Σε μελέτες γονιμότητας σε αρουραίους με δόσεις από το στόμα από το στόμα 125, 250 και 1000 mg / kg, τα αρσενικά υποβλήθηκαν σε θεραπεία για 4 εβδομάδες πριν από το ζευγάρωμα, κατά τη διάρκεια (περίπου 8 εβδομάδες συνολικά) και τα θηλυκά υποβλήθηκαν σε θεραπεία 2 εβδομάδες πριν από το ζευγάρωμα κατά τη διάρκεια της κύησης ημέρα 7. Δεν παρατηρήθηκαν ανεπιθύμητες ενέργειες στη γονιμότητα στα 125 mg / kg (περίπου 12 φορές την έκθεση του ανθρώπου στο MRHD των 100 mg / ημέρα βάσει των συγκρίσεων AUC). Σε υψηλότερες δόσεις παρατηρήθηκαν αυξημένες απορροφήσεις που σχετίζονταν με τη μηδóση σε θηλυκά ζώα (περίπου 25 και 100 φορές ανθρώπινη έκθεση στο MRHD με βάση τη σύγκριση AUC).
Υδροχλωρική μετφορμίνη
Έχουν διεξαχθεί μακροχρόνιες μελέτες καρκινογένεσης σε αρουραίους (δόση 104 εβδομάδων) και ποντίκια (διάρκεια δοσολόγησης 91 εβδομάδων) σε δόσεις μέχρι και 900 mg / kg / ημέρα και 1500 mg / kg / ημέρα, αντίστοιχα. Αυτές οι δόσεις είναι περίπου τέσσερις φορές η μέγιστη συνιστώμενη ανθρώπινη ημερήσια δόση των 2000 mg με βάση τις συγκρίσεις επιφάνειας σώματος. Δεν βρέθηκαν στοιχεία καρκινογένεσης με μετφορμίνη σε αρσενικούς ή θηλυκούς ποντικούς. Παρομοίως, δεν παρατηρήθηκε ογκογονικό δυναμικό με μετφορμίνη σε αρσενικούς αρουραίους. Υπήρχε, ωστόσο, αυξημένη συχνότητα εμφάνισης καλοήθων πολυπόδων στρωματικής μήτρας σε θηλυκούς αρουραίους που έλαβαν θεραπεία με 900 mg / kg / ημέρα.
Δεν υπήρξαν ενδείξεις μεταλλαξιογόνου δυναμικού της μετφορμίνης στις ακόλουθες in vitro δοκιμασίες: Δοκιμή Ames (S. typhimurium), εξέταση γονιδιακής μετάλλαξης (κύτταρα λεμφώματος ποντικού) ή δοκιμασία χρωμοσωμικών εκτροπών (ανθρώπινα λεμφοκύτταρα). Τα αποτελέσματα στην in vivo δοκιμή μικροπυρήνων ποντικού ήταν επίσης αρνητικά. Η γονιμότητα αρσενικών ή θηλυκών αρουραίων δεν επηρεάστηκε από τη μετφορμίνη όταν χορηγήθηκε σε δόσεις τόσο υψηλές όσο 600 mg / kg / ημέρα, που είναι περίπου τριπλάσια της μέγιστης συνιστώμενης ανθρώπινης ημερήσιας δόσης με βάση την επιφάνεια του σώματος συγκρίσεις.
μπλουζα
Κλινικές μελέτες
Η συγχορήγηση σιταγλιπτίνης και μετφορμίνης έχει μελετηθεί σε ασθενείς με διαβήτη τύπου 2 που δεν ελέγχονται επαρκώς με δίαιτα και άσκηση και σε συνδυασμό με γλιμεπιρίδη.
Δεν έχουν διεξαχθεί μελέτες κλινικής αποτελεσματικότητας με το Janumet. Ωστόσο, αποδείχθηκε η βιοϊσοδυναμία του Janumet με τα συγχορηγούμενα δισκία σιταγλιπτίνης και υδροχλωρικής μετφορμίνης.
Συγκέντρωση σιταγλιπτίνης και μετφορμίνης σε ασθενείς με διαβήτη τύπου 2 ανεπαρκώς ελεγχόμενοι στη δίαιτα και την άσκηση
Συνολικά 1091 ασθενείς με διαβήτη τύπου 2 και ανεπαρκής γλυκαιμικός έλεγχος στη διατροφή και την άσκηση συμμετείχαν σε μια 24-εβδομάδα, τυχαιοποιημένη, διπλή-τυφλή, ελεγχόμενη με εικονικό φάρμακο μελέτη παράγοντα που σχεδιάστηκε για να αξιολογήσει την αποτελεσματικότητα της σιταγλιπτίνης και της μετφορμίνης συγχορήγηση. Οι ασθενείς με αντιυπεργλυκαιμικό παράγοντα (N = 541) υποβλήθηκαν σε δίαιτα, άσκηση και περίοδο έκπλυσης φαρμάκων διάρκειας έως και 12 εβδομάδων. Μετά την περίοδο απομάκρυνσης, οι ασθενείς με ανεπαρκή γλυκαιμικό έλεγχο (A1C 7,5% έως 11%) τυχαιοποιήθηκαν μετά την ολοκλήρωση μιας εφάπαξ περιόδου τυφλού ελεγχόμενου placebo δύο εβδομάδων. Ασθενείς που δεν είχαν αντιυπεργλυκαιμικούς παράγοντες κατά την είσοδο στη μελέτη (N = 550) με ανεπαρκή γλυκαιμικό έλεγχο (A1C 7,5% έως 11%) εισήλθαν αμέσως στην 2-εβδομάδα μονο-τυφλή περίοδο εικονικού φαρμάκου και στη συνέχεια ήταν τυχαιοποιημένη. Περίπου ίσος αριθμός ασθενών τυχαιοποιήθηκαν για να λάβουν εικονικό φάρμακο, 100 mg σιταγλιπτίνης άπαξ ημερησίως, 500 mg ή 1000 mg μετφορμίνης δύο φορές την ημέρα ή 50 mg σιταγλιπτίνης δύο φορές την ημέρα σε συνδυασμό με 500 mg ή 1000 mg μετφορμίνης δύο φορές καθημερινά. Οι ασθενείς που δεν κατάφεραν να ανταποκριθούν σε συγκεκριμένους γλυκαιμικούς στόχους κατά τη διάρκεια της μελέτης υποβλήθηκαν σε θεραπεία με διάσωση γλυβουρίδης (γλιβενκλαμίδη).
Η συγχορήγηση σιταγλιπτίνης και μετφορμίνης παρείχε σημαντικές βελτιώσεις στην A1C, FPG και 2 ώρες PPG σε σύγκριση με το εικονικό φάρμακο, μόνο με μετφορμίνη και μόνο σιταγλιπτίνη (Πίνακας 3, Εικόνα 1). Οι μέσες μειώσεις από την αρχική τιμή της A1C ήταν γενικά μεγαλύτερες για ασθενείς με υψηλότερες τιμές A1C της αρχικής τιμής. Για τους ασθενείς που δεν έλαβαν αντιυπεργλυκαιμικό παράγοντα κατά την είσοδο στη μελέτη, οι μέσες μειώσεις από την αρχική τιμή της A1C ήταν: σιταγλιπτίνη 100 mg μία φορά την ημέρα, -1,1%. μετφορμίνη 500 mg δύο φορές την ημέρα, -1,1%. μετφορμίνη 1000 mg δύο φορές την ημέρα, -1,2%. σιταγλιπτίνη 50 mg δύο φορές την ημέρα με μετφορμίνη 500 mg δύο φορές την ημέρα, -1,6%. σιταγλιπτίνη 50 mg δύο φορές την ημέρα με μετφορμίνη 1000 mg δύο φορές την ημέρα, -1,9%. και για τους ασθενείς που ελάμβαναν εικονικό φάρμακο, -0,2%. Τα αποτελέσματα του λιπιδίου ήταν γενικά ουδέτερα. Η μείωση του σωματικού βάρους στις ομάδες που έλαβαν σιταγλιπτίνη σε συνδυασμό με μετφορμίνη ήταν παρόμοια με εκείνη των ομάδων που έλαβαν μετφορμίνη μόνο ή εικονικό φάρμακο.
Πίνακας 3: Γλυκαιμικές παράμετροι στην τελική επίσκεψη (Μελέτη 24-εβδομάδων) για σιταγλιπτίνη και μετφορμίνη, μόνοι και σε συνδυασμό σε ασθενείς με διαβήτη τύπου 2 ανεπαρκώς ελεγχόμενοι στη δίαιτα και την άσκηση *
Εικονικό φάρμακο |
Σιταγλιπτίνη 100 mg QD |
Μετφορμίνη 500 mg bid |
Μετφορμίνη 1000 mg bid |
Σιταγλιπτίνη 50 mg bid + Μετφορμίνη 500 mg bid |
Σιταγλιπτίνη 50 mg bid + Μετφορμίνη 1000 mg bid |
|
| ||||||
| A1C (%) | Ν = 165 | Ν = 175 | Ν = 178 | Ν = 177 | Ν = 183 | Ν = 178 |
| Βασική γραμμή (μέση τιμή) | 8.7 | 8.9 | 8.9 | 8.7 | 8.8 | 8.8 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | 0.2 | -0.7 | -0.8 | -1.1 | -1.4 | -1.9 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο†) (95% CI) |
-0.8ντο (-1.1, -0.6) |
-1.0ντο (-1.2, -0.8) |
-1.3ντο (-1.5, -1.1) |
-1.6ντο (-1.8, -1.3) |
-2.1ντο (-2.3, -1.8) |
|
| Οι ασθενείς (%) που επιτυγχάνουν A1C <7% | 15 (9%) | 35 (20%) | 41 (23%) | 68 (38%) | 79 (43%) | 118 (66%) |
| % Ασθενείς που λαμβάνουν φάρμακο διάσωσης | 32 | 21 | 17 | 12 | 8 | 2 |
| FPG (mg / dL) | Ν = 169 | Ν = 178 | Ν = 179 | Ν = 179 | Ν = 183 | Ν = 180 |
| Βασική γραμμή (μέση τιμή) | 196 | 201 | 205 | 197 | 204 | 197 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | 6 | -17 | -27 | -29 | -47 | -64 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο†) (95% CI) |
-23ντο (-33, -14) |
-33ντο (-43, -24) |
-35ντο (-45, -26) |
-53ντο (-62, -43) |
-70ντο (-79, -60) |
|
| 2 ώρες PPG (mg / dL) | Ν = 129 | Ν = 136 | Ν = 141 | Ν = 138 | Ν = 147 | Ν = 152 |
| Βασική γραμμή (μέση τιμή) | 277 | 285 | 293 | 283 | 292 | 287 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | 0 | -52 | -53 | -78 | -93 | -117 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο†) (95% CI) |
-52ντο (-67, -37) |
-54ντο (-69, -39) |
-78ντο (-93, -63) |
-93ντο (-107, -78) |
-117ντο (-131, -102) |

Σχήμα 1: Μέση Αλλαγή από την αρχική τιμή για την A1C (%) σε 24 εβδομάδες με Sitagliptin και Metformin, Μόνο και σε συνδυασμό σε ασθενείς με διαβήτη τύπου 2 ανεπαρκώς ελεγχόμενο με δίαιτα και άσκηση "
Επιπλέον, αυτή η μελέτη περιελάμβανε ασθενείς (N = 117) με πιο σοβαρή υπεργλυκαιμία (A1C> 11% ή αίμα γλυκόζη> 280 mg / dL) οι οποίοι υποβλήθηκαν σε αγωγή με ανοικτή αμφίπλευρη ημερήσια δόση σιταγλιπτίνης 50 mg και μετφορμίνης 1000 mg. Σε αυτή την ομάδα ασθενών, η μέση αρχική τιμή A1C ήταν 11,2%, η μέση τιμή FPG ήταν 314 mg / dL και η μέση τιμή 2 ώρες της PPG ήταν 441 mg / dL. Μετά από 24 εβδομάδες, παρατηρήθηκαν μέσες μειώσεις από την αρχική τιμή -2,9% για την A1C, -127 mg / dL για FPG και -208 mg / dL για 2 ώρες PPG.
Η αρχική θεραπεία συνδυασμού ή η συντήρηση της συνδυασμένης θεραπείας θα πρέπει να εξατομικεύεται και να αφήνεται στη διακριτική ευχέρεια του παρόχου υγειονομικής περίθαλψης.
Σιταγλιπτίνη συμπληρωματική θεραπεία σε ασθενείς με διαβήτη τύπου 2 ανεπαρκώς ελεγχόμενοι με μετφορμίνη μόνο
Συνολικά 701 ασθενείς με διαβήτη τύπου 2 συμμετείχαν σε μια τυχαιοποιημένη, διπλά τυφλή, ελεγχόμενη με εικονικό φάρμακο μελέτη, διάρκειας 24 εβδομάδων, που σχεδιάστηκε για να αξιολογήσει την αποτελεσματικότητα της σιταγλιπτίνης σε συνδυασμό με μετφορμίνη. Οι ασθενείς που ήταν ήδη σε θεραπεία με μετφορμίνη (Ν = 431) σε δόση τουλάχιστον 1500 mg ημερησίως τυχαιοποιήθηκαν μετά την ολοκλήρωση μιας εφάπαξ περιόδου εφάπαξ εικονικής θεραπείας με εικονικό φάρμακο (placebo). Ασθενείς με μετφορμίνη και άλλο αντιυπεργλυκαιμικό παράγοντα (N = 229) και ασθενείς που δεν υποβλήθηκαν σε αντιυπεργλυκαιμικούς παράγοντες (εκτός θεραπείας για τουλάχιστον 8 εβδομάδες, N = 41) τυχαιοποιήθηκαν μετά από μια περίοδο διαρκείας περίπου 10 εβδομάδων σε μετφορμίνη (σε δόση τουλάχιστον 1500 mg ημερησίως) σε μονοθεραπεία. Οι ασθενείς τυχαιοποιήθηκαν για την προσθήκη είτε 100 mg σιταγλιπτίνης είτε εικονικού φαρμάκου, που χορηγήθηκε μία φορά την ημέρα. Ασθενείς που δεν κατάφεραν να εκπληρώσουν συγκεκριμένους στόχους γλυκεμικής κατά τη διάρκεια των μελετών υποβλήθηκαν σε θεραπεία με διάσωση της πιογλιταζόνης.
Σε συνδυασμό με μετφορμίνη, η σιταγλιπτίνη παρείχε σημαντικές βελτιώσεις στην A1C, FPG και 2 ώρες PPG σε σύγκριση με το εικονικό φάρμακο με μετφορμίνη (Πίνακας 4). Η γλυκαιμική θεραπεία διάσωσης χρησιμοποιήθηκε στο 5% των ασθενών που έλαβαν σιταγλιπτίνη 100 mg και το 14% των ασθενών που έλαβαν εικονικό φάρμακο. Παρόμοια μείωση στο σωματικό βάρος παρατηρήθηκε και για τις δύο ομάδες θεραπείας.
Πίνακας 4: Γλυκαιμικές παράμετροι στην τελική επίσκεψη (μελέτη διάρκειας 24 εβδομάδων) της σιταγλιπτίνης σε συνδυασμένη θεραπευτική αγωγή με μετφορμίνη *
| Σιταγλιπτίνη 100 mg QD + Μετφορμίνη |
Εικονικό φάρμακο + Μετφορμίνη |
|
| ||
| A1C (%) | Ν = 453 | Ν = 224 |
| Βασική γραμμή (μέση τιμή) | 8.0 | 8.0 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | -0.7 | -0.0 |
| Διαφορά από εικονικό φάρμακο + μετφορμίνη (προσαρμοσμένη μέση τιμή)†) (95% CI) |
-0.7ντο (-0.8, -0.5) |
|
| Οι ασθενείς (%) που επιτυγχάνουν A1C <7% | 213 (47%) | 41 (18%) |
| FPG (mg / dL) | Ν = 454 | Ν = 226 |
| Βασική γραμμή (μέση τιμή) | 170 | 174 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | -17 | 9 |
| Διαφορά από εικονικό φάρμακο + μετφορμίνη (προσαρμοσμένη μέση τιμή)†) (95% CI) |
-25ντο (-31, -20) |
|
| 2 ώρες PPG (mg / dL) | Ν = 387 | Ν = 182 |
| Βασική γραμμή (μέση τιμή) | 275 | 272 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | -62 | -11 |
| Διαφορά από εικονικό φάρμακο + μετφορμίνη (προσαρμοσμένη μέση τιμή)†) (95% CI) |
-51ντο (-61, -41) |
Προσθετική θεραπεία με σιταγλιπτίνη σε ασθενείς με διαβήτη τύπου 2 ανεπαρκώς ελεγχόμενοι στο συνδυασμό των μετφορμίνης και γλιμεπιρίδης
Συνολικά 441 ασθενείς με διαβήτη τύπου 2 συμμετείχαν σε μία τυχαιοποιημένη, διπλά τυφλή, 24 εβδομάδων, ελεγχόμενη με εικονικό φάρμακο μελέτη που σχεδιάστηκε για την αξιολόγηση της αποτελεσματικότητας της σιταγλιπτίνης σε συνδυασμό με τη γλιμεπιρίδη, με ή χωρίς μετφορμίνη. Οι ασθενείς εισήλθαν σε περίοδο θεραπείας κατά τη διάρκεια της θεραπείας με γλιμεπιρίδη (μόνο 4 mg ημερησίως) ή με τη γλιμεπιρίδη σε συνδυασμό με μετφορμίνη (≤ 1500 mg ημερησίως). Μετά από μια περίοδο τιτλοποίησης δόσης και σταθερής δόσης έως 16 εβδομάδες και με περίοδο εικονικού φαρμάκου διάρκειας 2 εβδομάδων, οι ασθενείς με ανεπαρκή γλυκαιμικό έλεγχο (A1C 7,5% έως 10,5%) τυχαιοποιήθηκαν στην προσθήκη είτε 100 mg σιταγλιπτίνης είτε εικονικού φαρμάκου, που χορηγήθηκε μία φορά καθημερινά. Ασθενείς που δεν κατάφεραν να εκπληρώσουν συγκεκριμένους στόχους γλυκεμικής κατά τη διάρκεια των μελετών υποβλήθηκαν σε θεραπεία με διάσωση της πιογλιταζόνης.
Οι ασθενείς που έλαβαν σιταγλιπτίνη με μετφορμίνη και γλιμεπιρίδη είχαν σημαντικές βελτιώσεις στην A1C και FPG σε σύγκριση με ασθενείς που έλαβαν εικονικό φάρμακο με μετφορμίνη και γλιμεπιρίδη (Πίνακας 5), με μέσες μειώσεις από την αρχική τιμή σε σχέση με το εικονικό φάρμακο στην A1C κατά -0,9% και σε FPG των -21 mg / dL. Η θεραπεία διάσωσης χρησιμοποιήθηκε στο 8% των ασθενών που έλαβαν σιταγλιπτίνη 100 mg και το 29% των ασθενών που έλαβαν εικονικό φάρμακο. Οι ασθενείς που έλαβαν θεραπεία με πρόσθετη σιταγλιπτίνη είχαν μέση αύξηση σωματικού βάρους 1,1 kg έναντι πρόσθετο εικονικό φάρμακο (+0,4 kg vs. -0,7 kg). Επιπλέον, η πρόσθετη σιταγλιπτίνη είχε ως αποτέλεσμα αυξημένο ποσοστό υπογλυκαιμίας σε σύγκριση με το πρόσθετο εικονικό φάρμακο. [Βλέπω Προειδοποιήσεις και προφυλάξεις; Ανεπιθύμητες ενέργειες.]
Πίνακας 5: Γλυκαιμικές παράμετροι στην τελική επίσκεψη (μελέτη 24 εβδομάδων) για τη σιταγλιπτίνη σε συνδυασμό με μετφορμίνη και γλιμεπιρίδη *
| Σιταγλιπτίνη 100 mg + Μετφορμίνη και γλιμεπιρίδη |
Εικονικό φάρμακο + Μετφορμίνη και γλιμεπιρίδη |
|
| ||
| A1C (%) | Ν = 115 | Ν = 105 |
| Βασική γραμμή (μέση τιμή) | 8.3 | 8.3 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | -0.6 | 0.3 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο†) (95% CI) | -0.9ντο (-1.1, -0.7) |
|
| Οι ασθενείς (%) που επιτυγχάνουν A1C <7% | 26 (23%) | 1 (1%) |
| FPG (mg / dL) | Ν = 115 | Ν = 109 |
| Βασική γραμμή (μέση τιμή) | 179 | 179 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | -8 | 13 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο†) (95% CI) | -21ντο (-32, -10) |
Σιταγλιπτίνη Add-on Θεραπεία vs. Θεραπεία προσθήκης Glipizide σε ασθενείς με διαβήτη τύπου 2 ανεπαρκώς ελεγχόμενοι σε μετφορμίνη
Η αποτελεσματικότητα της σιταγλιπτίνης αξιολογήθηκε σε μια 52-εβδομάδων, διπλά-τυφλή, ελεγχόμενη με γλιπιζίδη μελέτη μη ευνοϊκότητας σε ασθενείς με διαβήτη τύπου 2. Οι ασθενείς που δεν υποβλήθηκαν σε θεραπεία ή σε άλλους αντιυπεργλυκαιμικούς παράγοντες εισήλθαν σε περίοδο θεραπείας διαρκείας έως 12 εβδομάδων με μονοθεραπεία με μετφορμίνη (δόση ≥ 1500 mg ημερησίως) η οποία περιελάμβανε έκπλυση άλλων φαρμάκων εκτός της μετφορμίνης, εάν εφαρμόσιμος. Μετά την περίοδο διατήρησης, οι ασθενείς με ανεπαρκή γλυκαιμικό έλεγχο (A1C 6,5% έως 10%) τυχαιοποιήθηκαν 1: 1 στην προσθήκη σιταγλιπτίνης 100 mg μία φορά την ημέρα ή γλιπιζίδης για 52 εβδομάδες. Οι ασθενείς που έλαβαν γλιπιζίδη έλαβαν αρχική δόση 5 mg / ημέρα και κατόπιν τιτλοδοτήθηκαν εκλεκτικά τις επόμενες 18 εβδομάδες σε μέγιστη δόση 20 mg / ημέρα, όπως απαιτείται για τη βελτιστοποίηση του γλυκαιμικού ελέγχου. Στη συνέχεια, η δόση της γλιπιζίδης έπρεπε να διατηρείται σταθερή, εκτός από τη μείωση της τιτλοποίησης για την πρόληψη της υπογλυκαιμίας. Η μέση δόση της γλιπιζίδης μετά την περίοδο τιτλοδότησης ήταν 10 mg.
Μετά από 52 εβδομάδες, η σιταγλιπτίνη και η γλιπιζίδη είχαν παρόμοιες μέσες μειώσεις από την αρχική τιμή της A1C στην ανάλυση πρόθεσης προς θεραπεία (Πίνακας 6). Αυτά τα αποτελέσματα ήταν σύμφωνα με την ανάλυση ανά πρωτόκολλο (Σχήμα 2). Ένα συμπέρασμα υπέρ της μη κατωτερότητας της σιταγλιπτίνης στη γλιπιζίδη μπορεί να περιορίζεται σε ασθενείς με αρχική τιμή A1C συγκρίσιμες με εκείνες που περιλαμβάνονται στη μελέτη (πάνω από το 70% των ασθενών είχαν αρχική A1C <8% και πάνω από 90% είχαν A1C <9%).
Πίνακας 6: Γλυκαιμικές παράμετροι σε μια μελέτη 52 εβδομάδων που συγκρίνει τη σιταγλιπτίνη με τη γλιπιζίδη ως θεραπεία προσθήκης σε ασθενείς ανεπαρκώς ελεγχόμενους σε μετφορμίνη (πληθυσμός προσανατολισμού προς θεραπεία) *
| Σιταγλιπτίνη 100 mg + Μετφορμίνη |
Glipizide + Μετφορμίνη |
|
| ||
| A1C (%) | Ν = 576 | Ν = 559 |
| Βασική γραμμή (μέση τιμή) | 7.7 | 7.6 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | -0.5 | -0.6 |
| FPG (mg / dL) | Ν = 583 | Ν = 568 |
| Βασική γραμμή (μέση τιμή) | 166 | 164 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος†) | -8 | -8 |
Σχήμα 2: Μέση Αλλαγή από την αρχική τιμή για A1C (%) Πάνω από 52 εβδομάδες σε μια Μελέτη Συγκρίνοντας τη Σιταγλιπτίνη σε Το Glipizide ως θεραπεία προσθήκης σε ασθενείς ανεπαρκώς ελεγχόμενους σε μετφορμίνη (ανά πληθυσμό πρωτοκόλλου) â€
Η επίπτωση της υπογλυκαιμίας στην ομάδα της σιταγλιπτίνης (4,9%) ήταν σημαντικά (p <0,001) χαμηλότερη από εκείνη της ομάδας γλιπιζίδης (32,0%). Οι ασθενείς που έλαβαν θεραπεία με σιταγλιπτίνη εμφάνισαν σημαντική σημαντική μείωση από το αρχικό βάρος στο σωματικό βάρος σε σύγκριση με σημαντική αύξηση βάρους σε ασθενείς που έλαβαν γλιπιζίδη (-1,5 kg vs. +1,1 kg).
μπλουζα
Πώς παρέχεται
Αρ. 6747 - Τα δισκία Janumet, 50 mg / 500 mg, είναι ανοιχτό ροζ, σε σχήμα κάψουλας, επικαλυμμένα με λεπτό υμένιο δισκία με χαραγμένο στη μία πλευρά "575". Παρέχονται ως εξής:
NDC 0006-0575-61 φιαλίδια μονάδας χρήσης 60
NDC 0006-0575-62 φιαλίδια μονάδας χρήσης 180
NDC 0006-0575-52 συσκευασίες blister μονάδων δόσης των 50
NDC 0006-0575-82 χύδην μπουκάλια 1000.
Αρ. 6749 - Τα δισκία Janumet, 50 mg / 1000 mg, είναι κόκκινα, σε κάψουλα, επικαλυμμένα με λεπτό υμένιο δισκία με χαραγμένο "577" στη μία πλευρά. Παρέχονται ως εξής:
NDC 0006-0577-61 φιαλίδια μονάδας χρήσης 60
NDC 0006-0577-62 φιάλες μονάδας χρήσης 180
NDC 0006-0577-52 συσκευασίες blister μονάδων δόσης των 50
NDC 0006-0577-82 χύδην μπουκάλια 1000.
Φυλάσσεται στους 20-25 ° C (68-77 ° F), επιτρέπονται εκδρομές στους 15-30 ° C (59-86 ° F).
μπλουζα
Πληροφορίες για την παροχή συμβουλών σε ασθενείς
Οδηγίες
Οι ασθενείς θα πρέπει να ενημερώνονται για τους πιθανούς κινδύνους και οφέλη του Janumet και για εναλλακτικούς τρόπους θεραπείας. Θα πρέπει επίσης να ενημερώνονται για τη σημασία της τήρησης των διατροφικών οδηγιών, της τακτικής σωματικής άσκησης, του περιοδικού αίματος την παρακολούθηση της γλυκόζης και τον έλεγχο της A1C, την αναγνώριση και τη διαχείριση της υπογλυκαιμίας και της υπεργλυκαιμίας και την αξιολόγηση του διαβήτη επιπλοκές. Κατά τη διάρκεια περιόδων στρες όπως πυρετός, τραύμα, λοίμωξη ή χειρουργική επέμβαση, οι φαρμακευτικές απαιτήσεις ενδέχεται να αλλάξουν και οι ασθενείς θα πρέπει να συμβουλεύονται να ζητούν αμέσως ιατρική συμβουλή.
Οι κίνδυνοι γαλακτικής οξέωσης λόγω της συνιστώσας της μετφορμίνης, των συμπτωμάτων της και των συνθηκών που προδιαθέτουν στην ανάπτυξή της, όπως αναφέρεται στο Προειδοποιήσεις και προφυλάξεις, θα πρέπει να εξηγείται στους ασθενείς. Οι ασθενείς θα πρέπει να ενημερώνονται για να διακόψουν αμέσως το Janumet και να ενημερώσουν αμέσως τον επαγγελματία υγείας τους εάν υπάρχει ανεξήγητος υπεραερισμός, μυαλγία, αίσθημα κακουχίας, ασυνήθιστη υπνηλία, ζάλη, αργό ή ακανόνιστο καρδιακό ρυθμό, αίσθηση ψυχρού (ειδικά στα άκρα) ή άλλα μη ειδικά συμπτώματα συμβούν. Τα γαστρεντερικά συμπτώματα είναι κοινά κατά την έναρξη της θεραπείας με μετφορμίνη και μπορεί να εμφανιστούν κατά την έναρξη της θεραπείας με Janumet. Ωστόσο, οι ασθενείς θα πρέπει να συμβουλεύονται το γιατρό τους εάν εμφανίσουν ανεξήγητα συμπτώματα. Αν και τα γαστρεντερικά συμπτώματα που εμφανίζονται μετά τη σταθεροποίηση είναι απίθανο να σχετίζονται με το φάρμακο, ένα τέτοιο η εμφάνιση των συμπτωμάτων θα πρέπει να αξιολογηθεί για να προσδιοριστεί εάν μπορεί να οφείλεται σε γαλακτική οξέωση ή σε άλλη σοβαρή νόσος.
Οι ασθενείς θα πρέπει να συμβουλεύονται την υπερβολική πρόσληψη αλκοόλ, είτε οξείες είτε χρόνιες, ενώ λαμβάνουν Janumet.
Οι ασθενείς θα πρέπει να ενημερώνονται για τη σημασία της τακτικής εξέτασης της νεφρικής λειτουργίας και των αιματολογικών παραμέτρων κατά τη θεραπεία με το Janumet.
Οι ασθενείς θα πρέπει να ενημερώνονται ότι έχουν αναφερθεί αλλεργικές αντιδράσεις κατά τη διάρκεια της μετά την κυκλοφορία χρήση σιταγλιπτίνης, ενός από τα συστατικά του Janumet. Εάν εμφανιστούν συμπτώματα αλλεργικών αντιδράσεων (συμπεριλαμβανομένου εξανθήματος, κνίδωσης και οίδημα του προσώπου, των χειλέων, της γλώσσας και του προκαλούν δυσκολία στην αναπνοή ή στην κατάποση), οι ασθενείς πρέπει να διακόψουν τη λήψη του Janumet και να ζητήσουν ιατρική συμβουλή ταχέως.
Οι γιατροί πρέπει να ενημερώσουν τους ασθενείς τους να διαβάσουν το ένθετο της συσκευασίας του ασθενούς πριν ξεκινήσουν τη θεραπεία με το Janumet και να ξαναδιαβάσουν κάθε φορά που ανανεώνεται η συνταγή. Οι ασθενείς θα πρέπει να ενημερώνονται για να ενημερώσουν τον γιατρό ή τον φαρμακοποιό τους εάν εμφανίσουν τυχόν ασυνήθιστα συμπτώματα ή εάν κάποιο γνωστό σύμπτωμα επιμένει ή επιδεινώνεται.
Εργαστηριακές δοκιμές
Η ανταπόκριση σε όλες τις διαβητικές θεραπείες θα πρέπει να παρακολουθείται με περιοδικές μετρήσεις των επιπέδων γλυκόζης αίματος και A1C, με στόχο τη μείωση αυτών των επιπέδων προς το φυσιολογικό εύρος. Το A1C είναι ιδιαίτερα χρήσιμο για την αξιολόγηση μακροπρόθεσμου γλυκαιμικού ελέγχου.
Αρχική και περιοδική παρακολούθηση των αιματολογικών παραμέτρων (π.χ. αιμοσφαιρίνη / αιματοκρίτης και ερυθρό αίμα κυτταρικοί δείκτες) και τη νεφρική λειτουργία (κρεατινίνη ορού), τουλάχιστον σε ετήσια βάση. Ενώ η σπανιότατα παρατηρήθηκε μεγαλοβλαστική αναιμία με τη θεραπεία με μετφορμίνη, αν υπάρχει υποψία, η ανεπάρκεια βιταμίνης Β12 πρέπει να αποκλειστεί.
Διανεμήθηκαν από:
MERCK & CO., INC., Whitehouse Station, NJ 08889, USA
9794108
Αριθμός ευρεσιτεχνίας ΗΠΑ: 6,699,871
1Αναγνωρισμένο εμπορικό σήμα της MERCK & CO., Inc., Whitehouse Station, New Jersey 08889 USA
2Traemark της MERCK & CO., Inc., Whitehouse Station, New Jersey 08889 USA
Το 3GLUCOPHAGE® είναι καταχωρημένο εμπορικό σήμα της Merck Sante S.A.S, συνεργάτης της Merck KGaA της Darmstadt, Γερμανία.
Άδεια στην εταιρεία Bristol-Myers Squibb.
COPYRIGHT © 2007, 2008 MERCK & CO., Inc.
Ολα τα δικαιώματα διατηρούνται
Εγκεκριμένη από την FDA επισήμανση ασθενούς
Πληροφορίες ασθενούς
Το Janumet® (JAN-you-met)
(σιταγλιπτίνη / μετφορμίνη HCl)
Ταμπλέτες
Διαβάστε τις πληροφορίες για τον ασθενή που συνοδεύουν το Janumet1 προτού αρχίσετε να το παίρνετε και κάθε φορά που ξαναγεμίζετε. Μπορεί να υπάρχουν νέες πληροφορίες. Αυτό το φυλλάδιο δεν αντικαθιστά τον γιατρό σας σχετικά με την ιατρική σας κατάσταση ή τη θεραπεία.
Ποιες είναι οι σημαντικότερες πληροφορίες που πρέπει να γνωρίζω για τον Janumet;
Η υδροχλωρική μετφορμίνη, ένα από τα συστατικά του Janumet, μπορεί να προκαλέσει μια σπάνια αλλά σοβαρή παρενέργεια που ονομάζεται γαλακτική οξέωση (συσσώρευση γαλακτικού οξέος στο αίμα) που μπορεί να προκαλέσει θάνατο. Η γαλακτική οξέωση αποτελεί επείγουσα ιατρική περίθαλψη και πρέπει να αντιμετωπίζεται σε νοσοκομείο.
Σταματήστε να παίρνετε το Janumet και καλέστε αμέσως το γιατρό σας εάν εμφανίσετε οποιοδήποτε από τα ακόλουθα συμπτώματα γαλακτικής οξέωσης:
- Νιώθεις πολύ αδύναμος και κουρασμένος.
- Έχετε ασυνήθιστο (όχι κανονικό) πόνο στους μυς.
- Έχετε δυσκολία στην αναπνοή.
- Έχετε ανεξήγητα προβλήματα στομάχου ή εντέρου με ναυτία και έμετο ή διάρροια.
- Αισθάνεστε κρύο, ειδικά στα χέρια και τα πόδια σας.
- Νιώθεις ζαλάδα ή ζάλη.
- Έχετε αργό ή ακανόνιστο καρδιακό ρυθμό.
Έχετε περισσότερες πιθανότητες να πάρετε γαλακτική οξέωση αν:
- έχουν προβλήματα στα νεφρά.
- έχετε προβλήματα με το ήπαρ.
- έχουν συμφορητική καρδιακή ανεπάρκεια που απαιτεί θεραπεία με φάρμακα.
- πίνετε πολύ αλκοόλ (πολύ συχνά ή βραχυπρόθεσμα «πίνετε»).
- πάρτε αφυδατωμένο (χάνετε μεγάλη ποσότητα σωματικών υγρών). Αυτό μπορεί να συμβεί αν είστε άρρωστοι με πυρετό, έμετο ή διάρροια. Αφυδάτωση μπορεί επίσης να συμβεί όταν ιδρώνετε πολύ με τη δραστηριότητα ή την άσκηση και δεν πίνετε αρκετά υγρά.
- έχουν ορισμένες δοκιμές ακτίνων Χ με ενέσιμες χρωστικές ή παράγοντες αντίθεσης.
- έχουν χειρουργική επέμβαση.
- έχετε καρδιακή προσβολή, σοβαρή λοίμωξη ή εγκεφαλικό επεισόδιο.
- είναι 80 ετών ή μεγαλύτερα και δεν έχουν δοκιμαστεί η λειτουργία των νεφρών σας.
Τι είναι το Janumet;
Τα δισκία Janumet περιέχουν δύο συνταγογραφούμενα φάρμακα, τη σιταγλιπτίνη (JANUVIA ™ 2) και τη μετφορμίνη. Το Janumet μπορεί να χρησιμοποιηθεί μαζί με δίαιτα και άσκηση για τη μείωση του σακχάρου στο αίμα σε ενήλικες ασθενείς με διαβήτη τύπου 2. Ο γιατρός σας θα αποφασίσει εάν το Janumet είναι κατάλληλο για εσάς και θα καθορίσει τον καλύτερο τρόπο για να ξεκινήσετε και να συνεχίσετε να θεραπεύετε τον διαβήτη σας.
Janumet:
- βοηθά στη βελτίωση των επιπέδων ινσουλίνης μετά από γεύμα.
- βοηθά το σώμα να ανταποκριθεί καλύτερα στην ινσουλίνη που κάνει φυσικά.
- μειώνει την ποσότητα ζάχαρης που παράγεται από τον οργανισμό.
- είναι απίθανο να προκαλέσει χαμηλά επίπεδα σακχάρου στο αίμα (υπογλυκαιμία) όταν λαμβάνεται από μόνη της για τη θεραπεία υψηλού σακχάρου στο αίμα.
Το Janumet δεν έχει μελετηθεί σε παιδιά ηλικίας κάτω των 18 ετών.
Το Janumet δεν έχει μελετηθεί με ινσουλίνη, φάρμακο που είναι γνωστό ότι προκαλεί χαμηλά επίπεδα σακχάρου στο αίμα.
Ποιος δεν πρέπει να πάρει το Janumet;
Μην πάρετε το Janumet εάν:
- έχουν διαβήτη τύπου 1.
- έχουν ορισμένα νεφρικά προβλήματα.
- έχουν καταστάσεις που ονομάζονται μεταβολική οξέωση ή διαβητική κετοξέωση (αυξημένες κετόνες στο αίμα ή στα ούρα).
- είχαν αλλεργική αντίδραση στο Janumet ή σε σιταγλιπτίνη (JANUVIA), ένα από τα συστατικά του Janumet.
- πρόκειται να υποβληθούν σε ένεση χρωστικών ουσιών ή μέσων αντίθεσης για μια διαδικασία ακτινογραφίας, η Janumet θα πρέπει να σταματήσει για μικρό χρονικό διάστημα. Συζητήστε με το γιατρό σας πότε να σταματήσετε το Janumet και πότε να ξεκινήσετε ξανά. Βλέπε "Ποιες είναι οι σημαντικότερες πληροφορίες που πρέπει να γνωρίζω για το Janumet;"
Τι πρέπει να πω στο γιατρό μου πριν και κατά τη διάρκεια της θεραπείας με το Janumet;
Ο Janumet μπορεί να μην είναι σωστός για εσάς. Ενημερώστε το γιατρό σας σχετικά με όλες τις ιατρικές σας καταστάσεις, συμπεριλαμβανομένων των εξής:
- έχουν προβλήματα στα νεφρά.
- έχετε προβλήματα με το ήπαρ.
- είχαν αλλεργική αντίδραση στο Janumet ή σε σιταγλιπτίνη (JANUVIA), ένα από τα συστατικά του Janumet.
- έχουν καρδιακά προβλήματα, συμπεριλαμβανομένης της συμφορητικής καρδιακής ανεπάρκειας.
- είναι άνω των 80 ετών. Ασθενείς ηλικίας άνω των 80 ετών δεν πρέπει να λαμβάνουν Janumet εκτός εάν η λειτουργία των νεφρών ελέγχεται και είναι φυσιολογική.
- πίνετε αλκοόλ πολύ (όλο το χρόνο ή βραχυπρόθεσμα "binge" πόσιμο).
- είναι έγκυες ή σκοπεύουν να μείνουν έγκυες. Δεν είναι γνωστό αν το Janumet θα βλάψει το αγέννητο μωρό σας. Εάν είστε έγκυος, μιλήστε με το γιατρό σας σχετικά με τον καλύτερο τρόπο για να ελέγξετε το σάκχαρό σας στο αίμα ενώ είστε έγκυος. Εάν χρησιμοποιείτε το Janumet κατά τη διάρκεια της εγκυμοσύνης, μιλήστε με το γιατρό σας για το πώς μπορείτε να βρίσκεστε στο μητρώο Janumet. Ο τηλεφωνικός αριθμός χωρίς χρέωση για το μητρώο εγκυμοσύνης είναι 1-800-986-8999.
- θηλάζουν ή σκοπεύουν να θηλάσουν. Δεν είναι γνωστό εάν το Janumet θα περάσει στο μητρικό σας γάλα. Συζητήστε με το γιατρό σας σχετικά με τον καλύτερο τρόπο τροφοδοσίας του μωρού σας εάν παίρνετε το Janumet.
Ενημερώστε το γιατρό σας για όλα τα φάρμακα που παίρνετε, συμπεριλαμβανομένων των συνταγογραφούμενων και των μη συνταγογραφούμενων φαρμάκων, των βιταμινών και των συμπληρωμάτων βοτάνων. Το Janumet μπορεί να επηρεάσει πόσο καλά λειτουργούν άλλα φάρμακα και ορισμένα φάρμακα μπορούν να επηρεάσουν πόσο καλά λειτουργεί το Janumet.
Γνωρίστε τα φάρμακα που παίρνετε. Διατηρήστε μια λίστα με τα φάρμακά σας και δείξτε το στον γιατρό και τον φαρμακοποιό σας όταν πάρετε ένα νέο φάρμακο. Συζητήστε με το γιατρό σας προτού ξεκινήσετε οποιοδήποτε νέο φάρμακο.
Πώς πρέπει να πάρω Janumet;
- Ο γιατρός σας θα σας πει πόσα δισκία Janumet πρέπει να παίρνετε και πόσο συχνά πρέπει να τα παίρνετε. Πάρτε το Janumet όπως σας λέει ο γιατρός σας.
- Ο γιατρός σας μπορεί να χρειαστεί να αυξήσει τη δόση σας για να ελέγξει το σάκχαρό σας.
- Ο γιατρός σας μπορεί να συνταγογραφήσει το Janumet μαζί με μια σουλφονυλουρία (άλλο φάρμακο για τη μείωση του σακχάρου στο αίμα). Δείτε "Ποιες είναι οι πιθανές παρενέργειες του Janumet;" για πληροφορίες σχετικά με αυξημένο κίνδυνο χαμηλού σακχάρου στο αίμα.
- Πάρτε το Janumet με γεύματα για να μειώσετε την πιθανότητα εμφάνισης ενός στομαχιού.
- Συνεχίστε να παίρνετε το Janumet όσο σας λέει ο γιατρός σας.
- Εάν πάρετε πάρα πολύ Janumet, καλέστε αμέσως το γιατρό σας ή το κέντρο ελέγχου δηλητηριάσεων.
- Εάν παραλείψετε μια δόση, πάρτε την με το φαγητό μόλις το θυμηθείτε. Αν δεν θυμάστε μέχρι να έρθει η ώρα για την επόμενη δόση, παραλείψτε τη χαμένη δόση και επιστρέψτε στο κανονικό σας πρόγραμμα. Μην πάρετε ταυτόχρονα δύο δόσεις του Janumet.
- Μπορεί να χρειαστεί να διακόψετε τη λήψη του Janumet για μικρό χρονικό διάστημα. Επικοινωνήστε με το γιατρό σας εάν:
- αφυδατώνονται (έχουν χάσει πάρα πολύ σωματικό υγρό). Η αφυδάτωση μπορεί να συμβεί εάν είστε άρρωστοι με σοβαρό εμετό, διάρροια ή πυρετό ή εάν πίνετε πολύ λιγότερο ρευστό από το κανονικό.
- σχέδιο για χειρουργική επέμβαση.
- πρόκειται να λάβουν μια ένεση βαφής ή παράγοντα αντίθεσης για μια διαδικασία ακτινογραφίας.
Βλέπε "Ποιες είναι οι σημαντικότερες πληροφορίες που πρέπει να γνωρίζω για το Janumet;" και "Ποιος δεν πρέπει να πάρει Janumet;"
- Όταν το σώμα σας είναι υπό ορισμένους τύπους στρες, όπως πυρετός, τραύμα (όπως ατύχημα στο αυτοκίνητο), λοίμωξη ή χειρουργική επέμβαση, η ποσότητα του φαρμάκου για διαβήτη που χρειάζεστε μπορεί να αλλάξει. Ενημερώστε αμέσως το γιατρό σας εάν έχετε κάποια από τις παραπάνω καταστάσεις και ακολουθήστε τις οδηγίες του γιατρού σας.
- Παρακολουθήστε το σάκχαρό σας στο αίμα όπως σας λέει ο γιατρός σας.
- Μείνετε στο συνταγογραφούμενο πρόγραμμα διατροφής και άσκησης ενώ παίρνετε το Janumet.
- Συζητήστε με το γιατρό σας σχετικά με τον τρόπο πρόληψης, αναγνώρισης και διαχείρισης χαμηλού σακχάρου στο αίμα (υπογλυκαιμία), υψηλού σακχάρου στο αίμα (υπεργλυκαιμία) και επιπλοκών του διαβήτη.
- Ο γιατρός σας θα παρακολουθεί τον διαβήτη σας με τακτικές εξετάσεις αίματος, συμπεριλαμβανομένων των επιπέδων σακχάρου στο αίμα σας και της αιμοσφαιρίνης σας A1C.
- Ο γιατρός σας θα κάνει εξετάσεις αίματος για να ελέγξει τη νεφρική σας λειτουργία πριν και κατά τη διάρκεια της θεραπείας με το Janumet.
Ποιες είναι οι πιθανές παρενέργειες του Janumet;
Το Janumet μπορεί να προκαλέσει σοβαρές παρενέργειες. Βλέπε "Ποιες είναι οι σημαντικότερες πληροφορίες που πρέπει να γνωρίζω για το Janumet;"
Συχνές ανεπιθύμητες ενέργειες κατά τη λήψη του Janumet περιλαμβάνουν:
- βουλωμένη μύτη και πονόλαιμο
- λοίμωξη του ανώτερου αναπνευστικού
- διάρροια
- ναυτία και έμετος
- αέρια, δυσφορία στο στομάχι, δυσπεψία
- αδυναμία
- πονοκέφαλο
Η λήψη του Janumet με τα γεύματα μπορεί να συμβάλει στη μείωση των κοινών παρενεργειών του μετφορμίνη στο στομάχι που συμβαίνουν συνήθως στην αρχή της θεραπείας. Εάν έχετε ασυνήθιστα ή απροσδόκητα προβλήματα στο στομάχι, μιλήστε με το γιατρό σας. Τα προβλήματα στο στομάχι που αρχίζουν αργότερα κατά τη διάρκεια της θεραπείας μπορεί να είναι ένα σημάδι κάτι πιο σοβαρό.
Ορισμένα φάρμακα για διαβήτη, όπως σουλφονυλουρίες και μεγλιτινίδια, μπορούν να προκαλέσουν χαμηλά επίπεδα σακχάρου στο αίμα (υπογλυκαιμία). Όταν το Janumet χρησιμοποιείται με αυτά τα φάρμακα, ενδέχεται να έχετε πολύ χαμηλά επίπεδα σακχάρων στο αίμα. Ο γιατρός σας μπορεί να συνταγογραφήσει χαμηλότερες δόσεις φαρμάκου σουλφονυλουρίας ή μεγλιτινίνης. Ενημερώστε το γιατρό σας εάν αντιμετωπίζετε προβλήματα με χαμηλά επίπεδα σακχάρου στο αίμα.
Οι ακόλουθες πρόσθετες ανεπιθύμητες ενέργειες έχουν αναφερθεί σε γενική χρήση με το Janumet ή τη σιταγλιπτίνη:
- Σοβαρές αλλεργικές αντιδράσεις μπορεί να συμβούν με το Janumet ή τη σιταγλιπτίνη, ένα από τα φάρμακα στο Janumet. Τα συμπτώματα μιας σοβαρής αλλεργικής αντίδρασης μπορεί να περιλαμβάνουν εξάνθημα, κνίδωση και πρήξιμο του προσώπου, των χειλιών, της γλώσσας και του λαιμού, δυσκολία στην αναπνοή ή στην κατάποση. Εάν έχετε αλλεργική αντίδραση, διακόψτε τη λήψη του Janumet και καλέστε αμέσως το γιατρό σας. Ο γιατρός σας μπορεί να συνταγογραφήσει ένα φάρμακο για τη θεραπεία της αλλεργικής αντίδρασης και ένα διαφορετικό φάρμακο για τον διαβήτη σας.
- Αυξημένα ηπατικά ένζυμα.
- Φλεγμονή του παγκρέατος.
Αυτές δεν είναι όλες οι πιθανές παρενέργειες του Janumet. Για περισσότερες πληροφορίες, ρωτήστε το γιατρό σας.
Ενημερώστε το γιατρό σας εάν έχετε κάποια παρενέργεια που σας ενοχλεί, είναι ασυνήθιστη ή δεν πάει μακριά.
Πώς πρέπει να αποθηκεύσω το Janumet;
Φυλάσσετε Janumet σε θερμοκρασία δωματίου, 68-77 ° F (20-25 ° C).
Κρατήστε το Janumet και όλα τα φάρμακα μακριά από παιδιά.
Γενικές πληροφορίες σχετικά με τη χρήση του Janumet
Τα φάρμακα μερικές φορές συνταγογραφούνται για καταστάσεις που δεν αναφέρονται στα ενημερωτικά φυλλάδια ασθενών. Μη χρησιμοποιείτε το Janumet για μια κατάσταση για την οποία δεν έχει συνταγογραφηθεί. Μην πάρετε το Janumet σε άλλα άτομα, ακόμη και αν έχουν τα ίδια συμπτώματα που έχετε. Μπορεί να τους βλάψει.
Αυτό το φυλλάδιο συνοψίζει τις πιο σημαντικές πληροφορίες σχετικά με το Janumet. Εάν θέλετε να μάθετε περισσότερες πληροφορίες, μιλήστε με το γιατρό σας. Μπορείτε να ρωτήσετε τον γιατρό ή τον φαρμακοποιό σας για πληροφορίες σχετικά με το Janumet που είναι γραμμένες για επαγγελματίες υγείας. Για περισσότερες πληροφορίες καλέστε στο 1-800-622-4477.
Ποια είναι τα συστατικά του Janumet;
Δραστικά συστατικά: σιταγλιπτίνη και υδροχλωρική μετφορμίνη.
Ανενεργά συστατικά: μικροκρυσταλλική κυτταρίνη, πολυβινυλοπυρρολιδόνη, λαουρυλοθειικό νάτριο και στεατυλοφουμαρικό νάτριο. Η επικάλυψη μεμβράνης δισκίου περιέχει τα ακόλουθα αδρανή συστατικά: πολυβινυλική αλκοόλη, πολυαιθυλενογλυκόλη, τάλκη, διοξείδιο του τιτανίου, κόκκινο οξείδιο του σιδήρου και μαύρο οξείδιο του σιδήρου.
Τι είναι ο διαβήτης τύπου 2;
Ο διαβήτης τύπου 2 είναι μια κατάσταση στην οποία το σώμα σας δεν παράγει αρκετή ινσουλίνη και η ινσουλίνη που παράγει το σώμα σας δεν λειτουργεί τόσο καλά όπως πρέπει. Το σώμα σας μπορεί επίσης να κάνει υπερβολική ζάχαρη. Όταν συμβεί αυτό, η ζάχαρη (γλυκόζη) συσσωρεύεται στο αίμα. Αυτό μπορεί να οδηγήσει σε σοβαρά ιατρικά προβλήματα.
Ο κύριος στόχος της θεραπείας του διαβήτη είναι να μειώσετε το σάκχαρό σας στο φυσιολογικό επίπεδο. Η μείωση και ο έλεγχος του σακχάρου στο αίμα μπορεί να βοηθήσει στην πρόληψη ή την καθυστέρηση των επιπλοκών του διαβήτη, όπως καρδιακά προβλήματα, νεφρικά προβλήματα, τύφλωση και ακρωτηριασμός.
Τα υψηλά επίπεδα σακχάρου στο αίμα μπορούν να μειωθούν με δίαιτα και άσκηση και με ορισμένα φάρμακα όταν είναι απαραίτητο.
Εκδόθηκε τον Μάρτιο του 2009
Διανεμήθηκαν από:
MERCK & CO., INC., Whitehouse Station, NJ 08889, USA
Τελευταία ενημέρωση: 03/09
Janumet, σιταγλιπτίνη και υδροχλωρική μετφορμίνη, πληροφορίες για τους ασθενείς (στην απλή αγγλική γλώσσα)
Λεπτομερείς πληροφορίες για σημεία, συμπτώματα, αιτίες, θεραπείες διαβήτη
Οι πληροφορίες σε αυτή τη μονογραφία δεν προορίζονται να καλύψουν όλες τις πιθανές χρήσεις, οδηγίες, προφυλάξεις, αλληλεπιδράσεις φαρμάκων ή ανεπιθύμητες ενέργειες. Αυτές οι πληροφορίες είναι γενικευμένες και δεν προορίζονται ως συγκεκριμένες ιατρικές συμβουλές. Εάν έχετε απορίες σχετικά με τα φάρμακα που παίρνετε ή θέλετε περισσότερες πληροφορίες, επικοινωνήστε με το γιατρό σας, το φαρμακοποιό ή τη νοσοκόμα σας.
πίσω στο: Περιηγηθείτε σε όλα τα φάρμακα για τον διαβήτη

