Namenda: Η φαρμακευτική αγωγή του Αλτσχάιμερ
Το Namenda είναι ένα φάρμακο που χρησιμοποιείται στη θεραπεία της νόσου του Alzheimer. Λεπτομερείς πληροφορίες σχετικά με τη χρήση, τη δοσολογία, τις παρενέργειες του Namenda.
Εμπορικό σήμα: Namenda
Γενικό όνομα: υδροχλωρική μεμαντίνη
Το Namenda (υδροχλωρική μεμαντίνη) είναι φάρμακο που χρησιμοποιείται στη θεραπεία της νόσου του Alzheimer. Λεπτομερείς πληροφορίες σχετικά με τις χρήσεις, τη δοσολογία και τις παρενέργειες του Namenda παρακάτω.
Περιεχόμενα:
Περιγραφή
Φαρμακολογία
Ενδείξεις και χρήση
Αντενδείξεις
Προφυλάξεις
Αλληλεπιδράσεις με άλλα φάρμακα
Ανεπιθύμητες ενέργειες
Υπερβολική δόση
Δοσολογία
Παρέχεται
Οδηγίες για τον ασθενή
Πληροφορίες για τον ασθενή της Namenda (στην απλή αγγλική γλώσσα)
Περιγραφή
Το Namenda® (υδροχλωρική μεμαντίνη) είναι ένας από του στόματος δραστικός ανταγωνιστής υποδοχέα ΝΜϋΑ. Η χημική ονομασία για τη υδροχλωρική μεμαντίνη είναι το υδροχλωρικό 1-αμινο-3,5-διμεθυλαδαμαντάνιο με τον ακόλουθο συντακτικό τύπο:
Πηγή: δασικά εργαστήρια, διανομέας των ΗΠΑ ή Namenda.
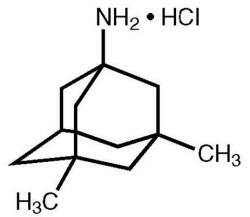
Ο μοριακός τύπος είναι C12H21N-HCl και το μοριακό βάρος είναι 215,76.
Το Memantine HCl εμφανίζεται ως μια λεπτή λευκή έως υπόλευκη σκόνη και είναι διαλυτή στο νερό. Το Namenda διατίθεται ως δισκία ή ως πόσιμο διάλυμα. Το Namenda είναι διαθέσιμο για στοματική χορήγηση ως επικαλυμμένα με λεπτό υμένιο δισκία που περιέχουν 5 mg και 10 mg υδροχλωρικής μεμαντίνης. Τα δισκία περιέχουν επίσης τα ακόλουθα μη δραστικά συστατικά: μικροκρυσταλλική κυτταρίνη, μονοϋδρική λακτόζη, κολλοειδές διοξείδιο πυριτίου, τάλκη και στεατικό μαγνήσιο. Επιπλέον, τα ακόλουθα αδρανή συστατικά είναι επίσης παρόντα ως συστατικά του επικαλύμματος μεμβράνης: υπρομελλόζη, τριακετίνη, διοξείδιο του τιτανίου, FD & C κίτρινο # 6 και FD & C μπλε # 2 (δισκία 5 mg), μαύρο οξείδιο σιδήρου (δισκία 10 mg). Το πόσιμο διάλυμα Namenda περιέχει υδροχλωρική μεμαντίνη σε ισχύ ισοδύναμη με 2 mg υδροχλωρικής μεμαντίνης σε κάθε mL. Το πόσιμο διάλυμα περιέχει επίσης τα ακόλουθα ανενεργά συστατικά: διάλυμα σορβιτόλης (70%), μεθυλοπαραβένιο, προπυλοπαραβένιο, προπυλενογλυκόλη, γλυκερίνη, φυσική γεύση μέντας # 104, κιτρικό οξύ, κιτρικό νάτριο και καθαρισμένο νερό.
Κλινική Φαρμακολογία
Μηχανισμός δράσης και φαρμακοδυναμική
Συνεχής ενεργοποίηση υποδοχέων Ν-μεθυλο-ϋ-ασπαρτικού (NMDA) κεντρικού νευρικού συστήματος από τον το γλουταμινικό διεγερτικό αμινοξύ έχει υποτεθεί ότι συμβάλλει στη συμπτωματολογία του Η ασθένεια Αλτσχάϊμερ. Η μεμαντίνη υποτίθεται ότι ασκεί το θεραπευτικό της αποτέλεσμα μέσω της δράσης της ως χαμηλής έως μέτριας συγγένειας μη ανταγωνιζόμενο (ανοιχτού καναλιού) ανταγωνιστή υποδοχέα ΝΜϋΑ, ο οποίος δεσμεύεται κατά προτίμηση με τη λειτουργία του υποδοχέα ΝΜϋΑ κανάλια κατιόντων. Δεν υπάρχουν ενδείξεις ότι η μεμαντίνη προλαμβάνει ή επιβραδύνει τον νευροεκφυλισμό σε ασθενείς με νόσο του Alzheimer.
Η μεμαντίνη έδειξε χαμηλή έως αμελητέα συνάφεια για υποδοχείς GABA, βενζοδιαζεπίνης, ντοπαμίνης, αδρενεργικού, ισταμίνης και γλυκίνης και για διαύλους Ca2 +, Na + ή Κ + που εξαρτώνται από την τάση. Η μεμαντίνη έδειξε επίσης ανταγωνιστικές επιδράσεις στον υποδοχέα 5ΗΤ3 με ισχύ παρόμοια με εκείνη της του υποδοχέα NMDA και παρεμπόδιζαν τους υποδοχείς νικοτινικής ακετυλοχολίνης με ένα έκτο έως ένα δέκατο των υποδοχέων ακετυλοχολίνης δραστικότητα.
Μελέτες in vitro έδειξαν ότι η μεμαντίνη δεν επηρεάζει την αναστρέψιμη αναστολή της ακετυλοχολινεστεράσης από το ντονεπεζίλη, τη γαλανταμίνη ή την τακρίνη.
Φαρμακοκινητική
Η μεμαντίνη απορροφάται καλά μετά από χορήγηση από το στόμα και έχει γραμμική φαρμακοκινητική σε σχέση με το εύρος της θεραπευτικής δόσης. Εκκρίνεται κυρίως στα ούρα, αμετάβλητη και έχει τελική ημιζωή αποβολής περίπου 60-80 ώρες.
Απορρόφηση και διανομή
Μετά από χορήγηση από το στόμα, η μεμαντίνη απορροφάται έντονα με συγκεντρώσεις κορυφής που επιτυγχάνονται σε περίπου 3-7 ώρες. Η τροφή δεν έχει καμία επίδραση στην απορρόφηση της μεμαντίνης. Ο μέσος όγκος κατανομής της μεμαντίνης είναι 9-11 L / kg και η δέσμευση πρωτεΐνης πλάσματος είναι χαμηλή (45%).
Μεταβολισμός και Εξάλειψη
Το Memantine υφίσταται μερικό ηπατικό μεταβολισμό. Περίπου το 48% του χορηγούμενου φαρμάκου απεκκρίνεται αμετάβλητο στα ούρα. το υπόλοιπο μετατρέπεται κυρίως σε τρεις πολικούς μεταβολίτες που διαθέτουν ελάχιστο υποδοχέα NMDA ανταγωνιστική δραστικότητα: το σύζευγμα Ν-γλυκουρονιδίου, η 6-υδροξυμεμαντίνη και το 1-νιτροζο-αποαμινωμένο memantine. Ένα σύνολο 74% της χορηγούμενης δόσης απεκκρίνεται ως το άθροισμα του μητρικού φαρμάκου και του συζεύγματος Ν-γλυκουρονιδίου. Το ηπατικό μικροσωματικό σύστημα ενζύμου CYP450 δεν παίζει σημαντικό ρόλο στον μεταβολισμό της μεμαντίνης. Το Memantine έχει τελικό χρόνο ημίσειας ζωής αποβολής περίπου 60-80 ώρες. Η νεφρική κάθαρση περιλαμβάνει ενεργή σωληναριακή έκκριση που μετριάζεται με σωληναριακή επαναρρόφηση εξαρτώμενη από το ρΗ.
Ειδικοί πληθυσμοί
Νεφρική δυσλειτουργία: Η φαρμακοκινητική της μεμαντίνης αξιολογήθηκε μετά από εφάπαξ από του στόματος χορήγηση 20 mg μεμαντίνης HCl σε 8 άτομα με ήπια νεφρική δυσλειτουργία (κάθαρση κρεατινίνης, CLcr,> 50 - 80 mL / min), 8 άτομα με μέτρια νεφρική δυσλειτουργία (CLcr 30-49 mL / min), 7 άτομα με σοβαρή νεφρική δυσλειτουργία (CLcr 5 - 29 mL / min) και 8 υγιή άτομα (CLcr> 80 mL / min) ταιριάζουν όσο το δυνατόν πιο κοντά στην ηλικία, το βάρος και το φύλο στα άτομα με νεφρική βλάβη. Η μέση AUC 0- (άπειρο) αυξήθηκε κατά 4%, 60% και 115% σε άτομα με ήπια, μέτρια και σοβαρή νεφρική δυσλειτουργία, αντίστοιχα, σε σύγκριση με υγιή άτομα. Ο τελικός χρόνος ημιζωής αποβολής αυξήθηκε κατά 18%, 41% και 95% σε άτομα με ήπια, μέτρια και σοβαρή νεφρική δυσλειτουργία, αντίστοιχα, σε σύγκριση με υγιή άτομα.
Δεν συνιστάται προσαρμογή της δοσολογίας σε ασθενείς με ήπια και μέτρια νεφρική δυσλειτουργία. Η δοσολογία θα πρέπει να μειώνεται σε ασθενείς με σοβαρή νεφρική δυσλειτουργία (Βλέπε ΔΟΣΟΛΟΓΙΑ ΚΑΙ ΧΟΡΗΓΗΣΗ).
Ηλικιωμένος: Η φαρμακοκινητική του Namenda σε νέους και ηλικιωμένους ασθενείς είναι παρόμοια.
Γένος: Μετά τη χορήγηση πολλαπλών δόσεων του Namenda 20 mg b.i.d., οι γυναίκες είχαν περίπου 45% υψηλότερη έκθεση από τους άνδρες, αλλά δεν παρατηρήθηκε διαφορά στην έκθεση όταν ελήφθη υπόψη το σωματικό βάρος.
Αλληλεπιδράσεις φαρμάκων-φαρμάκων
Υποστρώματα μικροσωματικών ενζύμων: Μελέτες in vitro έδειξαν ότι στις συγκεντρώσεις που υπερβαίνουν αυτές που συνδέονται με την αποτελεσματικότητα, η μεμαντίνη δεν επάγει τα ισοένζυμα CYP1A2, CYP2C9, CYP2E1 και CYP3A4 / 5 του κυτοχρώματος P450. Επιπλέον, μελέτες in vitro έδειξαν ότι η μεμαντίνη παράγει ελάχιστη αναστολή των ενζύμων CYP4A4, CYP2A6, CYP2C9, CYP2D6, CYP2E1 και CYP3A4. Αυτά τα δεδομένα υποδεικνύουν ότι δεν αναμένονται φαρμακοκινητικές αλληλεπιδράσεις με φάρμακα που μεταβολίζονται από αυτά τα ένζυμα.
Αναστολείς Μικροσωμικών Ενζύμων: Δεδομένου ότι η μεμαντίνη υφίσταται ελάχιστο μεταβολισμό, καθώς η πλειονότητα της δόσης απεκκρίνεται αμετάβλητη στα ούρα, είναι απίθανο να υπάρξει αλληλεπίδραση μεταξύ της μεμαντίνης και των φαρμάκων που είναι αναστολείς των ενζύμων του CYP450. Η συγχορήγηση του Namenda με τον αναστολέα AChE donepezil HCl δεν επηρεάζει τη φαρμακοκινητική της κάθε ένωσης.
Φάρμακα που εξαλείφονται μέσω των νεφρικών μηχανισμών: Η μεμαντίνη εξαλείφεται εν μέρει με σωληναριακή έκκριση. Μελέτες in vivo έδειξαν ότι πολλαπλές δόσεις της διουρητικής υδροχλωροθειαζίδης / τριαμτερένης (HCTZ / TA) δεν επηρέασαν την AUC της μεμαντίνης σε σταθερή κατάσταση. Η μεμαντίνη δεν επηρέασε τη βιοδιαθεσιμότητα του ΤΑ και μειώθηκε η AUC και η C max του HCTZ κατά περίπου 20%. Η συγχορήγηση μεμαντίνης με το αντιυπεργλυκαιμικό φάρμακο Glucovance® (γλυβουρίδη και μετφορμίνη HCl) δεν επηρέασε τη φαρμακοκινητική της μεμαντίνης, της μετφορμίνης και της γλυβουρίδης. Η μεμαντίνη δεν τροποποίησε τις επιδράσεις της γλυκόζης στον ορό του Glucovance®, υποδεικνύοντας την απουσία φαρμακοδυναμικής αλληλεπίδρασης.
Φάρμακα που καθιστούν τα ούρα αλκαλικά: Η κάθαρση της μεμαντίνης μειώθηκε κατά περίπου 80% υπό συνθήκες αλκαλικών ούρων σε ρΗ 8. Συνεπώς, μεταβολές του ρΗ ούρων προς την αλκαλική κατάσταση μπορεί να οδηγήσουν σε συσσώρευση του φαρμάκου με πιθανή αύξηση των ανεπιθύμητων ενεργειών. Τα φάρμακα που αλκανοποιούν τα ούρα (π.χ. αναστολείς της καρβονικής ανυδράσης, όξινο ανθρακικό νάτριο) αναμένεται να μειώσουν τη νεφρική απομάκρυνση της μεμαντίνης.
Φάρμακα υψηλά συνδεδεμένα με τις πρωτεΐνες του πλάσματος: Επειδή η πρόσδεση της μεμαντίνης στο πλάσμα είναι χαμηλή (45%), είναι απίθανο να υπάρξει αλληλεπίδραση με φάρμακα που συνδέονται σε μεγάλο βαθμό με τις πρωτεΐνες του πλάσματος, όπως η βαρφαρίνη και η διγοξίνη.
ΚΛΙΝΙΚΕΣ ΔΟΚΙΜΕΣ
Η αποτελεσματικότητα του Namenda (υδροχλωρική μεμαντίνη) ως θεραπεία για ασθενείς με μέτρια έως σοβαρή νόσο του Αλτσχάιμερ αποδείχθηκε σε 2 τυχαιοποιημένες, διπλά τυφλές, ελεγχόμενες με εικονικό φάρμακο κλινικές μελέτες (μελέτες 1 και 2) που διεξήχθησαν στις Ηνωμένες Πολιτείες οι οποίες αξιολόγησαν τόσο τη γνωστική λειτουργία όσο και την καθημερινή λειτουργία. Η μέση ηλικία των ασθενών που συμμετείχαν σε αυτές τις δύο δοκιμές ήταν 76 με εύρος 50-93 ετών. Περίπου το 66% των ασθενών ήταν γυναίκες και το 91% των ασθενών ήταν καυκάσιοι.
Μια τρίτη μελέτη (Μελέτη 3), που διεξήχθη στη Λετονία, περιέλαβε ασθενείς με σοβαρή άνοια, αλλά δεν αξιολόγησε τη γνωστική λειτουργία ως προγραμματισμένο τελικό σημείο.
Μελέτες για τα αποτελέσματα της μελέτης: Σε κάθε μελέτη των Η.Π.Α., προσδιορίστηκε η αποτελεσματικότητα του Namenda χρησιμοποιώντας και ένα όργανο με σκοπό την αξιολόγηση της συνολικής λειτουργίας μέσω της αξιολόγησης που σχετίζεται με τον πάροχο και ενός μέσου που μετρά γνωστική λειτουργία. Και οι δύο μελέτες έδειξαν ότι οι ασθενείς στο Namenda παρουσίασαν σημαντική βελτίωση και από τα δύο μέτρα σε σύγκριση με το εικονικό φάρμακο.
Η καθημερινή λειτουργία αξιολογήθηκε και στις δύο μελέτες με τη χρήση της τροποποιημένης συλλογικής μελέτης για τη νόσο του Αλτσχάιμερ - Δραστηριότητες ημερήσιας απογραφής (ADCS-ADL). Το ADCS-ADL αποτελείται από μια ολοκληρωμένη σειρά ερωτήσεων ADL που χρησιμοποιούνται για τη μέτρηση των λειτουργικών ικανοτήτων των ασθενών. Κάθε στοιχείο ADL βαθμολογείται από το υψηλότερο επίπεδο ανεξάρτητης απόδοσης έως την πλήρη απώλεια. Ο ερευνητής εκτελεί τον κατάλογο με τη συνέντευξη ενός φροντιστή εξοικειωμένου με τη συμπεριφορά του ασθενούς. Ένα υποσύνολο 19 αντικειμένων, συμπεριλαμβανομένων αξιολογήσεων της ικανότητας του ασθενούς να τρώει, να ντύνεται, να λούζει, να τηλεφωνεί, να ταξιδεύει, να ψωνίζει, και την εκτέλεση άλλων οικιακών εργασιών έχει επικυρωθεί για την αξιολόγηση των ασθενών με μέτρια έως σοβαρή άνοια. Αυτό είναι το τροποποιημένο ADCS-ADL, το οποίο έχει ένα εύρος βαθμολόγησης από 0 έως 54, με τις χαμηλότερες βαθμολογίες να δείχνουν μεγαλύτερη λειτουργική εξασθένηση.
Η ικανότητα του Namenda για τη βελτίωση των γνωστικών επιδόσεων αξιολογήθηκε και στις δύο μελέτες με τη Σοβαρή Βλάβη (SIB), μια πολλαπλών οργάνων που έχει επικυρωθεί για την αξιολόγηση της γνωστικής λειτουργίας σε ασθενείς με μέτρια έως σοβαρή πάθηση άνοια. Το SIB εξετάζει επιλεγμένες πτυχές της γνωστικής απόδοσης, συμπεριλαμβανομένων στοιχείων προσοχής, προσανατολισμού, γλώσσας, μνήμης, οπτικοακουστικής ικανότητας, κατασκευής, πρακτικής και κοινωνικής αλληλεπίδρασης. Η κλίμακα βαθμολόγησης SIB είναι από 0 έως 100, με χαμηλότερες βαθμολογίες που δείχνουν μεγαλύτερη γνωστική εξασθένηση.
Μελέτη 1 (Μελέτη είκοσι οκτώ εβδομάδων)
Σε μια μελέτη διάρκειας 28 εβδομάδων, 252 ασθενείς με μέτρια έως σοβαρή πιθανή νόσο του Αλτσχάιμερ (διαγνωσμένες με DSM-IV και NINCDS-ADRDA με βαθμολογίες Mini-Mental State Examination> / = 3 και! - = 14 και Στάδια Κλίμακας Παγκόσμιας Φθοράς 5-6) τυχαιοποιήθηκαν σε Namenda ή εικονικό φάρμακο. Για τους ασθενείς που τυχαιοποιήθηκαν στο Namenda, η θεραπεία ξεκίνησε στα 5 mg μία φορά την ημέρα και αυξήθηκε εβδομαδιαίως κατά 5 mg / ημέρα σε διηρημένες δόσεις σε δόση 20 mg / ημέρα (10 mg δύο φορές την ημέρα).
Επιδράσεις στο ADCS-ADL:
Το σχήμα 1 δείχνει τη χρονική πορεία της αλλαγής από την αρχική τιμή της βαθμολογίας ADCS-ADL για τους ασθενείς στις δύο ομάδες θεραπείας που συμπληρώνουν τις 28 εβδομάδες της μελέτης. Στις 28 εβδομάδες θεραπείας, η μέση διαφορά στις βαθμολογίες αλλαγών ADCS-ADL για τους ασθενείς που έλαβαν θεραπεία με Namenda σε σύγκριση με τους ασθενείς που έλαβαν εικονικό φάρμακο ήταν 3,4 μονάδες. Με τη χρήση μιας ανάλυσης βασισμένης σε όλους τους ασθενείς και με την τελευταία παρατήρηση της μελέτης τους (ανάλυση LOCF), η θεραπεία με Namenda ήταν στατιστικά σημαντικά ανώτερη από το εικονικό φάρμακο.
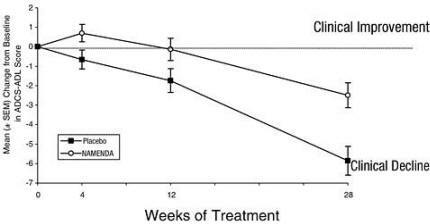
Σχήμα 1: Χρονική πορεία της μεταβολής από την αρχική τιμή της βαθμολογίας ADCS-ADL σε ασθενείς που ολοκλήρωσαν 28 εβδομάδες θεραπείας.
Το Σχήμα 2 δείχνει τα σωρευτικά ποσοστά ασθενών από καθεμία από τις ομάδες θεραπείας που είχαν επιτύχει τουλάχιστον την αλλαγή στο ADCS-ADL που εμφανίζεται στον άξονα Χ.
Οι καμπύλες δείχνουν ότι και οι δύο ασθενείς που έχουν ανατεθεί στο Namenda και το εικονικό φάρμακο έχουν ένα ευρύ φάσμα απαντήσεων και γενικά παρουσιάζουν αλλοίωση (α αρνητική μεταβολή στο ADCS-ADL σε σύγκριση με την αρχική τιμή), αλλά ότι ο όμιλος Namenda είναι πιο πιθανό να παρουσιάσει μικρότερη μείωση ή βελτίωση. (Σε μια σωρευτική απεικόνιση διανομής, μια καμπύλη για μια αποτελεσματική θεραπεία θα μετατοπιστεί προς τα αριστερά της καμπύλης για εικονικό φάρμακο, ενώ μια αναποτελεσματική ή επιβλαβής θεραπεία θα υπερκαλύπτετο ή θα μετατοπίστηκε προς τα δεξιά της καμπύλης για εικονικό φάρμακο.)
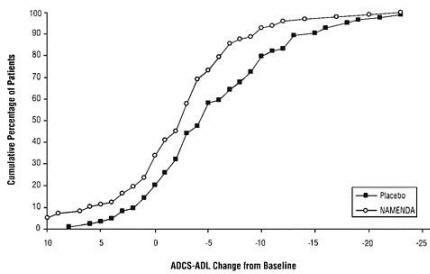
Σχήμα 2: Σωρευτικό ποσοστό των ασθενών που ολοκλήρωσαν 28 εβδομάδες διπλής τυφλής θεραπείας με συγκεκριμένες αλλαγές από την έναρξη της βαθμολογίας ADCS-ADL.
Επιδράσεις στο SIB: Το Σχήμα 3 δείχνει τη χρονική πορεία για τη μεταβολή από τη βασική γραμμή της βαθμολογίας SIB για τις δύο ομάδες θεραπείας κατά τη διάρκεια των 28 εβδομάδων της μελέτης. Στις 28 εβδομάδες θεραπείας, η μέση διαφορά στις βαθμολογίες μεταβολής του SIB για τους ασθενείς που έλαβαν θεραπεία με Namenda σε σύγκριση με τους ασθενείς που έλαβαν εικονικό φάρμακο ήταν 5,7 μονάδες. Χρησιμοποιώντας ανάλυση LOCF, η θεραπεία με το Namenda ήταν στατιστικά σημαντικά ανώτερη από το εικονικό φάρμακο.
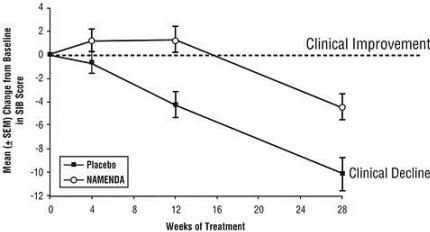
Σχήμα 3: Χρονική πορεία της μεταβολής από τη βασική γραμμή της βαθμολογίας SIB σε ασθενείς που ολοκλήρωσαν 28 εβδομάδες θεραπείας.
Το Σχήμα 4 δείχνει τα σωρευτικά ποσοστά ασθενών από κάθε ομάδα θεραπείας που είχε επιτύχει τουλάχιστον το μέτρο αλλαγής της βαθμολογίας SIB που εμφανίζεται στον άξονα Χ.
Οι καμπύλες δείχνουν ότι και οι δύο ασθενείς που έχουν ανατεθεί στο Namenda και το εικονικό φάρμακο έχουν ένα ευρύ φάσμα απαντήσεων και παρουσιάζουν γενικά επιδείνωση, αλλά ότι ο όμιλος Namenda είναι πιο πιθανό να παρουσιάσει μικρότερη μείωση ή μείωση βελτίωση.

Σχήμα 4: Σωρευτικό ποσοστό των ασθενών που ολοκλήρωσαν 28 εβδομάδες διπλής τυφλής θεραπείας με συγκεκριμένες αλλαγές από την αρχική βαθμολογία στις βαθμολογίες SIB.
Μελέτη 2 (Μελέτη 24 εβδομάδων) Σε μία μελέτη διάρκειας 24 εβδομάδων, 404 ασθενείς με μέτρια έως σοβαρή μορφή πιθανή νόσος του Alzheimer (διαγνωσμένη με κριτήρια NINCDS-ADRDA, με Mini-Mental State Examination βαθμολογίες ≥ 5 και ≤ 14) που είχαν υποβληθεί σε θεραπεία με donepezil για τουλάχιστον 6 μήνες και είχαν λάβει σταθερή δόση το donepezil για τους τελευταίους 3 μήνες ήταν τυχαιοποιημένο στο Namenda ή το εικονικό φάρμακο κατά τη διάρκεια λήψης donepezil. Για τους ασθενείς που τυχαιοποιήθηκαν στο Namenda, η θεραπεία ξεκίνησε στα 5 mg άπαξ ημερησίως και αυξήθηκε εβδομαδιαίως κατά 5 mg / ημέρα σε διηρημένες δόσεις σε δόση 20 mg / ημέρα (10 mg δύο φορές την ημέρα).
Επιδράσεις στο ADCS-ADL: Το Σχήμα 5 δείχνει τη χρονική πορεία για τη μεταβολή από την αρχική τιμή της βαθμολογίας ADCS-ADL για τις δύο ομάδες θεραπείας κατά τη διάρκεια των 24 εβδομάδων της μελέτης. Στις 24 εβδομάδες θεραπείας, η μέση διαφορά στις βαθμολογίες αλλαγής ADCS-ADL για το Namenda / donepezil (θεραπεία συνδυασμού) σε σύγκριση με τους ασθενείς που έλαβαν εικονικό φάρμακο / ντονεπεζίλη (μονοθεραπεία) ήταν 1,6 μονάδες. Χρησιμοποιώντας ανάλυση LOCF, η θεραπεία με Namenda / donepezil ήταν στατιστικά σημαντικά ανώτερη από το εικονικό φάρμακο / donepezil.
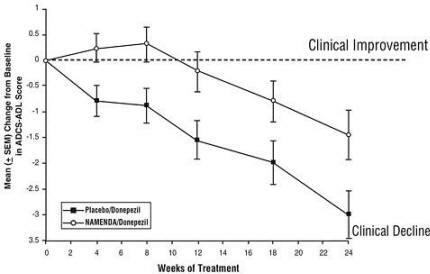
Σχήμα 5: Χρονική πορεία της αλλαγής από την αρχική τιμή της βαθμολογίας ADCS-ADL σε ασθενείς που ολοκλήρωσαν 24 εβδομάδες θεραπείας.
Το Σχήμα 6 δείχνει τα σωρευτικά ποσοστά ασθενών από καθεμία από τις ομάδες θεραπείας που είχαν επιτύχει τουλάχιστον το μέτρο βελτίωσης στο ADCS-ADL που εμφανίζεται στον άξονα Χ.
Οι καμπύλες δείχνουν ότι και οι δύο ασθενείς που έλαβαν το Namenda / donepezil και το εικονικό φάρμακο / donepezil έχουν ένα ευρύ φάσμα απαντήσεων και παρουσιάζουν γενικά επιδείνωση, αλλά ότι η ομάδα Namenda / donepezil είναι πιο πιθανό να παρουσιάσει μικρότερη πτώση ή μείωση βελτίωση.

Σχήμα 6: Σωρευτικό ποσοστό των ασθενών που ολοκλήρωσαν 24 εβδομάδες διπλής τυφλής θεραπείας με συγκεκριμένες αλλαγές από την έναρξη σε βαθμολογίες ADCS-ADL.
Επιδράσεις στο SIB: Το σχήμα 7 δείχνει τη χρονική πορεία για τη μεταβολή από την αρχική τιμή της βαθμολογίας SIB για τις δύο ομάδες θεραπείας κατά τη διάρκεια των 24 εβδομάδων της μελέτης. Στις 24 εβδομάδες θεραπείας, η μέση διαφορά στις βαθμολογίες μεταβολής του SIB για τους ασθενείς που έλαβαν θεραπεία με Namenda / donepezil σε σύγκριση με τους ασθενείς που έλαβαν εικονικό φάρμακο / donepezil ήταν 3,3 μονάδες. Χρησιμοποιώντας ανάλυση LOCF, η θεραπεία με Namenda / donepezil ήταν στατιστικά σημαντικά ανώτερη από το εικονικό φάρμακο / donepezil.

Σχήμα 7: Χρονική πορεία της αλλαγής από τη βασική γραμμή της βαθμολογίας SIB για ασθενείς που ολοκλήρωσαν 24 εβδομάδες θεραπείας.
Το Σχήμα 8 δείχνει τα σωρευτικά ποσοστά ασθενών από κάθε ομάδα θεραπείας που είχαν επιτύχει τουλάχιστον το μέτρο βελτίωσης της βαθμολογίας SIB που εμφανίζεται στον άξονα Χ.
Οι καμπύλες δείχνουν ότι και οι δύο ασθενείς που έλαβαν το Namenda / donepezil και το εικονικό φάρμακο / donepezil έχουν ένα ευρύ φάσμα των απαντήσεων, αλλά ότι η ομάδα Namenda / donepezil είναι πιο πιθανό να παρουσιάσει βελτίωση ή μικρότερη πτώση.
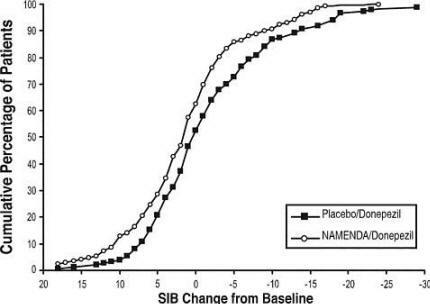
Σχήμα 8: Σωρευτικό ποσοστό των ασθενών που ολοκλήρωσαν 24 εβδομάδες διπλής τυφλής θεραπείας με συγκεκριμένες αλλαγές από τη βασική γραμμή στις βαθμολογίες SIB.
Μελέτη 3 (Μελέτη δώδεκα εβδομάδων) Σε μια διπλή-τυφλή μελέτη διάρκειας 12 εβδομάδων, που διεξήχθη σε νοσηλευτικά σπίτια στη Λετονία, 166 ασθενείς με άνοια σύμφωνα με έως το DSM-ΙΙΙ-R, βαθμολογία εξέτασης Mini-Mental State <10 και κλιμάκωση κλιμάκωσης παγκόσμιας υποβάθμισης 5 έως 7 τυχαιοποιήθηκαν είτε σε Namenda είτε εικονικό φάρμακο. Για τους ασθενείς που τυχαιοποιήθηκαν στο Namenda, η θεραπεία ξεκίνησε στα 5 mg άπαξ ημερησίως και αυξήθηκε στα 10 mg μία φορά ημερησίως μετά από 1 εβδομάδα. Τα βασικά μέτρα για την αποτελεσματικότητα ήταν η υπο-κλίμακα εξάρτησης της περίθαλψης της Κλίμακας Αξιολόγησης Συμπεριφοράς για τους Γηριατρικούς Ασθενείς (BGP), ένα μέτρο της καθημερινής λειτουργίας και μια κλινική παγκόσμια εντύπωση αλλαγής (CGI-C), ένα μέτρο συνολικής κλινικής αποτέλεσμα. Σε αυτή τη μελέτη δεν χρησιμοποιήθηκε κανένα έγκυρο μέτρο γνωστικής λειτουργίας. Μια στατιστικά σημαντική διαφορά θεραπείας στις 12 εβδομάδες που ευνόησε το Namenda έναντι του εικονικού φαρμάκου παρατηρήθηκε και στα δύο κύρια μέτρα αποτελεσματικότητας. Επειδή οι ασθενείς που εισήλθαν ήταν ένα μείγμα της νόσου του Alzheimer και της αγγειακής άνοιας, επιχειρήθηκε να γίνει διάκριση μεταξύ των δύο ομάδων και όλων οι ασθενείς χαρακτηρίστηκαν αργότερα ως έχοντες είτε αγγειακή άνοια είτε ασθένεια Alzheimer, με βάση τις βαθμολογίες τους στην ισχαιμική κλίμακα Hachinski στη μελέτη είσοδος. Μόνο το 50% των ασθενών είχαν ηλεκτρονική τομογραφία του εγκεφάλου. Για το υποσύνολο που χαρακτηρίστηκε ως ασθένεια Alzheimer, παρατηρήθηκε στατιστικά σημαντική επίδραση θεραπείας που ευνοούσε το Namenda έναντι του εικονικού φαρμάκου στις 12 εβδομάδες τόσο στο BGP όσο και στο CGI-C.
Ενδείξεις και χρήση
Το Namenda (υδροχλωρική μεμαντίνη) ενδείκνυται για τη θεραπεία της μέτριας έως σοβαρής άνοιας τύπου Alzheimer.
Αντενδείξεις
Το Namenda (υδροχλωρική μεμαντίνη) αντενδείκνυται σε ασθενείς με γνωστή υπερευαισθησία στη υδροχλωρική μεμαντίνη ή σε οποιοδήποτε έκδοχο που χρησιμοποιείται στη σύνθεση.
Προφυλάξεις
Πληροφορίες για ασθενείς και φροντιστές: Οι φροντιστές πρέπει να ενημερώνονται για τη συνιστώμενη χορήγηση (δύο φορές ημερησίως για δόσεις άνω των 5 mg) και κλιμάκωση της δόσης (ελάχιστο χρονικό διάστημα μιας εβδομάδας μεταξύ των αυξήσεων της δόσης).
Κατασχέσεις Νευρολογικής Κατάστασης:
Το Namenda δεν έχει συστηματικά αξιολογηθεί σε ασθενείς με διαταραχή κρίσης. Σε κλινικές δοκιμές του Namenda, οι επιληπτικές κρίσεις εμφανίστηκαν στο 0,2% των ασθενών που έλαβαν θεραπεία με Namenda και στο 0,5% των ασθενών που έλαβαν εικονικό φάρμακο.
Ουρογενετικές συνθήκες
Οι συνθήκες που αυξάνουν το pH των ούρων μπορεί να μειώσουν την αποβολή της μεμαντίνης από τα ούρα, με αποτέλεσμα την αύξηση των επιπέδων της μεμαντίνης στο πλάσμα.
Ειδικοί πληθυσμοί
Ηπατική ανεπάρκεια
Το Namenda υφίσταται μερικό ηπατικό μεταβολισμό, με περίπου 48% της χορηγούμενης δόσης να απεκκρίνεται στα ούρα ως αμετάβλητο φάρμακο ή ως άθροισμα του μητρικού φαρμάκου και του συζυγούς Ν-γλυκουρονιδίου (74%). Η φαρμακοκινητική της μεμαντίνης σε ασθενείς με ηπατική ανεπάρκεια δεν έχει διερευνηθεί, αλλά αναμένεται να επηρεαστεί ελάχιστα.
Νεφρική δυσλειτουργία
Δεν απαιτείται προσαρμογή της δοσολογίας σε ασθενείς με ήπια ή μέτρια νεφρική δυσλειτουργία. Συνιστάται μείωση της δοσολογίας σε ασθενείς με σοβαρή νεφρική δυσλειτουργία (βλ ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ και ΔΟΣΟΛΟΓΙΑ ΚΑΙ ΧΟΡΗΓΗΣΗ ).
Αλληλεπιδράσεις φαρμάκων-φαρμάκων
Ν-μεθυλ-ϋ-ασπαρτικό (ΝΜϋΑ) ανταγωνιστές: Η συνδυασμένη χρήση του Namenda με άλλους ανταγωνιστές του NMDA (αμανταδίνη, κεταμίνη και δεξτρομεθορφάνη) δεν έχει αξιολογηθεί συστηματικά και η χρήση αυτή πρέπει να προσεγγιστεί με προσοχή.
Επιδράσεις του Namenda σε υποστρώματα μικροσωμικών ενζύμων: Οι μελέτες in vitro που διεξήχθησαν με υποστρώματα ένδειξης των ενζύμων CYP450 (CYP1A2, -2A6, -2C9, -2D6, -2E1, -3A4) έδειξαν ελάχιστη αναστολή αυτών των ενζύμων από memantine. Επιπλέον, in vitro μελέτες δείχνουν ότι στις συγκεντρώσεις που υπερβαίνουν αυτές που σχετίζονται με την αποτελεσματικότητα, η μεμαντίνη δεν επάγει τα ισοένζυμα CYP1A2, CYP2C9, CYP2E1 και CYP3A4 / 5 του κυτοχρώματος P450. Δεν αναμένονται φαρμακοκινητικές αλληλεπιδράσεις με φάρμακα που μεταβολίζονται από αυτά τα ένζυμα.
Επιδράσεις αναστολέων και / ή υποστρωμάτων μικροσωμικών ενζύμων στο Namenda: Η μεμαντίνη εξαλείφεται κυρίως από τα νεφρά, και τα φάρμακα που είναι υποστρώματα ή / και αναστολείς του συστήματος CYP450 δεν αναμένεται να μεταβάλλουν τον μεταβολισμό της μεμαντίνης.
Αναστολείς ακετυλοχολινεστεράσης (AChE): Η συγχορήγηση του Namenda με τον αναστολέα AChE donepezil HCl δεν επηρέασε τη φαρμακοκινητική της κάθε ένωσης. Σε ελεγχόμενη κλινική μελέτη 24 εβδομάδων σε ασθενείς με μέτρια έως σοβαρή νόσο του Alzheimer, οι ανεπιθύμητες το προφίλ συμβάντος που παρατηρήθηκε με συνδυασμό μεμαντίνης και donepezil ήταν παρόμοιο με αυτό του donepezil μόνο.
Τα φάρμακα εξαλείφονται μέσω των νεφρικών μηχανισμών: Επειδή η μεμαντίνη εξαλείφεται εν μέρει με σωληναριακή έκκριση, η συγχορήγηση φαρμάκων που χρησιμοποιούν το ίδιο νεφρικό κατιονικό σύστημα, συμπεριλαμβανομένων η υδροχλωροθειαζίδη (HCTZ), η τριαμτερένη (ΤΑ), η μετφορμίνη, η σιμετιδίνη, η ρανιτιδίνη, η κινιδίνη και η νικοτίνη, θα μπορούσαν ενδεχομένως να οδηγήσουν σε αλλοιωμένα επίπεδα πλάσματος και των δύο παραγόντων. Ωστόσο, η συγχορήγηση του Namenda και του HCTZ / TA δεν επηρέασε τη βιοδιαθεσιμότητα ούτε της memantine ούτε της ΤΑ και η βιοδιαθεσιμότητα του HCTZ μειώθηκε κατά 20%. Επιπλέον, η συγχορήγηση μεμαντίνης με το αντιυπεργλυκαιμικό φάρμακο Glucovance® (γλυβουρίδη και μετφορμίνη HCl) δεν επηρέασε τη φαρμακοκινητική της μεμαντίνης, της μετφορμίνης και της γλυβουρίδης. Επιπλέον, η μεμαντίνη δεν τροποποίησε την επίδραση μείωσης της γλυκόζης στον ορό του Glucovance®.
Φάρμακα που καθιστούν τα ούρα αλκαλικά: Η κάθαρση της μεμαντίνης μειώθηκε κατά περίπου 80% υπό συνθήκες αλκαλικών ούρων σε ρΗ 8. Ως εκ τούτου, αλλοίωση του pH ούρων προς την αλκαλική κατάσταση μπορεί να οδηγήσει σε συσσώρευση του φαρμάκου με πιθανή αύξηση των ανεπιθύμητων ενεργειών. Το pH των ούρων μεταβάλλεται με δίαιτα, φάρμακα (π.χ. αναστολείς καρβονικής ανυδράσης, διττανθρακικό νάτριο) και κλινική κατάσταση του ασθενούς (π.χ., νεφρική σωληναριακή οξέωση ή σοβαρές λοιμώξεις του ουροποιητικού συστήματος). Ως εκ τούτου, η μεμαντίνη πρέπει να χρησιμοποιείται με προσοχή κάτω από αυτές τις συνθήκες.
Καρκινογένεση, μεταλλαξογένεση και βλάβη της γονιμότητας
Δεν υπήρξαν ενδείξεις καρκινογένεσης σε μια από του στόματος μελέτη 113 εβδομάδων σε ποντίκια σε δόσεις έως 40 mg / kg / ημέρα (10 φορές τη μέγιστη συνιστώμενη δόση σε ανθρώπους [MRHD] σε mg / m2). Δεν υπήρξαν επίσης ενδείξεις καρκινογένεσης σε αρουραίους από του στόματος χορηγούμενες έως 40 mg / kg / ημέρα για 71 εβδομάδες ακολουθούμενη από 20 mg / kg / ημέρα (20 και 10 φορές το MRHD σε mg / m2, αντίστοιχα) μέσα σε 128 εβδομάδες.
Η μεμαντίνη δεν παρήγαγε στοιχεία γονοτοξικού δυναμικού όταν αξιολογήθηκε σε in vitro S. typhimurium ή Ε. coli αντίστροφης μετάλλαξης, in vitro δοκιμή χρωμοσωμικής εκτροπής σε ανθρώπινα λεμφοκύτταρα, in vivo κυτταρογενετική δοκιμασία για βλάβη χρωμοσωμάτων σε αρουραίους και in vivo προσδιορισμό μικροπυρήνων ποντικού. Τα αποτελέσματα ήταν αμφίβολα σε έναν in vitro προσδιορισμό γονιδιακής μετάλλαξης χρησιμοποιώντας κύτταρα V79 κινεζικού χάμστερ.
Δεν παρατηρήθηκε καμία μείωση της γονιμότητας ή της αναπαραγωγικής επίδοσης σε αρουραίους που χορηγήθηκαν μέχρι 18 mg / kg / ημέρα (9 φορές το MRHD σε mg / m 2) από το στόμα από 14 ημέρες πριν από το ζευγάρωμα μέχρι την κύηση και τη γαλουχία στις γυναίκες ή για 60 ημέρες πριν από το ζευγάρωμα αρσενικά.
Εγκυμοσύνη
Εγκυμοσύνη Κατηγορία Β: Η μεμαντίνη που δόθηκε από το στόμα σε εγκύους αρουραίους και έγκυα κουνέλια κατά την περίοδο οργανογένεσης δεν ήταν τερατογόνος μέχρι τις υψηλότερες δόσεις που εξετάστηκαν (18 mg / kg / ημέρα σε αρουραίους και 30 mg / kg / ημέρα σε κουνέλια, οι οποίες είναι 9 και 30 φορές, αντίστοιχα, η μέγιστη συνιστώμενη δόση σε ανθρώπους [MRHD] σε mg / m 2 βάση).
Η ελαφρά μητρική τοξικότητα, τα μειωμένα βάρη των νεογνών και η αυξημένη συχνότητα εμφάνισης μη οστεοποιημένων αυχενικών σπονδύλων παρατηρήθηκαν σε μία από του στόματος δόση των 18 mg / kg / ημέρα σε μια μελέτη στην οποία οι αρουραίοι έλαβαν από του στόματος μεμαντίνη αρχίζοντας προ-ζευγαρώνοντας και συνεχίζοντας μέσω του μετά τον τοκετό περίοδος. Η ελαφρά μητρική τοξικότητα και τα μειωμένα βάρη των νεογνών παρατηρήθηκαν επίσης σε αυτή τη δόση σε μια μελέτη στην οποία οι αρουραίοι υποβλήθηκαν σε αγωγή από την 15η ημέρα της κύησης μέχρι την περίοδο μετά τον τοκετό. Η δόση χωρίς επιπτώσεις για αυτά τα αποτελέσματα ήταν 6 mg / kg, η οποία είναι 3 φορές μεγαλύτερη από την τιμή MRHD σε mg / m 2.
Δεν υπάρχουν επαρκείς και καλά ελεγχόμενες μελέτες της μεμαντίνης σε έγκυες γυναίκες. Το Memantine πρέπει να χρησιμοποιείται κατά τη διάρκεια της εγκυμοσύνης μόνο εάν το πιθανό όφελος δικαιολογεί τον πιθανό κίνδυνο για το έμβρυο.
Θηλάζουσες μητέρες
Δεν είναι γνωστό αν η μεμαντίνη απεκκρίνεται στο μητρικό γάλα. Επειδή πολλά φάρμακα απεκκρίνονται στο ανθρώπινο γάλα, πρέπει να δίνεται προσοχή όταν η μεμαντίνη χορηγείται σε μια θηλάζουσα μητέρα.
Παιδιατρική χρήση
Δεν υπάρχουν επαρκείς και καλά ελεγχόμενες δοκιμές που να τεκμηριώνουν την ασφάλεια και την αποτελεσματικότητα της μεμαντίνης σε οποιαδήποτε ασθένεια που εμφανίζεται στα παιδιά.
Ανεπιθύμητες ενέργειες
Η εμπειρία που περιγράφεται σε αυτό το τμήμα προέρχεται από μελέτες σε ασθενείς με νόσο Alzheimer και αγγειακή άνοια.
Ανεπιθύμητες ενέργειες που οδηγούν σε διακοπή: Σε ελεγχόμενες με εικονικό φάρμακο μελέτες στις οποίες ασθενείς με άνοια έλαβαν δόσεις Namenda έως 20 mg / ημέρα, η πιθανότητα διακοπής λόγω ανεπιθύμητου συμβάντος ήταν η ίδια στην ομάδα του Namenda όπως και στο εικονικό φάρμακο ομάδα. Κανένα μεμονωμένο ανεπιθύμητο συμβάν δεν συσχετίστηκε με τη διακοπή της θεραπείας σε 1% ή περισσότερους ασθενείς που έλαβαν θεραπεία με Namenda και σε ποσοστό μεγαλύτερο από το εικονικό φάρμακο.
Ανεπιθύμητα συμβάντα που αναφέρθηκαν σε ελεγχόμενες δοκιμές: Τα ανεπιθύμητα συμβάντα που αναφέρθηκαν στις μελέτες του Namenda (υδροχλωρική μεμαντίνη) αντανακλούν την εμπειρία που αποκτήθηκε υπό στενά παρακολουθούμενες καταστάσεις σε έναν εξαιρετικά επιλεγμένο πληθυσμό ασθενών. Στην πραγματική πρακτική ή σε άλλες κλινικές δοκιμές, αυτές οι εκτιμήσεις συχνότητας μπορεί να μην ισχύουν, καθώς οι συνθήκες χρήσης, η συμπεριφορά αναφοράς και οι τύποι των ασθενών που αντιμετωπίζονται μπορεί να διαφέρουν. Ο Πίνακας 1 αναφέρει τα σημεία και τα συμπτώματα που εμφανίστηκαν σε θεραπεία που αναφέρθηκαν σε τουλάχιστον 2% των ασθενών που ελάμβαναν εικονικό φάρμακο δοκιμασίες άνοιας και για τα οποία ο ρυθμός εμφάνισης ήταν μεγαλύτερος για τους ασθενείς που έλαβαν θεραπεία με Namenda από ό, τι στους ασθενείς που έλαβαν θεραπεία εικονικό φάρμακο. Δεν εμφανίστηκε ανεπιθύμητο συμβάν με συχνότητα τουλάχιστον 5% και διπλάσια από την τιμή του εικονικού φαρμάκου.
Σύστημα Σώματος |
Εικονικό φάρμακο (Ν = 922) % |
Namenda (Ν = 940) % |
Σώμα ως σύνολο | ||
Κούραση |
1 | 2 |
Πόνος |
1 | 3 |
Καρδιαγγειακό σύστημα | ||
Υπέρταση |
2 | 4 |
Κεντρικό και Περιφερικό Νευρικό Σύστημα | ||
Ζάλη |
5 | 7 |
Πονοκέφαλο |
3 | 6 |
Γαστρεντερικό σύστημα | ||
Δυσκοιλιότητα |
3 | 5 |
Έμετος |
2 | 3 |
Μυοσκελετικό σύστημα | ||
Πόνος στην πλάτη |
2 | 3 |
Ψυχιατρικές διαταραχές | ||
Σύγχυση |
5 | 6 |
Υπνηλία |
2 | 3 |
Παραίσθηση |
2 | 3 |
Αναπνευστικό σύστημα | ||
Βήχας |
3 | 4 |
Δύσπνοια |
1 | 2 |
Άλλες ανεπιθύμητες ενέργειες που εμφανίστηκαν με συχνότητα τουλάχιστον 2% στους ασθενείς που έλαβαν θεραπεία με Namenda αλλά με μεγαλύτερο ή ίσο ρυθμό στο εικονικό φάρμακο ήταν η διέγερση, η πτώση, η πρόκληση τραυματισμού, η ακράτεια ούρων, διάρροια, βρογχίτιδα, αϋπνία, μόλυνση ουροφόρων οδών, συμπτώματα που ομοιάζουν με γρίπη, μη φυσιολογικό βάδισμα, κατάθλιψη, λοίμωξη της ανώτερης αναπνευστικής οδού, άγχος, περιφερικό οίδημα, ναυτία, ανορεξία και αρθραλγία.
Το γενικό προφίλ των ανεπιθύμητων ενεργειών και τα ποσοστά επίπτωσης για επιμέρους ανεπιθύμητες ενέργειες στον υποπληθυσμό ασθενών με η μέτρια έως σοβαρή νόσο του Alzheimer δεν ήταν διαφορετική από την αναλογία προφίλ και συχνότητας εμφάνισης που περιγράφηκε παραπάνω για τη συνολική άνοια πληθυσμός.
Αλλαγές Ζωτικών Σημείων: Οι ομάδες Namenda και placebo συγκρίθηκαν σε σχέση με (1) τη μέση μεταβολή από την αρχική τιμή των ζωτικών σημείων (παλμός, συστολική αρτηριακή πίεση, διαστολικό αίμα πίεση και βάρος) και (2) η συχνότητα εμφάνισης ασθενών που πληρούν τα κριτήρια για πιθανές κλινικά σημαντικές μεταβολές από τις αρχικές σε αυτές μεταβλητές. Δεν υπήρξαν κλινικά σημαντικές αλλαγές στα ζωτικά σημεία σε ασθενείς που έλαβαν θεραπεία με Namenda. Μια σύγκριση των μέτρων ύπαρξης ζωτικών σημείων ύπτια και μόνιμων σημείων για το Namenda και το εικονικό φάρμακο σε ηλικιωμένα φυσιολογικά άτομα έδειξε ότι η θεραπεία με Namenda δεν σχετίζεται με ορθοστατικές αλλαγές.
Εργαστηριακές αλλαγές: Οι ομάδες Namenda και εικονικού φαρμάκου συγκρίθηκαν σε σχέση με (1) τη μέση μεταβολή από τη βασική γραμμή της ποικιλίας της χημείας ορού, της αιματολογίας και (2) την επίπτωση των ασθενών που πληρούν τα κριτήρια για πιθανές κλινικώς σημαντικές μεταβολές από τις αρχικές σε αυτές μεταβλητές. Αυτές οι αναλύσεις δεν αποκάλυψαν κλινικά σημαντικές αλλαγές στις παραμέτρους εργαστηριακών εξετάσεων που σχετίζονται με τη θεραπεία με Namenda.
Αλλαγές ΗΚΓ: Οι ομάδες Namenda και placebo συγκρίθηκαν σε σχέση με (1) τη μέση αλλαγή από την αρχική τιμή σε διάφορες παραμέτρους ΗΚΓ και (2) η συχνότητα εμφάνισης ασθενών που πληρούν τα κριτήρια για πιθανές κλινικώς σημαντικές αλλαγές από τις αρχικές σε αυτές μεταβλητές. Αυτές οι αναλύσεις δεν αποκάλυψαν κλινικά σημαντικές αλλαγές στις παραμέτρους του ΗΚΓ που σχετίζονται με τη θεραπεία με το Namenda.
Άλλα ανεπιθύμητα συμβάματα που παρατηρήθηκαν κατά τη διάρκεια κλινικών δοκιμών
Το Namenda έχει χορηγηθεί σε περίπου 1350 ασθενείς με άνοια, εκ των οποίων περισσότεροι από 1200 έλαβαν τη μέγιστη συνιστώμενη δόση των 20 mg / ημέρα. Οι ασθενείς έλαβαν θεραπεία με Namenda για περιόδους έως 884 ημερών, με 862 ασθενείς που έλαβαν θεραπεία τουλάχιστον 24 εβδομάδων και 387 ασθενείς που έλαβαν 48 εβδομάδες ή περισσότερο θεραπείας.
Αντιμετώπιση αναδυόμενων συμπτωμάτων και συμπτωμάτων που εμφανίστηκαν κατά τη διάρκεια 8 ελεγχόμενων κλινικών δοκιμών και 4 ανοιχτών οι δοκιμές καταγράφηκαν ως ανεπιθύμητες ενέργειες από τους κλινικούς ερευνητές χρησιμοποιώντας τη δική τους ορολογία επιλέγοντας. Για να υπάρξει μια συνολική εκτίμηση του ποσοστού ατόμων που έχουν παρόμοια είδη συμβάντων, τα γεγονότα ομαδοποιήθηκαν σε έναν μικρότερο αριθμό τυποποιημένων κατηγοριών που χρησιμοποιούν την ορολογία της ΠΟΥ, και οι συχνότητες συμβάντων υπολογίστηκαν σε όλους σπουδές.
Περιλαμβάνονται όλες οι ανεπιθύμητες ενέργειες που εμφανίζονται σε τουλάχιστον δύο ασθενείς, εκτός από εκείνες που έχουν ήδη αναφερθεί στον Πίνακα 1, όρους της ΠΟΥ γενικά να είναι πληροφοριακά, μικρά συμπτώματα ή συμβάντα απίθανο να προκαλούνται από φάρμακα, π.χ. επειδή είναι κοινά στη μελέτη πληθυσμός. Τα συμβάντα ταξινομούνται ανά σύστημα σώματος και απαριθμούνται χρησιμοποιώντας τους ακόλουθους ορισμούς: συχνές ανεπιθύμητες ενέργειες - αυτές που εμφανίζονται σε τουλάχιστον 1/100 ασθενείς. σπάνιες ανεπιθύμητες ενέργειες - εκείνες που εμφανίζονται σε 1/100 έως 1/1000 ασθενείς. Αυτές οι ανεπιθύμητες ενέργειες δεν σχετίζονται αναγκαστικά με τη θεραπεία με Namenda και στις περισσότερες περιπτώσεις παρατηρήθηκαν με παρόμοια συχνότητα σε ασθενείς που έλαβαν εικονικό φάρμακο στις ελεγχόμενες μελέτες.
Σώμα ως σύνολο: Συχνές: συγκοπή. Σπάνια: υποθερμία, αλλεργική αντίδραση.
Καρδιαγγειακό σύστημα: Συχνές: καρδιακή ανεπάρκεια. Συχνές: στηθάγχη, βραδυκαρδία, έμφραγμα του μυοκαρδίου, θρομβοφλεβίτιδα, κολπική μαρμαρυγή, υπόταση, καρδιακή ανακοπή, ορθοστατική υπόταση, πνευμονική εμβολή, πνευμονικό οίδημα.
Κεντρικό και Περιφερικό Νευρικό Σύστημα: Συχνές: παροδική ισχαιμική επίθεση, αγγειακό εγκεφαλικό επεισόδιο, ίλιγγος, αταξία, υποκινησία. Συχνές: παραισθησία, σπασμοί, εξωπυραμιδική διαταραχή, υπερτονία, τρόμος, αφασία, υποαισθησία, μη φυσιολογική συντονισμός, ημιπληγία, υπερκινησία, ακούσιες μυϊκές συσπάσεις, λήθαργος, εγκεφαλική αιμορραγία, νευραλγία, πτώση, νευροπόθεια.
Γαστρεντερικό σύστημα: Σπάνια: γαστρεντερίτιδα, εκκολπωματίτιδα, γαστρεντερική αιμορραγία, μελενά, οισοφαγική έλκος.
Διαταραχές του αίματος και του λεμφικού συστήματος: Συχνές: αναιμία. Σπάνια: λευκοπενία.
Μεταβολικές και διατροφικές διαταραχές: Συχνές: αυξημένη αλκαλική φωσφατάση, μειωμένο βάρος. Σπάνια: αφυδάτωση, υπονατριαιμία, επιδεινωμένος σακχαρώδης διαβήτης.
Ψυχιατρικές διαταραχές: Συχνές: επιθετική αντίδραση. Σπάνια: ψευδαίσθηση, διαταραχή προσωπικότητας, συναισθηματική αστάθεια, νευρικότητα, διαταραχή ύπνου, αυξημένη λίμπιντο, ψύχωση, αμνησία, απάθεια, παρανοϊκή αντίδραση, μη φυσιολογική σκέψη, μη φυσιολογικό κλάμα, αυξημένη όρεξη, παρωνιρία, παραλήρημα, αποπροσωποποίηση, νεύρωση, αυτοκτονία απόπειρα.
Αναπνευστικό σύστημα: Συχνές: πνευμονία. Σπάνια: άπνοια, άσθμα, αιμόπτυση.
Δέρμα και παρεμβολές: Συχνές: εξάνθημα. Συχνές: δερματικό έλκος, κνησμός, κυτταρίτιδα, έκζεμα, δερματίτιδα, ερυθηματώδες εξάνθημα, αλωπεκία, κνίδωση.
Ειδικές αισθήσεις: Συχνές: καταρράκτης, επιπεφυκίτιδα. Σπάνια: εκφυλισμός της ωχράς κηλίδας, μειωμένη οπτική οξύτητα, μειωμένη ακοή, εμβοές, βλεφαρίτιδα, θολή όραση, αδιαφάνεια του κερατοειδούς, γλαύκωμα, αιμορραγία του επιπεφυκότα, πόνο στο μάτι, αιμορραγία αμφιβληστροειδούς, ξηροφθαλμία, διπλωπία, μη φυσιολογική δακρύρροια, μυωπία, αποκόλληση αμφιβληστροειδούς.
Ουροποιητικό σύστημα: Συχνές: συχνή ούρηση. Σπάνια: δυσουρία, αιματουρία, κατακράτηση ούρων.
Γεγονότα που αναφέρθηκαν μετά την εμπορία του Namenda, τόσο των ΗΠΑ όσο και των ΗΠΑ
Παρόλο που δεν έχει βρεθεί αιτιώδης σχέση με τη θεραπεία με μεμαντίνη, έχουν αναφερθεί ότι οι ακόλουθες ανεπιθύμητες ενέργειες σχετίζονται χρονικά με τη θεραπεία με μεμαντίνη και δεν είναι που περιγράφεται αλλού στην επισήμανση: κολποκοιλιακό αποκλεισμό, κάταγμα οστού, σύνδρομο καρπιαίου σωλήνα, εγκεφαλικό έμφρακτο, θωρακικό άλγος, claudication, κολίτιδα, δυσκινησία, δυσφαγία, γαστρίτιδα, γαστροοισοφαγική παλινδρόμηση, σπασμοί grand mal, ενδοκρανιακή αιμορραγία, ηπατική ανεπάρκεια, υπερλιπιδαιμία, υπογλυκαιμία, ειλεός, ανικανότητα, κακουχία, κακόηθες νευροληπτικό σύνδρομο, οξεία παγκρεατίτιδα, πνευμονία εισπνοής, οξεία νεφρική ανεπάρκεια, παρατεταμένο διάστημα QT, ανησυχία, σύνδρομο Stevens-Johnson, αιφνίδιο θάνατο, υπερκοιλιακή ταχυκαρδία, ταχυκαρδία, όψιμη δυσκινησία και θρομβοπενία.
ΤΟΞΙΚΟΛΟΓΙΑ ΤΩΝ ΖΩΩΝ
Η μεμαντίνη προκάλεσε νευρωνικές βλάβες (κενοτομία και νέκρωση) στα πολυπολικά και πυραμιδικά κύτταρα στα φλοιώδη στρώματα ΙΙΙ και IV του οπίσθιου cingulate και retrosplenial neocortices σε αρουραίους, παρόμοιες με αυτές που είναι γνωστό ότι συμβαίνουν σε τρωκτικά που έχουν χορηγηθεί άλλοι ανταγωνιστές υποδοχέα NMDA. Οι βλάβες παρατηρήθηκαν μετά από μία δόση μεμαντίνης. Σε μια μελέτη στην οποία χορηγήθηκαν ημερήσιες δόσεις μαντατίνης από το στόμα για 14 ημέρες, η δόση χωρίς επιπτώσεις για νευρωνική νέκρωση ήταν 6 φορές η μέγιστη συνιστώμενη δόση σε άνθρωπο σε mg / m 2. Η πιθανότητα επαγωγής κεντρικής νευρωνικής κενοτομής και νέκρωσης από ανταγωνιστές υποδοχέα NMDA στους ανθρώπους είναι άγνωστη.
ΚΑΤΑΠΟΛΕΜΗΣΗ ΝΑΡΚΩΤΙΚΩΝ ΚΑΙ ΕΞΑΡΤΗΣΙΑ
Κατηγορία ελεγχόμενης ουσίας: Το Memantine HCl δεν είναι ελεγχόμενη ουσία.
Φυσική και ψυχολογική εξάρτηση: Το Memantine HCl είναι ένας μη ανταγωνιστικός NMDA ανταγωνιστής χαμηλής έως μέτριας συγγένειας που δεν έδωσε καμία ένδειξη ότι αναζητά φάρμακο συμπεριφορά ή συμπτώματα απόσυρσης κατά τη διακοπή σε 2.504 ασθενείς που συμμετείχαν σε κλινικές δοκιμές στη θεραπευτική αγωγή δόσεις. Τα στοιχεία μετά την κυκλοφορία, εκτός των ΗΠΑ, που συλλέγονται εκ των υστέρων, δεν παρείχαν στοιχεία για κατάχρηση ή εξάρτηση από τα ναρκωτικά.
Υπερβολική δόση
Επειδή οι στρατηγικές για τη διαχείριση της υπερδοσολογίας εξελίσσονται συνεχώς, συνιστάται να επικοινωνήσετε με ένα κέντρο δηλητηριάσεων για τον καθορισμό των πιο πρόσφατων συστάσεων για τη διαχείριση υπερβολικής δόσης οποιουδήποτε φάρμακο.
Όπως σε κάθε περίπτωση υπερδοσολογίας, πρέπει να χρησιμοποιηθούν γενικά υποστηρικτικά μέτρα και η θεραπεία θα πρέπει να είναι συμπτωματική. Η εξάλειψη της μεμαντίνης μπορεί να ενισχυθεί με την αύξηση της οξύτητας των ούρων. Σε μια τεκμηριωμένη περίπτωση υπερδοσολογίας με έως και 400 mg μεμαντίνης, ο ασθενής παρουσίασε ανησυχία, ψύχωση, οπτικές ψευδαισθήσεις, υπνηλία, λήθαργο και απώλεια συνείδησης. Ο ασθενής ανέκαμψε χωρίς μόνιμα επακόλουθα.
Δοσολογία και χορήγηση
Η δοσολογία του Namenda (υδροχλωρική μεμαντίνη) που αποδείχθηκε αποτελεσματική σε ελεγχόμενες κλινικές δοκιμές είναι 20 mg / ημέρα.
Η συνιστώμενη αρχική δόση του Namenda είναι 5 mg άπαξ ημερησίως. Η συνιστώμενη δόση στόχος είναι 20 mg / ημέρα. Η δόση πρέπει να αυξηθεί σε δόσεις των 5 mg έως 10 mg / ημέρα (5 mg δύο φορές την ημέρα), 15 mg / ημέρα (5 mg και 10 mg ως ξεχωριστές δόσεις) και 20 mg / ημέρα (10 mg δύο φορές την ημέρα). Το ελάχιστο συνιστώμενο διάστημα μεταξύ των αυξήσεων της δόσης είναι μία εβδομάδα.
Το Namenda μπορεί να λαμβάνεται με ή χωρίς φαγητό.
Οι ασθενείς / φροντιστές θα πρέπει να ενημερώνονται σχετικά με τον τρόπο χρήσης της συσκευής δοσολογίας για το διάλυμα Oral Solution. Θα πρέπει να ενημερώνονται για το φύλλο οδηγιών ασθενούς που συνοδεύει το προϊόν. Οι ασθενείς / φροντιστές θα πρέπει να ενημερώνονται για την αντιμετώπιση οποιωνδήποτε ερωτήσεων σχετικά με τη χρήση της λύσης στον ιατρό ή τον φαρμακοποιό τους.
Δόσεις σε Ειδικούς Πληθυσμούς
Συνιστάται μια δόση στόχος 5 mg BID σε ασθενείς με σοβαρή νεφρική δυσλειτουργία (κάθαρση κρεατινίνης 5 - 29 mL / min με βάση την εξίσωση Cockroft-Gault):
Για τα αρσενικά: CLcr = [140-ετών (έτη)] · Βάρος (kg) / [72 · κρεατινίνη ορού (mg / dL)]
Για τα θηλυκά: CLcr = 0,85 · [ηλικία 140 ετών] · Βάρος (kg) / [72 · κρεατινίνη ορού (mg / dL)]
Πώς παρέχεται
5 mg δισκίο:
Μπουκάλι 60 NDC # 0456-3205-60
10 -10 Μονάδα Δόση NDC # 0456-3205-63
Τα δισκία επικαλυμμένα με λεπτό υμένιο, σε σχήμα καψακίου, είναι μαύρα, με την αντοχή (5) στη μία πλευρά και την FL από την άλλη.
10 mg δισκίο:
Μπουκάλι 60 NDC # 0456-3210-60
10 -10 Μονάδα Δόση NDC # 0456-3210-63
Τα επικαλυμμένα με λεπτό υμένιο δισκία με σχήμα καψακίου είναι γκρίζα, με την αντοχή (10) στη μία πλευρά και το FL από την άλλη.
Titration Pak:
Συσκευασία blister από PVC / αλουμίνιο που περιέχει 49 δισκία. Τα δισκία των 28 - 5 mg και των 21 - 10 mg. NDC # 0456-3200-14
Τα δισκία επικαλυμμένα με λεπτό υμένιο με σχήμα καψακίου των 5 mg είναι μαύρα, με την αντοχή (5) να είναι χαραγμένη στη μία πλευρά και FL από την άλλη. Τα επικαλυμμένα με λεπτό υμένιο δισκία των 10 mg σε μορφή κάψουλας είναι γκρίζα, με την αντοχή (10) στην μία πλευρά και την FL από την άλλη.
Στοματική λύση:
Οι συστάσεις δοσολογίας για πόσιμο διάλυμα είναι οι ίδιες με αυτές για τα δισκία. Το πόσιμο διάλυμα είναι διαυγές, απαλλαγμένο από οινόπνευμα, απαλλαγμένο από ζάχαρη και αρωματισμένο με μέντας.
2 mg / mL από του στόματος διαλύματος (10 mg = 5 mL)
12 fl. oz. (360 mL) NDC # 0456-3202-12
Φυλάσσεται στους 25 ° C (77 ° F). επιτρέπονται εκδρομές στους 15-30 ° C (59-86 ° F) [βλέπε USP Ελεγχόμενη θερμοκρασία δωματίου].
Forest Pharmaceuticals, Inc.
Θυγατρική της Forest Laboratories, Inc.
St. Louis, ΜΟ 63045
Χορηγήθηκε άδεια από την Merz Pharmaceuticals GmbH
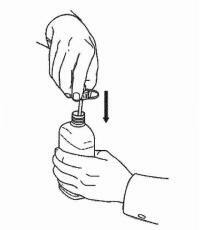
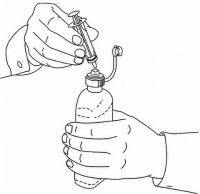
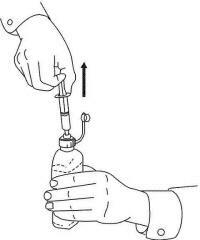
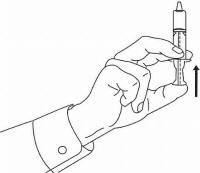
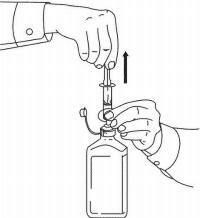
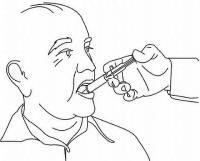
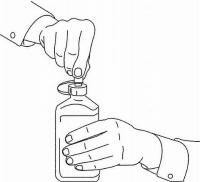
ΟΔΗΓΙΕΣ ΑΣΘΕΝΟΥΣ ΓΙΑ ΤΗΝ ΟΔΙΚΗ ΛΥΣΗ NAMENDA®
Ακολουθήστε τις παρακάτω οδηγίες για να χρησιμοποιήσετε τη συσκευή δοσομέτρησης για το στόμα σας Namenda®.
ΣΗΜΑΝΤΙΚΟ: Διαβάστε αυτές τις οδηγίες πριν χρησιμοποιήσετε το Namenda® προφορικό διάλυμα.
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
ΣΠΟΥΔΑΙΟΣ: Οι πληροφορίες σε αυτή τη μονογραφία δεν προορίζονται να καλύψουν όλες τις πιθανές χρήσεις, οδηγίες, προφυλάξεις, αλληλεπιδράσεις φαρμάκων ή ανεπιθύμητες ενέργειες. Αυτές οι πληροφορίες είναι γενικευμένες και δεν προορίζονται ως συγκεκριμένες ιατρικές συμβουλές. Εάν έχετε απορίες σχετικά με τα φάρμακα που παίρνετε ή θέλετε περισσότερες πληροφορίες, επικοινωνήστε με το γιατρό σας, το φαρμακοποιό ή τη νοσοκόμα σας. Τελευταία ενημέρωση 4/07.
Πηγή: Forest Laboratories, διανομέας της Namenda.
Πληροφορίες για τον ασθενή της Namenda (στην απλή αγγλική γλώσσα)
πίσω στο: Ιστοσελίδα Φαρμακολογίας Ψυχιατρικών Φαρμάκων


