Γλυκοφάγος για τη θεραπεία του διαβήτη
Εμπορικό όνομα: Glucophage
Γενική ονομασία: υδροχλωρική μετφορμίνη
Μορφή Δοσολογίας: δισκία παρατεταμένης αποδέσμευσης
Περιεχόμενα:
Περιγραφή
Κλινική Φαρμακολογία
Ενδείξεις και χρήση
Αντενδείξεις
Προειδοποιήσεις
Προφυλάξεις
Αλληλεπιδράσεις με άλλα φάρμακα
Ανεπιθύμητες ενέργειες
Υπερβολική δόση
Δοσολογία
Παρέχεται
Glucomage, υδροχλωρική μετφορμίνη, πληροφορίες για τον ασθενή (στην απλή αγγλική γλώσσα)
Περιγραφή
Τα δισκία Glucophage® (υδροχλωρική μετφορμίνη) και το Glucophage® XR (υδροχλωρική μετφορμίνη) Δισκία παρατεταμένης απελευθέρωσης είναι από του στόματος αντιϋπεργλυκαιμικά φάρμακα που χρησιμοποιούνται στη θεραπεία του διαβήτη τύπου 2. Η υδροχλωρική μετφορμίνη (υδροχλωρική Ν, Ν-διμεθυλιμιδιδοκαρβονιμιδική διαμίδη) δεν σχετίζεται χημικά ή φαρμακολογικά με άλλες κατηγορίες αντιϋπεργλυκαιμικών παραγόντων από του στόματος. Ο δομικός τύπος είναι όπως φαίνεται:
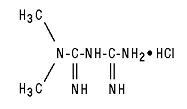
Η υδροχλωρική μετφορμίνη είναι μία λευκή έως υπόλευκη κρυσταλλική ένωση με μοριακό τύπο C4H11N5-HCl και ένα μοριακό βάρος 165,63. Η υδροχλωρική μετφορμίνη είναι ελεύθερα διαλυτή στο νερό και είναι πρακτικά αδιάλυτη σε ακετόνη, αιθέρα και χλωροφόρμιο. Το ρΚα της μετφορμίνης είναι 12,4. Το ρΗ ενός υδατικού διαλύματος 1% υδροχλωρικής μετφορμίνης είναι 6,68.
Τα δισκία Glucophage περιέχουν 500 mg, 850 mg ή 1000 mg υδροχλωρικής μετφορμίνης. Κάθε δισκίο περιέχει τα ανενεργά συστατικά ποβιδόνη και στεατικό μαγνήσιο. Επιπλέον, η επικάλυψη για τα δισκία των 500 mg και 850 mg περιέχει υπρομελλόζη και η επικάλυψη για το δισκίο των 1000 mg περιέχει υπρομελλόζη και πολυαιθυλενογλυκόλη.
Το Glucophage XR περιέχει 500 mg ή 750 mg υδροχλωρικής μετφορμίνης ως το δραστικό συστατικό.
Τα δισκία Glucophage XR 500 mg περιέχουν τα αδρανή συστατικά καρβοξυμεθυλοκυτταρίνη νατρίου, υπρομελλόζη, μικροκρυσταλλική κυτταρίνη και στεατικό μαγνήσιο.
Τα δισκία Glucophage XR 750 mg περιέχουν τα αδρανή συστατικά νατριούχο καρβοξυμεθυλοκυτταρίνη, υπρομελλόζη και στεατικό μαγνήσιο.
Συστατικά και απόδοση του συστήματος - Το Glucophage XR περιλαμβάνει ένα σύστημα διπλής υδρόφιλης πολυμερούς μήτρας. Η υδροχλωρική μετφορμίνη συνδυάζεται με ένα πολυμερές ελέγχου απελευθέρωσης φαρμάκου για να σχηματίσει μια «εσωτερική» φάση, η οποία στη συνέχεια ενσωματώνεται ως διακριτά σωματίδια σε μία «εξωτερική» φάση ενός δεύτερου πολυμερούς. Μετά τη χορήγηση, το υγρό από την γαστρεντερική (GI) οδό εισέρχεται στο δισκίο, προκαλώντας την ενυδάτωση και τη διόγκωση των πολυμερών. Το φάρμακο απελευθερώνεται αργά από τη μορφή δοσολογίας με μία διαδικασία διάχυσης μέσω της μήτρας πηκτής που ουσιαστικά είναι ανεξάρτητη από το ρΗ. Το σύστημα ενυδατωμένου πολυμερούς δεν είναι άκαμπτο και αναμένεται να διασπαστεί με φυσιολογική περισταλτικότητα στην ΟΑ. Τα βιολογικά αδρανή συστατικά του δισκίου μπορεί περιστασιακά να παραμείνουν άθικτα κατά τη διάρκεια της διαμετακόμισης GI και θα εξαλειφθούν στα κόπρανα ως μια μαλακή, ενυδατωμένη μάζα.
μπλουζα
Κλινική Φαρμακολογία
Μηχανισμός δράσης
Η μετφορμίνη είναι ένας αντιυπεργλυκαιμικός παράγοντας που βελτιώνει την ανοχή στη γλυκόζη σε ασθενείς με διαβήτη τύπου 2, μειώνοντας τόσο τη βασική όσο και τη μεταγευματική γλυκόζη πλάσματος. Οι φαρμακολογικοί μηχανισμοί δράσης της είναι διαφορετικοί από άλλες κατηγορίες αντιϋπεργλυκαιμικών παραγόντων από του στόματος. Η μετφορμίνη μειώνει την παραγωγή ηπατικής γλυκόζης, μειώνει την εντερική απορρόφηση της γλυκόζης και βελτιώνει την ευαισθησία στην ινσουλίνη αυξάνοντας την περιφερική πρόσληψη και χρήση της γλυκόζης. Σε αντίθεση με τις σουλφονυλουρίες, η μετφορμίνη δεν προκαλεί υπογλυκαιμία ούτε σε ασθενείς με διαβήτη τύπου 2 ούτε σε φυσιολογικά άτομα (εκτός από ειδικές περιπτώσεις, βλ. ΠΡΟΦΥΛΑΞΕΙΣ) και δεν προκαλεί υπερινσουλιναιμία. Με τη θεραπεία με μετφορμίνη, η έκκριση ινσουλίνης παραμένει αμετάβλητη, ενώ τα επίπεδα ινσουλίνης νηστείας και η απόκριση ινσουλίνης στο πλάσμα της ημέρας μπορεί να μειωθεί.
Φαρμακοκινητική
Απορρόφηση και βιοδιαθεσιμότητα
Η απόλυτη βιοδιαθεσιμότητα ενός δισκίου Glucophage 500 mg που χορηγείται υπό συνθήκες νηστείας είναι περίπου 50% έως 60%. Μελέτες που χρησιμοποιούν μεμονωμένες στοματικές δόσεις Glucophage 500 έως 1500 mg και 850 έως 2550 mg, δείχνουν ότι υπάρχει έλλειψη αναλογία δόσης με αυξανόμενες δόσεις, η οποία οφείλεται σε μειωμένη απορρόφηση και όχι σε αλλοίωση εξάλειψη. Το φαγητό μειώνει την έκταση και ελαφρώς καθυστερεί την απορρόφηση της μετφορμίνης, όπως φαίνεται από περίπου 40% χαμηλότερο μέσο όρο μέγιστου πλάσματος συγκέντρωση (Cmax), κατώτερη περιοχή 25% κάτω από την καμπύλη συγκέντρωσης πλάσματος έναντι χρόνου (AUC) και παράταση χρόνου έως κορυφή 35 λεπτών συγκέντρωση πλάσματος (Tmax) μετά τη χορήγηση ενός μόνο δισκίου μετφορμίνης των 850 mg με τροφή, σε σύγκριση με την ίδια περιεκτικότητα σε δισκία χορηγείται νηστεία. Η κλινική σημασία αυτών των μειώσεων είναι άγνωστη.
Μετά από μία εφάπαξ από του στόματος δόση του Glucophage XR, επιτυγχάνεται Cmax με διάμεση τιμή 7 ωρών και εύρος 4 έως 8 ωρών. Τα μέγιστα επίπεδα στο πλάσμα είναι περίπου 20% χαμηλότερα σε σύγκριση με την ίδια δόση του Glucophage, ωστόσο η έκταση της απορρόφησης (όπως μετράται με AUC) είναι παρόμοια με αυτή του Glucophage.
Σε σταθερή κατάσταση, οι AUC και Cmax είναι μικρότερες από την αναλογία δόσης για το Glucophage XR εντός της κλίμακας από 500 έως 2000 mg που χορηγείται άπαξ ημερησίως. Τα μέγιστα επίπεδα στο πλάσμα είναι περίπου 0,6, 1,1, 1,4 και 1,8 μg / mL για 500, 1000, 1500 και 2000 mg δόσεις μία φορά την ημέρα, αντίστοιχα. Η έκταση της απορρόφησης μετφορμίνης (όπως μετράται με AUC) από το Glucophage XR σε μία δόση 2000 mg μία φορά την ημέρα είναι παρόμοια με την ίδια συνολική ημερήσια δόση που χορηγήθηκε ως δισκία Glucophage 1000 mg δύο φορές την ημέρα. Μετά από επανειλημμένη χορήγηση του Glucophage XR, η μετφορμίνη δεν συσσωρεύτηκε στο πλάσμα.
Η μεταβλητότητα μεταξύ των υποκειμένων στο Cmax και η AUC της μετφορμίνης από το Glucophage XR είναι συγκρίσιμη με εκείνη του Glucophage.
Αν και η έκταση της απορρόφησης μετφορμίνης (όπως μετράται με AUC) από το δισκίο Glucophage XR αυξημένη κατά περίπου 50% όταν χορηγήθηκε με τροφή, δεν παρατηρήθηκε καμία επίδραση της τροφής στη Cmax και στην Tmax του μετφορμίνη. Και τα γεύματα υψηλού και χαμηλού λίπους είχαν την ίδια επίδραση στη φαρμακοκινητική του Glucophage XR.
Διανομή
Ο φαινόμενος όγκος κατανομής (V / F) μετφορμίνης μετά από εφάπαξ δόσεις Glucophage 850 mg κατά μέσο όρο ήταν 654 ± 358 L. Η μετφορμίνη δεσμεύεται αμελητέα στις πρωτεΐνες του πλάσματος, σε αντίθεση με τις σουλφονυλουρίες, οι οποίες είναι περισσότερο από 90% δεσμευμένες σε πρωτεΐνες. Η μετφορμίνη χωρίζει σε ερυθροκύτταρα, πιθανότατα ως συνάρτηση του χρόνου. Στις συνηθισμένες κλινικές δόσεις και δοσολογικά σχήματα του Glucophage, οι σταθερές συγκεντρώσεις της μετφορμίνης στο πλάσμα επιτυγχάνονται εντός 24 έως 48 ωρών και γενικά
Μεταβολισμός και Εξάλειψη
Οι ενδοφλέβιες μελέτες μίας δόσης σε φυσιολογικά άτομα αποδεικνύουν ότι η μετφορμίνη απεκκρίνεται αμετάβλητη στο ούρα και δεν υποβάλλονται σε ηπατικό μεταβολισμό (δεν έχουν εντοπιστεί μεταβολίτες στον άνθρωπο) ούτε χοληφόρο απέκκριση. Νεφρική κάθαρση (βλ Τραπέζι 1) είναι περίπου 3,5 φορές μεγαλύτερη από την κάθαρση κρεατινίνης, γεγονός που δείχνει ότι η σωληναριακή έκκριση είναι η κύρια οδός απομάκρυνσης της μετφορμίνης. Μετά από τη χορήγηση από το στόμα, περίπου το 90% του απορροφημένου φαρμάκου απομακρύνεται μέσω της νεφρικής οδού μέσα στις πρώτες 24 ώρες, με χρόνο ημιζωής αποβολής πλάσματος περίπου 6,2 ώρες. Στο αίμα, ο χρόνος ημίσειας ζωής αποβολής είναι περίπου 17,6 ώρες, γεγονός που υποδηλώνει ότι η μάζα των ερυθροκυττάρων μπορεί να είναι διαμέρισμα διανομής.
Ειδικοί πληθυσμοί
Ασθενείς με διαβήτη τύπου 2
Με την παρουσία φυσιολογικών νεφρικών λειτουργιών, δεν υπάρχουν διαφορές μεταξύ της φαρμακοκινητικής μιας ή των πολλαπλών δόσεων της μετφορμίνης μεταξύ ασθενών με διαβήτη τύπου 2 και φυσιολογικών ατόμων (βλ. Τραπέζι 1), ούτε υπάρχει συσσώρευση μετφορμίνης σε καμία από τις δύο ομάδες σε συνηθισμένες κλινικές δόσεις.
Η φαρμακοκινητική του Glucophage XR σε ασθενείς με διαβήτη τύπου 2 είναι συγκρίσιμη με εκείνη των υγιών φυσιολογικών ενηλίκων.
Νεφρική ανεπάρκεια
Σε ασθενείς με μειωμένη νεφρική λειτουργία (με βάση τη μετρούμενη κάθαρση κρεατινίνης), το πλάσμα και η ημιπερίοδος ζωής του αίματος η μετφορμίνη παρατείνεται και η νεφρική κάθαρση ελαττώνεται ανάλογα με τη μείωση της κάθαρσης κρεατινίνης (βλ Τραπέζι 1; δείτε επίσης ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ).
Ηπατική ανεπάρκεια
Δεν έχουν διεξαχθεί φαρμακοκινητικές μελέτες με μετφορμίνη σε ασθενείς με ηπατική ανεπάρκεια.
Γηριατρική
Περιορισμένα δεδομένα από ελεγχόμενες φαρμακοκινητικές μελέτες του Glucophage σε υγιή ηλικιωμένα άτομα υποδεικνύουν ότι το ολικό πλάσμα η κάθαρση της μετφορμίνης μειώνεται, ο χρόνος ημίσειας ζωής παρατείνεται και η Cmax αυξάνεται, σε σύγκριση με τους υγιείς νέους μαθήματα. Από αυτά τα δεδομένα, φαίνεται ότι η αλλαγή στη φαρμακοκινητική της μετφορμίνης με τη γήρανση οφείλεται κατά κύριο λόγο στην αλλαγή της νεφρικής λειτουργίας (βλ. Τραπέζι 1). Τα δισκία Glucophage (υδροχλωρική μετφορμίνη) και το Glucophage XR (υδροχλωρική μετφορμίνη) μπορεί να ξεκινήσει σε ασθενείς ηλικίας ≥ 80 ετών, εκτός εάν η μέτρηση της κάθαρσης κρεατινίνης καταδείξει ότι η νεφρική λειτουργία δεν μειώνεται (βλέπω ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ και ΔΟΣΟΛΟΓΙΑ ΚΑΙ ΧΟΡΗΓΗΣΗ).
Πίνακας 1: Επιλογή μέσης (± S.D.) Φαρμακοκινητικών παραμέτρων μετφορμίνης μετά από μία ή περισσότερες στοματικές δόσεις Glucophage
| Θεματικές ομάδες: Δόση γλυκοφαγίουένα (αριθμός θεμάτων) |
ντοΜέγιστησι (μg / mL) |
ΤΜέγιστηντο (ώρες) |
Νεφρική κάθαρση (ml / λεπτό) |
|---|---|---|---|
| ένα Όλες οι δόσεις που χορηγήθηκαν με νηστεία εκτός από τις πρώτες 18 δόσεις των μελετών πολλαπλών δόσεων | |||
| σι Μέγιστη συγκέντρωση πλάσματος | |||
| ντο Χρόνος μέχρι τη μέγιστη συγκέντρωση στο πλάσμα | |||
| ρε Συνδυασμένα αποτελέσματα (μέσο μέσο) πέντε μελετών: μέση ηλικία 32 έτη (εύρος 23-59 ετών) | |||
| μι Κινητική μελέτη που έγινε μετά τη δόση 19, δεδομένης της νηστείας | |||
| φά Ηλικιωμένοι, μέση ηλικία 71 ετών (εύρος 65-81 ετών) | |||
| σολ CLcr = κάθαρση κρεατινίνης ομαλοποιημένη σε επιφάνεια σώματος 1,73 m2 | |||
| Υγιείς, μη διαβητικοί ενήλικες: | |||
| 500 mg μιας δόσης (24) | 1.03 ( ±0.33) | 2.75 ( ±0.81) | 600 ( ±132) |
| 850 mg μιας δόσης (74)ρε | 1.60 ( ±0.38) | 2.64 ( ±0.82) | 552 ( ±139) |
| 850 mg τρεις φορές ημερησίως για 19 δόσειςμι (9) | 2.01 ( ±0.42) | 1.79 ( ±0.94) | 642 ( ±173) |
| Ενήλικες με διαβήτη τύπου 2: | |||
| 850 mg μιας δόσης (23) | 1.48 ( ±0.5) | 3.32 ( ±1.08) | 491 ( ±138) |
| 850 mg τρεις φορές ημερησίως για 19 δόσειςμι (9) | 1.90 ( ±0.62) | 2.01 ( ±1.22) | 550 ( ±160) |
| Ηλικιωμένοςf, υγιείς μη διαβητικοί ενήλικες: | |||
| 850 mg μιας δόσης (12) | 2.45 ( ±0.70) | 2.71 ( ±1.05) | 412 ( ±98) |
| Οι ενήλικες με προβλήματα νεφρικής λειτουργίας: | |||
| 850 mg μιας δόσης | |||
| Ήπια (CLcrσολ 61-90 κ.εκ. / λεπτό) (5) | 1.86 ( ±0.52) | 3.20 ( ±0.45) | 384 ( ±122) |
| Μέτρια (CLcr 31-60 ιπί / λεπτό) (4) | 4.12 ( ±1.83) | 3.75 ( ±0.50) | 108 ( ±57) |
| Σοβαρή (CLcr 10-30 κ.εκ. / λεπτό) (6) | 3.93 ( ±0.92) | 4.01 ( ±1.10) | 130 ( ±90 |
Παιδιατρική
Μετά τη χορήγηση ενός μεμονωμένου δισκίου Glucophage 500 mg από το στόμα με τροφή, η γεωμετρική μέση τιμή Cmax και AUC της μετφορμίνης διέφερε λιγότερο από 5% μεταξύ παιδιατρικούς ασθενείς με διαβήτη τύπου 2 (ηλικίας 12-16 ετών) και υγιείς ενήλικες ηλικίας 20-45 ετών με βάση το φύλο και το βάρος, όλα με φυσιολογικά νεφρικά λειτουργία
Γένος
Οι φαρμακοκινητικές παράμετροι της μετφορμίνης δεν διαφέρουν σημαντικά μεταξύ των φυσιολογικών ατόμων και των ασθενών με διαβήτη τύπου 2 όταν αναλύονται ανάλογα με το φύλο (αρσενικά = 19, γυναίκες = 16). Παρομοίως, σε ελεγχόμενες κλινικές μελέτες σε ασθενείς με διαβήτη τύπου 2, η αντιυπεργλυκαιμική δράση του Glucophage ήταν συγκρίσιμη σε άνδρες και γυναίκες.
Αγώνας
Δεν έχουν πραγματοποιηθεί μελέτες φαρμακοκινητικών παραμέτρων μετφορμίνης σύμφωνα με τη φυλή. Σε ελεγχόμενες κλινικές μελέτες του Glucophage σε ασθενείς με διαβήτη τύπου 2, το αντιυπεργλυκαιμικό αποτέλεσμα ήταν συγκρίσιμο σε λευκοί (n = 249), μαύροι (n = 51) και ισπανικοί (n = 24).
Κλινικές μελέτες
Glucophage
Σε μια διπλή-τυφλή, ελεγχόμενη με εικονικό φάρμακο, πολυκεντρική αμερικανική κλινική δοκιμή που περιελάμβανε παχύσαρκους ασθενείς με διαβήτη τύπου 2 των οποίων η υπεργλυκαιμία δεν ελέγχονταν επαρκώς με (βασική γλυκόζη πλάσματος νηστείας [FPG] περίπου 240 mg / dL), η θεραπεία με Glucophage (έως 2550 mg / ημέρα) για 29 εβδομάδες οδήγησε σε σημαντική μέσες καθαρές μειώσεις της γλυκόζης πλάσματος νηστείας και της μεταγευματικής γλυκόζης (PPG) και της αιμοσφαιρίνης A1c (HbA1c) 59 mg / dL, 83 mg / dL και 1,8% αντίστοιχα, σε σύγκριση με την ομάδα του εικονικού φαρμάκου Πίνακας 2).
Πίνακας 2: Γλυκοφάγος εναντίον εικονικού φαρμάκου Περίληψη των μέσων αλλαγών από την αρχική τιμή * σε γλυκόζη πλάσματος νηστείας, HbA1γ, και Βάρος σώματος, στην τελική επίσκεψη (μελέτη 29 εβδομάδων)
| Glucophage (η = 141) |
Εικονικό φάρμακο (η = 145) |
p-Value | |
|---|---|---|---|
| * Όλοι οι ασθενείς που υποβάλλονται σε θεραπεία διατροφής στη γραμμή βάσης | ** Μη στατιστικά σημαντικό | ||
| FPG (mg / dL) Βασική γραμμή Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ |
241.5 -53.0 |
237.7 6.3 |
NS ** 0.001 |
| Αιμοσφαιρίνη Α1c (%) Βασική γραμμή Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ |
8.4 -1.4 |
8.2 0.4 |
NS ** 0.001 |
| Βάρος σώματος (lbs) Βασική γραμμή Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ |
201.0 -1.4 |
206.0 -2.4 |
NS ** NS ** |
Μία μελέτη διάρκειας 29 εβδομάδων, διπλή-τυφλή, ελεγχόμενη με εικονικό φάρμακο μελέτη του Glucophage και της γλυβουρίδης, μόνος και σε συνδυασμό, διεξήχθη σε παχύσαρκους ασθενείς με τύπου 2 διαβήτη που δεν κατάφεραν να επιτύχουν ικανοποιητικό γλυκαιμικό έλεγχο ενώ στις μέγιστες δόσεις γλυβουρίδης (βασική τιμή FPG περίπου 250 mg / dL) (βλ. πίνακα 3). Ασθενείς που τυχαιοποιήθηκαν στο σκέλος συνδυασμού άρχισαν τη θεραπεία με Glucophage 500 mg και γλυβουρίδη 20 mg. Στο τέλος κάθε εβδομάδας των πρώτων 4 εβδομάδων της δοκιμής, αυτοί οι ασθενείς είχαν τις δόσεις του Glucophage αυξημένες κατά 500 mg αν δεν είχαν φθάσει στη γλυκόζη πλάσματος νηστείας στόχου. Μετά την 4η εβδομάδα, τέτοιες προσαρμογές της δοσολογίας έγιναν μηνιαίως, παρόλο που κανένας ασθενής δεν μπορούσε να υπερβεί το Glucophage 2500 mg. Οι ασθενείς στο σκέλος μόνο του Glucophage (μετφορμίνη και εικονικό φάρμακο) ακολούθησαν το ίδιο πρόγραμμα τιτλοδότησης. Στο τέλος της δοκιμής, περίπου το 70% των ασθενών στην ομάδα συνδυασμού έλαβαν Glucophage 2000 mg / γλυβουρίδη 20 mg ή Glucophage 2500 mg / γλυβουρίδη 20 mg. Οι ασθενείς που τυχαιοποιήθηκαν για να συνεχίσουν να εμφανίζουν επιδείνωση του γλυκαιμικού ελέγχου με γλυβουρίδη, με μέσες αυξήσεις των FPG, PPG και HbA1c των 14 mg / dL, 3 mg / dL και 0,2% αντίστοιχα. Αντίθετα, οι ασθενείς που τυχαιοποιήθηκαν στο Glucophage (έως 2500 mg / ημέρα) παρουσίασαν ελαφρά βελτίωση, με μέσες μειώσεις των FPG, PPG και HbA1c κατά 1 mg / dL, 6 mg / dL και 0,4% αντίστοιχα. Ο συνδυασμός του Glucophage και της γλυβουρίδης ήταν αποτελεσματικός στη μείωση των επιπέδων FPG, PPG και HbA1c κατά 63 mg / dL, 65 mg / dL και 1,7% αντίστοιχα. Σε σύγκριση με τα αποτελέσματα μόνο της θεραπείας με γλυβουρίδη, οι καθαρές διαφορές με τη συνδυασμένη θεραπεία ήταν -77 mg / dL, -68 mg / dL και -1,9% αντίστοιχα (βλ. Πίνακα 3).
Πίνακας 3: Συνδυασμένη μονοθεραπεία συνδυασμένης γλυκοφαγιάς / γλυβουρίδης (Comb) έναντι γλυβουρίδης (Glyb) ή Glucophage (GLU): Περίληψη των μέσων αλλαγών από την αρχική τιμή * στη γλυκόζη πλάσματος νηστείας, HbA1γ, και Βάρος σώματος, στην τελική επίσκεψη (μελέτη 29 εβδομάδων)
| p-τιμές | ||||||
|---|---|---|---|---|---|---|
| Χτένα (η = 213) |
Glyb (η = 209) |
GLU (η = 210) |
Glyb vs Χτένα |
GLU vs Χτένα |
GLU vs Glyb |
|
| * Όλοι οι ασθενείς σε γλυβουρίδη, 20 mg / ημέρα, στην αρχική τιμή | ** Μη στατιστικά σημαντικό | |||||
| Γλυκόζη πλάσματος νηστείας (mg / dL) | ||||||
| Βασική γραμμή Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ |
250.5 -63.5 |
247.5 13.7 |
253.9 -0.9 |
NS ** 0.001 |
NS ** 0.001 |
NS ** 0.025 |
| Αιμοσφαιρίνη Α1c (%) | ||||||
| Βασική γραμμή Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ |
8.8 -1.7 |
8.5 0.2 |
8.9 -0.4 |
NS ** 0.001 |
NS ** 0.001 |
0.007 0.001 |
| Βάρος σώματος (lbs) | ||||||
| Βασική γραμμή Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ |
202.2 0.9 |
203.0 -0.7 |
204.0 -8.4 |
NS ** 0.011 |
NS ** 0.001 |
NS ** 0.001 |
Το μέγεθος της μείωσης της συγκέντρωσης της γλυκόζης στο αίμα νηστείας μετά το θεσμό του Η θεραπεία με τα δισκία Glucophage (υδροχλωρική μετφορμίνη) ήταν ανάλογη με το επίπεδο νηστείας υπεργλυκαιμία. Οι ασθενείς με διαβήτη τύπου 2 με υψηλότερες συγκεντρώσεις γλυκόζης στη νηστεία παρουσίασαν μεγαλύτερη πτώση της γλυκόζης στο πλάσμα και της γλυκοζυλιωμένης αιμοσφαιρίνης.
Σε κλινικές μελέτες, το Glucophage, μόνο του ή σε συνδυασμό με μια σουλφονυλουρία, μείωσε τον μέσο όρο νηστείας τριγλυκερίδια, ολική χοληστερόλη και επίπεδα LDL χοληστερόλης και δεν είχε αρνητικές επιδράσεις σε άλλα επίπεδα λιπιδίων (βλ. Πίνακας 4).
Πίνακας 4: Περίληψη της μέσης εκατοστιαίας μεταβολής από την αρχική τιμή των κυριότερων μεταβλητών λιπιδίων ορού στην τελική επίσκεψη (μελέτες 29 εβδομάδων)
| Γλυκοφάγος έναντι του εικονικού φαρμάκου | Συνδυασμένο Glucophage / Glyburide έναντι μονοθεραπείας |
||||
|---|---|---|---|---|---|
| Glucophage (η = 141) |
Εικονικό φάρμακο (η = 145) |
Glucophage (η = 210) |
Glucophage / Γλυβουρίδη (η = 213) |
Γλυβουρίδη (η = 209) |
|
| Συνολική χοληστερόλη (mg / dL) | |||||
| Βασική γραμμή Μέση% Μεταβολή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ |
211.0 -5% |
212.3 1% |
213.1 -2% |
215.6 -4% |
219.6 1% |
| Σύνολο τριγλυκεριδίων (mg / dL) | |||||
| Βασική γραμμή Μέση% Μεταβολή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ |
236.1 -16% |
203.5 1% |
242.5 -3% |
215.0 -8% |
266.1 4% |
| LDL-χοληστερόλη (mg / dL) | |||||
| Βασική γραμμή Μέση% Μεταβολή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ |
135.4 -8% |
138.5 1% |
134.3 -4% |
136.0 -6% |
137.5 3% |
| HDL-χοληστερόλη (mg / dL) | |||||
| Βασική γραμμή Μέση% Μεταβολή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ |
39.0 2% |
40.5 -1% |
37.2 5% |
39.0 3% |
37.0 1% |
Σε αντίθεση με τις σουλφονυλουρίες, το σωματικό βάρος των ατόμων στο Glucophage τείνει να παραμένει σταθερό ή ακόμη και να μειώνεται κάπως (βλ. Πίνακες 2 και 3).
Μία 24-εβδομάδα, διπλή-τυφλή, ελεγχόμενη με εικονικό φάρμακο μελέτη του Glucophage συν ινσουλίνη έναντι ινσουλίνης συν το εικονικό φάρμακο ήταν που διεξήχθη σε ασθενείς με διαβήτη τύπου 2 που απέτυχαν να επιτύχουν ικανοποιητικό γλυκαιμικό έλεγχο μόνο στην ινσουλίνη (βλ Πίνακας 5). Οι ασθενείς που τυχαιοποιήθηκαν για τη λήψη του Glucophage συν ινσουλίνη πέτυχαν μείωση της HbA1c κατά 2,10%, σε σύγκριση με τη μείωση της HbA1c κατά 1,56% που επιτυγχάνεται με την ινσουλίνη συν το εικονικό φάρμακο. Η βελτίωση του γλυκαιμικού ελέγχου επιτεύχθηκε στην τελική επίσκεψη μελέτης με 16% λιγότερη ινσουλίνη, 93,0 U / ημέρα έναντι 110,6 U / ημέρα, Glucophage συν ινσουλίνη έναντι ινσουλίνης συν εικονικό φάρμακο, αντίστοιχα, ρ = 0,04.
Πίνακας 5: Συνοπτική περίληψη των μέσων αλλαγών από την αρχική τιμή της HbA στο Glucophage / Insulin vs. Placebo / Insulin1γ και ημερήσια δόση ινσουλίνης
| Glucophage / Ινσουλίνη (η = 26) |
Εικονικό φάρμακο / Ινσουλίνη (η = 28) |
Θεραπευτική αγωγή Διαφορά Μέσος όρος ± SE |
|
|---|---|---|---|
|
ένα Στατιστικά σημαντική χρήση ανάλυσης της συνδιακύμανσης με την αρχική τιμή ως μεταβλητή (p = 0,04) Δεν είναι σημαντικό χρησιμοποιώντας ανάλυση διακύμανσης (τιμές που φαίνονται στον πίνακα) | |||
| σι Στατιστικά σημαντική για την ινσουλίνη (p = 0,04) | |||
| Αιμοσφαιρίνη Α1c (%) | |||
| Βασική γραμμή Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ |
8.95 -2.10 |
9.32 -1.56 |
-0.54 ± 0.43ένα |
| Δόση ινσουλίνης (U / ημέρα) | |||
| Βασική γραμμή Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ |
93.12 -0.15 |
94.64 15.93 |
-16.08 ± 7.77σι |
Μία δεύτερη διπλή τυφλή, ελεγχόμενη με εικονικό φάρμακο μελέτη (n = 51), με 16 εβδομάδες τυχαιοποιημένης θεραπείας, έδειξε ότι σε ασθενείς με διαβήτη τύπου 2 που ελέγχονται με ινσουλίνη για 8 εβδομάδες με μέση τιμή HbA1c 7,46 ± 0,97%, η προσθήκη του Glucophage διατηρεί παρόμοιο γλυκαιμικό έλεγχο (HbA1c 7,15 ± 0,61 έναντι 6,97 ± 0,62 για το Glucophage συν ινσουλίνη και εικονικό φάρμακο συν ινσουλίνη, αντίστοιχα) με 19% λιγότερη ινσουλίνη έναντι βασικής γραμμής (μείωση 23,68 ± 30,22 έναντι αύξησης 0,43 ± 25,20 μονάδων για το Glucophage συν ινσουλίνη και εικονικό φάρμακο συν ινσουλίνη, ρ <0,01). Επιπλέον, αυτή η μελέτη έδειξε ότι ο συνδυασμός του Glucophage συν ινσουλίνη είχε ως αποτέλεσμα τη μείωση σε βάρος σώματος 3,11 ± 4,30 lbs, σε σύγκριση με αύξηση 1,30 ± 6,08 lbs για εικονικό φάρμακο συν ινσουλίνη, ρ = 0,01.
Glucophage XR
Μία 24-εβδομάδα, διπλή-τυφλή, ελεγχόμενη με εικονικό φάρμακο μελέτη του Glucophage XR, που ελήφθη μία φορά την ημέρα με το βραδινό γεύμα, διεξήχθη ασθενείς με διαβήτη τύπου 2 που δεν κατάφεραν να επιτύχουν γλυκαιμικό έλεγχο με δίαιτα και άσκηση (HbA1c 7,0% -10,0%, FPG 126-270 mg / dL). Οι ασθενείς που έλαβαν τη μελέτη είχαν μέση αρχική τιμή HbA1c 8,0% και μέση βασική τιμή FPG 176 mg / dL. Μετά από θεραπεία 12 εβδομάδων, η μέση HbA1c είχε αυξηθεί από την αρχική τιμή κατά 0,1% και η μέση τιμή FPG μειώθηκε από την αρχική τιμή κατά 2 mg / dL στην ομάδα του εικονικού φαρμάκου, σε σύγκριση με μείωση της μέσης HbA1c κατά 0,6% και μείωση της μέσης τιμής FPG των 23 mg / dL σε ασθενείς που έλαβαν θεραπεία με Glucophage XR 1000 mg μια φορά καθημερινά. Στη συνέχεια, η δόση θεραπείας αυξήθηκε στα 1500 mg μία φορά ημερησίως εάν η HbA1c ήταν ≥7,0%, αλλά <8,0% (οι ασθενείς με HbA1c ≥ 8,0% διακόπηκαν από τη μελέτη). Κατά την τελευταία επίσκεψη (24 εβδομάδων), η μέση τιμή HbA1c είχε αυξηθεί κατά 0,2% από την αρχική τιμή στους ασθενείς που έλαβαν εικονικό φάρμακο και μειώθηκε κατά 0,6% με το Glucophage XR.
Μια μελέτη 16-εβδομάδων, διπλής-τυφλής, ελεγχόμενης με εικονικό φάρμακο, δόσης-απόκρισης του Glucophage XR, που λαμβάνεται μία φορά την ημέρα με το βραδινό γεύμα ή δύο φορές την ημέρα με τα γεύματα, διεξήχθη σε ασθενείς με διαβήτη τύπου 2 που δεν κατάφεραν να επιτύχουν γλυκαιμικό έλεγχο με δίαιτα και άσκηση (HbA1c 7,0% -11,0%, FPG 126-280 mg / dL). Οι αλλαγές στον γλυκαιμικό έλεγχο και το σωματικό βάρος φαίνονται στον Πίνακα 6.
Πίνακας 6: Περίληψη των μέσων αλλαγών από την αρχική τιμή * στην HbA1γ, Γλυκόζη πλάσματος νηστείας και σωματικό βάρος κατά την τελική επίσκεψη (μελέτη 16 εβδομάδων)
| Glucophage XR | Εικονικό φάρμακο | |||||
|---|---|---|---|---|---|---|
| 500 mg Μια φορά Καθημερινά |
1000 mg Μια φορά Καθημερινά |
1500 mg Μια φορά Καθημερινά |
2000 mg Μια φορά Καθημερινά |
1000 mg Εις διπλούν Καθημερινά |
||
| * Όλοι οι ασθενείς που υποβάλλονται σε θεραπεία διατροφής στη γραμμή βάσης | ||||||
| ένα Όλες οι συγκρίσεις έναντι του εικονικού φαρμάκου | ||||||
| ** Μη στατιστικά σημαντικό | ||||||
| Αιμοσφαιρίνη Α1c (%) | (η = 115) | (η = 115) | (η = 111) | (η = 125) | (η = 112) | (η = 111) |
| Βασική γραμμή | 8.2 | 8.4 | 8.3 | 8.4 | 8.4 | 8.4 |
| Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ | -0.4 | -0.6 | -0.9 | -0.8 | -1.1 | 0.1 |
| p-valueένα | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| FPG (mg / dL) | (η = 126) | (η = 118) | (η = 120) | (η = 132) | (η = 122) | (η = 113) |
| Βασική γραμμή | 182.7 | 183.7 | 178.9 | 181.0 | 181.6 | 179.6 |
| Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ | -15.2 | -19.3 | -28.5 | -29.9 | -33.6 | 7.6 |
| p-valueένα | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| Βάρος σώματος (lbs) | (η = 125) | (η = 119) | (η = 117) | (η = 131) | (η = 119) | (η = 113) |
| Βασική γραμμή | 192.9 | 191.8 | 188.3 | 195.4 | 192.5 | 194.3 |
| Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ | -1.3 | -1.3 | -0.7 | -1.5 | -2.2 | -1.8 |
| p-valueένα | NS ** | NS ** | NS ** | NS ** | NS ** | - |
Σε σύγκριση με το εικονικό φάρμακο, παρατηρήθηκε βελτίωση στον γλυκαιμικό έλεγχο σε όλα τα επίπεδα δόσης του Glucophage XR (μετφορμίνη υδροχλωρικό) Δισκία εκτεταμένης απελευθέρωσης και η θεραπεία δεν συσχετίστηκε με καμία σημαντική μεταβολή στο βάρος (βλέπω ΔΟΣΟΛΟΓΙΑ ΚΑΙ ΧΟΡΗΓΗΣΗ για συστάσεις δοσολογίας για το Glucophage και το Glucophage XR).
Μία τυχαιοποιημένη μελέτη διάρκειας 24 εβδομάδων, διπλής τυφλής, τυχαιοποιημένης μελέτης του Glucophage XR, που λαμβάνεται μία φορά την ημέρα με το βραδινό γεύμα, και τα δισκία Glucophage (υδροχλωρική μετφορμίνη), που λαμβάνονται δύο φορές ημερησίως (με πρωινό και βραδινό γεύμα), διεξήχθη σε ασθενείς με διαβήτη τύπου 2 οι οποίοι είχαν υποβληθεί σε θεραπεία με Glucophage 500 mg δύο φορές την ημέρα για τουλάχιστον 8 εβδομάδες πριν από την έναρξη της μελέτης. Η δόση του Glucophage δεν είχε απαραίτητα τιτλοποιηθεί για να επιτύχει ένα συγκεκριμένο επίπεδο γλυκαιμικού ελέγχου πριν από την είσοδο στη μελέτη. Οι ασθενείς που ενέπιπταν στη μελέτη αν η HbA1c ήταν ≤8,5% και η FPG ήταν ≥200 mg / dL. Οι αλλαγές στον γλυκαιμικό έλεγχο και το σωματικό βάρος φαίνονται στον Πίνακα 7.
Πίνακας 7: Περίληψη των μέσων αλλαγών από την αρχική τιμή * στην HbA1γ, Γλυκόζη πλάσματος νηστείας και σωματικό βάρος την εβδομάδα 12 και στην τελική επίσκεψη (μελέτη 24 εβδομάδων)
| Glucophage 500 mg Δύο φορές την ημέρα |
Glucophage XR | ||
|---|---|---|---|
| 1000 mg Μια φορά τη μέρα |
1500 mg Μια φορά τη μέρα |
||
| * Όλοι οι ασθενείς στο Glucophage 500 mg δύο φορές την ημέρα στην αρχική τιμή | |||
| ένα n = 68 | |||
| Αιμοσφαιρίνη Α1c (%) | (η = 67) | (η = 72) | (η = 66) |
| Βασική γραμμή | 7.06 | 6.99 | 7.02 |
| Αλλαγή σε 12 εβδομάδες | 0.14 | 0.23 | 0.04 |
| (95% CI) | (-0.03, 0.31) | (0.10, 0.36) | (-0.08, 0.15) |
| Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ | 0.14ένα | 0.27 | 0.13 |
| (95% CI) | (-0.04, 0.31) | (0.11, 0.43) | (-0.02, 0.28) |
| FPG (mg / dL) | (η = 69) | (η = 72) | (η = 70) |
| Βασική γραμμή | 127.2 | 131.0 | 131.4 |
| Αλλαγή σε 12 εβδομάδες | 12.9 | 9.5 | 3.7 |
| (95% CI) | (6.5, 19.4) | (4.4, 14.6) | (-0.4, 7.8) |
| Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ | 14.0 | 11.5 | 7.6 |
| (95% CI) | (7.0, 21.0) | (4.4, 18.6) | (1.0, 14.2) |
| Βάρος σώματος (lbs) | (η = 71) | (η = 74) | (η = 71) |
| Βασική γραμμή | 210.3 | 202.8 | 192.7 |
| Αλλαγή σε 12 εβδομάδες | 0.4 | 0.9 | 0.7 |
| (95% CI) | (-0.4, 1.5) | (0.0, 2.0) | (-0.4, 1.8) |
| Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ | 0.9 | 1.1 | 0.9 |
| (95% CI) | (-0.4, 2.2) | (-0.2, 2.4) | (-0.4, 2.0) |
Μετά από 12 εβδομάδες θεραπείας, παρατηρήθηκε αύξηση της μέσης HbA1γ σε όλες τις ομάδες. στην ομάδα του Glucophage XR 1000 mg, η αύξηση από την αρχική τιμή του 0,23% ήταν στατιστικά σημαντική (βλ ΔΟΣΟΛΟΓΙΑ ΚΑΙ ΧΟΡΗΓΗΣΗ).
Οι μεταβολές των παραμέτρων λιπιδίων στην προηγούμενα περιγραφόμενη μελέτη ελεγχόμενης από το εικονικό φάρμακο δόση του Glucophage XR φαίνονται στον Πίνακα 8.
Πίνακας 8: Περίληψη των μέσων ποσοστιαίων μεταβολών από την αρχική τιμή * στις κύριες μεταβλητές λιπιδίων κατά την τελική επίσκεψη (μελέτη διάρκειας 16 εβδομάδων)
| Glucophage XR | Εικονικό φάρμακο | |||||
|---|---|---|---|---|---|---|
| 500 mg Μια φορά Καθημερινά |
1000 mg Μια φορά Καθημερινά |
1500 mg Μια φορά Καθημερινά |
2000 mg Μια φορά Καθημερινά |
1000 mg Εις διπλούν Καθημερινά |
||
| * Όλοι οι ασθενείς που υποβάλλονται σε θεραπεία διατροφής στη γραμμή βάσης | ||||||
| Συνολική χοληστερόλη (mg / dL) | (η = 120) | (η = 113) | (η = 110) | (η = 126) | (η = 117) | (η = 110) |
| Βασική γραμμή | 210.3 | 218.1 | 214.6 | 204.4 | 208.2 | 208.6 |
| Μέση% Μεταβολή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ | 1.0% | 1.7% | 0.7% | -1.6% | -2.6% | 2.6% |
| Σύνολο τριγλυκεριδίων (mg / dL) | (η = 120) | (η = 113) | (η = 110) | (η = 126) | (η = 117) | (η = 110) |
| Βασική γραμμή | 220.2 | 211.9 | 198.0 | 194.2 | 179.0 | 211.7 |
| Μέση% Μεταβολή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ | 14.5% | 9.4% | 15.1% | 14.9% | 9.4% | 10.9% |
| LDL-χοληστερόλη (mg / dL) | (η = 119) | (η = 113) | (η = 109) | (η = 126) | (η = 117) | (η = 107) |
| Βασική γραμμή | 131.0 | 134.9 | 135.8 | 125.8 | 131.4 | 131.9 |
| Μέση% Μεταβολή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ | -1.4% | -1.6% | -3.5% | -3.3% | -5.5% | 3.2% |
| HDL-χοληστερόλη (mg / dL) | (η = 120) | (η = 108) | (η = 108) | (η = 125) | (η = 117) | (η = 108) |
| Βασική γραμμή | 40.8 | 41.6 | 40.6 | 40.2 | 42.4 | 39.4 |
| Μέση% Μεταβολή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ | 6.2% | 8.6% | 5.5% | 6.1% | 7.1% | 5.8% |
Οι μεταβολές των παραμέτρων λιπιδίων στην προηγούμενα περιγραφόμενη μελέτη των Glucophage και Glucophage XR φαίνονται στον Πίνακα 9.
Πίνακας 9: Περίληψη των μέσων ποσοστιαίων μεταβολών από την αρχική τιμή * στις κυριότερες μεταβλητές λιπιδίων κατά την τελική επίσκεψη (μελέτη 24 εβδομάδων)
| Glucophage | Glucophage XR | ||
|---|---|---|---|
| 500 mg Δύο φορές την ημέρα |
1000 mg Μια φορά τη μέρα |
1500 mg Μια φορά τη μέρα |
|
| * Όλοι οι ασθενείς στο Glucophage 500 mg δύο φορές την ημέρα στην αρχική τιμή | |||
| Συνολική χοληστερόλη (mg / dL) | (η = 68) | (η = 70) | (η = 66) |
| Βασική γραμμή | 199.0 | 201.9 | 201.6 |
| Μέση% Μεταβολή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ | 0.1% | 1.3% | 0.1% |
| Σύνολο τριγλυκεριδίων (mg / dL) | (η = 68) | (η = 70) | (η = 66) |
| Βασική γραμμή | 178.0 | 169.2 | 206.8 |
| Μέση% Μεταβολή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ | 6.3% | 25.3% | 33.4% |
| LDL-χοληστερόλη (mg / dL) | (η = 68) | (η = 70) | (η = 66) |
| Βασική γραμμή | 122.1 | 126.2 | 115.7 |
| Μέση% Μεταβολή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ | −1.3% | −3.3% | −3.7% |
| HDL-χοληστερόλη (mg / dL) | (η = 68) | (η = 70) | (η = 65) |
| Βασική γραμμή | 41.9 | 41.7 | 44.6 |
| Μέση% Μεταβολή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ | 4.8% | 1.0% | -2.1% |
Παιδιατρικές κλινικές μελέτες
Σε μία διπλά τυφλή, ελεγχόμενη με εικονικό φάρμακο μελέτη σε παιδιατρικούς ασθενείς ηλικίας 10 έως 16 ετών με διαβήτη τύπου 2 (μέση τιμή FPG 182,2 mg / dL), η θεραπεία με Glucophage (μέχρι το 2000 mg / ημέρα) για έως 16 εβδομάδες (μέση διάρκεια θεραπείας 11 εβδομάδες) οδήγησε σε σημαντική μέση καθαρή μείωση της FPG των 64,3 mg / dL, σε σύγκριση με το εικονικό φάρμακο (βλέπε Πίνακα 10).
Πίνακας 10: Γλυκοφάγος έναντι εικονικού φαρμάκου (Pediatricsένα) Περίληψη των μέσων αλλαγών από την αρχική τιμή * στην γλυκόζη του πλάσματος και το σωματικό βάρος κατά την τελική επίσκεψη
| Glucophage | Εικονικό φάρμακο | p-Value | |
|---|---|---|---|
| ένα Οι παιδιατρικοί ασθενείς έχουν ηλικία 13,8 ετών (εύρος 10-16 ετών) | |||
| * Όλοι οι ασθενείς που υποβάλλονται σε θεραπεία διατροφής στη γραμμή βάσης | |||
| ** Μη στατιστικά σημαντικό | |||
| FPG (mg / dL) | (η = 37) | (η = 36) | |
| Βασική γραμμή Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ |
162.4 -42.9 |
192.3 21.4 |
<0.001 |
| Βάρος σώματος (lbs) | (η = 39) | (η = 38) | |
| Βασική γραμμή Αλλαγή στην ΤΕΛΙΚΗ ΕΠΙΣΚΕΨΗ |
205.3 -3.3 |
189.0 -2.0 |
NS ** |
μπλουζα
Ενδείξεις και χρήση
Τα δισκία Glucophage (υδροχλωρική μετφορμίνη) ενδείκνυνται ως συμπλήρωμα στη δίαιτα και στην άσκηση για τη βελτίωση του γλυκαιμικού ελέγχου σε ενήλικες και παιδιά με σακχαρώδη διαβήτη τύπου 2.
Το Glucophage XR (υδροχλωρική μετφορμίνη) Δισκία παρατεταμένης απελευθέρωσης ενδείκνυται ως συμπλήρωμα στη δίαιτα και την άσκηση για τη βελτίωση του γλυκαιμικού ελέγχου σε ενήλικες με σακχαρώδη διαβήτη τύπου 2.
μπλουζα
Αντενδείξεις
Το Glucophage και το Glucophage XR αντενδείκνυνται σε ασθενείς με:
Νεφρική νόσος ή νεφρική δυσλειτουργία (π.χ., όπως υποδηλώνουν τα επίπεδα κρεατινίνης ορού ≥ 1,5 mg / dL [αρσενικά], ≥ 1,4 mg / dL [θηλυκά] ή μη φυσιολογικά κάθαρση κρεατινίνης) που μπορεί επίσης να προκύψει από καταστάσεις όπως η καρδιαγγειακή κατάρρευση (σοκ), το οξύ έμφραγμα του μυοκαρδίου και η σηψαιμία (βλέπω ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ και ΠΡΟΦΥΛΑΞΕΙΣ).
Γνωστή υπερευαισθησία στη υδροχλωρική μετφορμίνη.
Οξεία ή χρόνια μεταβολική οξέωση, συμπεριλαμβανομένης της διαβητικής κετοξέωσης, με ή χωρίς κώμα. Η διαβητική κετοξέωση πρέπει να αντιμετωπίζεται με ινσουλίνη.
Το Glucophage και το Glucophage XR θα πρέπει να διακόπτονται προσωρινά σε ασθενείς που υποβάλλονται σε ακτινολογικές μελέτες που περιλαμβάνουν η ενδοαγγειακή χορήγηση ιωδιωμένων υλικών αντίθεσης, επειδή η χρήση τέτοιων προϊόντων μπορεί να οδηγήσει σε οξεία αλλοίωση του νεφρική λειτουργία. (Δείτε επίσης ΠΡΟΦΥΛΑΞΕΙΣ.)
μπλουζα
Προειδοποιήσεις
Γαλακτική οξείδωση:
Η γαλακτική οξέωση είναι μια σπάνια αλλά σοβαρή μεταβολική επιπλοκή που μπορεί να συμβεί λόγω συσσώρευσης μετφορμίνης κατά τη διάρκεια της θεραπείας με Glucophage ή Glucophage XR. όταν συμβαίνει, είναι θανατηφόρο σε περίπου 50% των περιπτώσεων. Η γαλακτική οξέωση μπορεί επίσης να συμβεί σε συνδυασμό με μια σειρά παθοφυσιολογικών καταστάσεων, συμπεριλαμβανομένου του σακχαρώδους διαβήτη, και κάθε φορά που υπάρχει σημαντική υπο-διήθηση ιστού και υποξαιμία. Η γαλακτική οξέωση χαρακτηρίζεται από αυξημένα επίπεδα γαλακτικού αίματος (> 5 mmol / L), μειωμένο pH αίματος, διαταραχές ηλεκτρολυτών με αυξημένο χάσμα ανιόντων και αυξημένη αναλογία γαλακτικού / πυροσταφυλικού. Όταν η μετφορμίνη εμπλέκεται ως η αιτία της γαλακτικής οξέωσης, τα επίπεδα της μετφορμίνης στο πλάσμα> 5 μg / mL γενικά βρίσκονται.
Η συχνότητα εμφάνισης της γαλακτικής οξέωσης σε ασθενείς που λαμβάνουν υδροχλωρική μετφορμίνη είναι πολύ χαμηλή (περίπου 0,03 περιπτώσεις / 1000 ασθενείς-έτη, με περίπου 0,015 θανατηφόρες περιπτώσεις / 1000 έτη ασθενών). Σε περισσότερες από 20.000 ασθενείς-έτη έκθεσης στη μετφορμίνη σε κλινικές δοκιμές, δεν υπήρξαν αναφορές γαλακτικής οξέωσης. Οι αναφερθείσες περιπτώσεις εμφανίστηκαν κυρίως σε διαβητικούς ασθενείς με σημαντική νεφρική ανεπάρκεια, συμπεριλαμβανομένων και των δύο ενδογενών νεφρών της νόσου και της νεφρικής υποπερατότητας, συχνά στη ρύθμιση πολλαπλών ταυτόχρονων ιατρικών / χειρουργικών προβλημάτων και πολλαπλών συνακόλουθων φάρμακα. Ασθενείς με συμφορητική καρδιακή ανεπάρκεια που απαιτούν φαρμακολογική διαχείριση, ιδίως εκείνοι με ασταθή ή οξεία συμφορητική καρδιακή ανεπάρκεια, οι οποίοι κινδυνεύουν από υποδιήθηση και υποξαιμία, διατρέχουν αυξημένο κίνδυνο να παρουσιάσουν γαλακτική αλκαλική ύφεσις αίματος. Ο κίνδυνος γαλακτικής οξέωσης αυξάνεται με το βαθμό νεφρικής δυσλειτουργίας και την ηλικία του ασθενούς. Ως εκ τούτου, ο κίνδυνος γαλακτικής οξέωσης μπορεί να μειωθεί σημαντικά με την τακτική παρακολούθηση της νεφρικής λειτουργίας στο ασθενείς που λαμβάνουν Glucophage ή Glucophage XR και με τη χρήση της ελάχιστης αποτελεσματικής δόσης του Glucophage ή του Glucophage XR. Ειδικότερα, η θεραπεία των ηλικιωμένων πρέπει να συνοδεύεται από προσεκτική παρακολούθηση της νεφρικής λειτουργίας. Η θεραπεία με Glucophage ή Glucophage XR δεν πρέπει να ξεκινά σε ασθενείς ηλικίας ≥ 80 ετών εκτός εάν η μέτρηση της κρεατινίνης η κάθαρση αποδεικνύει ότι η νεφρική λειτουργία δεν μειώνεται, καθώς αυτοί οι ασθενείς είναι πιο ευάλωτοι στην ανάπτυξη γαλακτικού οξέος αλκαλική ύφεσις αίματος. Επιπλέον, τα Glucophage και το Glucophage XR πρέπει να παρακρατούνται αμέσως, υπό την παρουσία οποιασδήποτε κατάστασης που σχετίζεται με υποξαιμία, αφυδάτωση ή σήψη. Επειδή η εξασθενημένη ηπατική λειτουργία μπορεί να περιορίσει σημαντικά την ικανότητα καθαρισμού του γαλακτικού, Glucophage και Glucophage Το Glucophage XR πρέπει γενικά να αποφεύγεται σε ασθενείς με κλινικές ή εργαστηριακές ενδείξεις ηπατικής νόσος. Οι ασθενείς θα πρέπει να προειδοποιούνται για την υπερβολική πρόσληψη αλκοόλ, είτε οξείες είτε χρόνιες, κατά τη λήψη Glucophage ή Glucophage XR, δεδομένου ότι το αλκοόλ ενισχύει τις επιδράσεις της υδροχλωρικής μετφορμίνης στο γαλακτικό μεταβολισμός. Επιπλέον, το Glucophage και το Glucophage XR θα πρέπει να διακόπτονται προσωρινά πριν από οποιαδήποτε ενδοαγγειακή μελέτη ραδιοσυχνότητας και για οποιαδήποτε χειρουργική επέμβαση (βλέπε επίσης ΠΡΟΦΥΛΑΞΕΙΣ).
Η εμφάνιση γαλακτικής οξέωσης συχνά είναι λεπτή και συνοδεύεται μόνο από μη ειδικά συμπτώματα όπως αίσθημα κακουχίας, μυαλγίες, αναπνευστική δυσχέρεια, αυξημένη υπνηλία και μη ειδική κοιλιακή δυσφορία. Μπορεί να υπάρχει σχετική υποθερμία, υπόταση και ανθεκτικές βραδυαρρυθμίες με πιο έντονη οξέωση. Ο ασθενής και ο γιατρός του ασθενούς πρέπει να γνωρίζουν την πιθανή σημασία αυτών των συμπτωμάτων και ο ασθενής θα πρέπει να ενημερώνεται αμέσως για να ενημερώσει τον ιατρό εάν παρουσιαστούν (βλ. Επίσης ΠΡΟΦΥΛΑΞΕΙΣ). Το Glucophage και το Glucophage XR θα πρέπει να αποσυρθούν μέχρι να διευκρινιστεί η κατάσταση. Οι ηλεκτρολύτες στον ορό, οι κετόνες, η γλυκόζη στο αίμα και, εάν ενδείκνυται, το pH του αίματος, τα επίπεδα γαλακτικού οξέος και ακόμη και τα επίπεδα μετφορμίνης στο αίμα μπορεί να είναι χρήσιμα. Μόλις ο ασθενής σταθεροποιηθεί σε οποιοδήποτε επίπεδο δόσης του Glucophage ή του Glucophage XR, τα γαστρεντερικά συμπτώματα, τα οποία είναι κοινά κατά την έναρξη της θεραπείας, είναι απίθανο να σχετίζονται με το φάρμακο. Η μεταγενέστερη εμφάνιση γαστρεντερικών συμπτωμάτων μπορεί να οφείλεται σε γαλακτική οξέωση ή άλλη σοβαρή νόσο.
Επίπεδα φλεβικού γαλακτικού πλάσματος νηστείας πάνω από το ανώτερο φυσιολογικό όριο, αλλά κάτω από 5 mmol / L σε ασθενείς που λαμβάνουν Glucophage ή Glucophage XR δεν υποδεικνύουν κατ 'ανάγκη επικείμενη γαλακτική οξέωση και μπορεί να εξηγηθεί από άλλους μηχανισμούς, όπως ο κακώς ελεγχόμενος διαβήτης ή η παχυσαρκία, η έντονη σωματική δραστηριότητα ή τα τεχνικά προβλήματα στο δείγμα Χειρισμός, ή Αντιμετώπιση. (Δείτε επίσης ΠΡΟΦΥΛΑΞΕΙΣ.)
Θα πρέπει να υπάρχει υποψία γαλακτικής οξέωσης σε οποιονδήποτε διαβητικό ασθενή με μεταβολική οξέωση χωρίς στοιχεία κετοξέωσης (κετονουρία και κετοναιμία).
Η γαλακτική οξέωση είναι ιατρική κατάσταση που πρέπει να αντιμετωπιστεί σε νοσοκομειακό περιβάλλον. Σε έναν ασθενή με γαλακτική οξέωση που παίρνει το Glucophage ή το Glucophage XR, το φάρμακο θα πρέπει να διακόπτεται αμέσως και να λαμβάνονται αμέσως γενικά υποστηρικτικά μέτρα. Επειδή η υδροχλωρική μετφορμίνη είναι διαλυτή (με κάθαρση μέχρι 170 mL / min υπό καλή αιμοδυναμική συνθήκες), συνιστάται η ταχεία αιμοδιύλιση για να διορθωθεί η οξέωση και να απομακρυνθεί η συσσωρευμένη μετφορμίνη. Μια τέτοια διαχείριση συχνά έχει ως αποτέλεσμα την άμεση αντιστροφή των συμπτωμάτων και την ανάκαμψη. (Δείτε επίσης ΑΝΤΕΝΔΕΙΞΕΙΣ και ΠΡΟΦΥΛΑΞΕΙΣ.)
μπλουζα
Προφυλάξεις
Γενικός
Μακροαγγειακά αποτελέσματα - Δεν υπήρξαν κλινικές μελέτες που να αποδεικνύουν την ύπαρξη τεκμηριωμένων ενδείξεων για μείωση του μακροαγγειακού κινδύνου με Glucophage ή Glucophage XR ή οποιοδήποτε άλλο αντιδιαβητικό φάρμακο.
Παρακολούθηση της νεφρικής λειτουργίας - Η μετφορμίνη είναι γνωστό ότι ουσιαστικά απεκκρίνεται από τα νεφρά και το ο κίνδυνος συσσώρευσης μετφορμίνης και η γαλακτική οξέωση αυξάνεται με τον βαθμό της νεφρικής ανεπάρκειας λειτουργία. Έτσι, οι ασθενείς με επίπεδα κρεατινίνης ορού πάνω από το ανώτερο φυσιολογικό όριο για την ηλικία τους δεν πρέπει να λαμβάνουν Glucophage ή Glucophage XR. Σε ασθενείς με προχωρημένη ηλικία, το Glucophage και το Glucophage XR πρέπει να τιτλοφορούνται προσεκτικά για να καθοριστούν η ελάχιστη δόση για επαρκή γλυκαιμική δράση, επειδή η γήρανση σχετίζεται με μειωμένη νεφρική λειτουργία λειτουργία. Σε ηλικιωμένους ασθενείς, ιδιαίτερα σε ηλικίες ≥ 80 ετών, η νεφρική λειτουργία πρέπει να παρακολουθείται τακτικά και γενικά τα Glucophage και Glucophage XR δεν πρέπει να τιτλοδοτούνται στη μέγιστη δόση (βλ. ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ και ΔΟΣΟΛΟΓΙΑ ΚΑΙ ΧΟΡΗΓΗΣΗ).
Πριν από την έναρξη της θεραπείας με Glucophage ή Glucophage XR και τουλάχιστον ετησίως στη συνέχεια, η νεφρική λειτουργία θα πρέπει να αξιολογείται και να επαληθεύεται κανονικά. Σε ασθενείς στους οποίους αναμένεται ανάπτυξη νεφρικής δυσλειτουργίας, θα πρέπει να αξιολογηθεί η νεφρική λειτουργία πιο συχνά και το Glucophage ή το Glucophage XR σταμάτησαν εάν υπάρχουν ενδείξεις νεφρικής ανεπάρκειας παρόν.
Χρήση συγχορηγούμενων φαρμάκων που μπορεί να επηρεάσουν τη νεφρική λειτουργία ή τη διάθεση της μετφορμίνης - Συγχορηγούμενα φάρμακα που μπορεί να επηρεάσουν τη νεφρική λειτουργία ή να οδηγήσουν σε σημαντική αιμοδυναμική αλλαγή ή μπορεί να επηρεάσει τη διάθεση της μετφορμίνης, όπως τα κατιονικά φάρμακα που αποβάλλονται από τη νεφρική σωληναριακή έκκριση (βλ. ΠΡΟΦΥΛΑΞΕΙΣ: Αλληλεπιδράσεις φαρμάκων), θα πρέπει να χρησιμοποιείται με προσοχή.
Ακτινολογικές μελέτες που αφορούν τη χρήση ενδοαγγειακών ιωδιωμένων υλικών αντίθεσης (για παράδειγμα, ενδοφλέβια ουρογράμματα, ενδοφλέβια χολοangiography, αγγειογραφία και αξονική τομογραφία (CT) σαρώνει με ενδοαγγειακά υλικά αντίθεσης) - Μελέτες ενδοκρασικής αντίθεσης με τα ιωδιωμένα υλικά μπορούν να οδηγήσουν σε οξεία αλλοίωση της νεφρικής λειτουργίας και έχουν συσχετιστεί με γαλακτική οξέωση σε ασθενείς που λαμβάνουν μετφορμίνη (βλ ΑΝΤΕΝΔΕΙΞΕΙΣ). Συνεπώς, σε ασθενείς στους οποίους σχεδιάζεται οποιαδήποτε τέτοια μελέτη, το Glucophage ή το Glucophage XR θα πρέπει να διακόπτεται προσωρινά κατά την διαδικασία και παρακρατήθηκε για 48 ώρες μετά τη διαδικασία και επανεντάχθηκε μόνο αφού η νεφρική λειτουργία επανεξετασθεί και κανονικός.
Υποξικές καταστάσεις - Καρδιαγγειακή κατάρρευση (σοκ) από οποιαδήποτε αιτία, οξεία συμφορητική καρδιακή ανεπάρκεια, οξεία μυοκαρδία το έμφραγμα και άλλες καταστάσεις που χαρακτηρίζονται από υποξαιμία έχουν συσχετιστεί με γαλακτική οξέωση και μπορεί επίσης να προκαλέσουν πρενεναζόλη. Όταν συμβαίνουν τέτοια συμβάντα σε ασθενείς με θεραπεία με Glucophage ή Glucophage XR, το φάρμακο πρέπει να διακοπεί αμέσως.
Χειρουργικές επεμβάσεις - Η θεραπεία με Glucophage ή Glucophage XR θα πρέπει να διακόπτεται προσωρινά για οποιαδήποτε χειρουργική επέμβαση (εκτός από τις μικρές με περιορισμένη πρόσληψη τροφής και υγρών) και δεν θα πρέπει να ξεκινάει πάλι έως ότου η στοματική λήψη του ασθενούς επαναληφθεί και η νεφρική λειτουργία έχει αξιολογηθεί ως κανονικός.
Η πρόσληψη αλκοόλ-αλκοόλ είναι γνωστό ότι ενισχύει την επίδραση της μετφορμίνης στον μεταβολισμό του γαλακτικού οξέος. Συνεπώς, οι ασθενείς θα πρέπει να προειδοποιούνται για υπερβολική πρόσληψη αλκοόλ, οξεία ή χρόνια, ενώ λαμβάνουν Glucophage ή Glucophage XR.
Διαταραγμένη ηπατική λειτουργία - Επειδή η μειωμένη ηπατική λειτουργία έχει συσχετιστεί με κάποιες περιπτώσεις γαλακτικής οξέωσης, Το Glucophage και το Glucophage XR πρέπει γενικά να αποφεύγονται σε ασθενείς με κλινικές ή εργαστηριακές ενδείξεις ηπατικής νόσος.
Επίπεδα βιταμίνης Β12-Σε ελεγχόμενες κλινικές δοκιμές του Glucophage διάρκειας 29 εβδομάδων, παρατηρήθηκε μείωση των υπο-φυσιολογικών επιπέδων προηγούμενα φυσιολογικά επίπεδα βιταμίνης Β12 στον ορό, χωρίς κλινικές εκδηλώσεις, παρατηρήθηκαν σε περίπου 7% ασθενείς. Μία τέτοια μείωση, πιθανώς λόγω παρεμβολής με την απορρόφηση Β12 από το σύμπλοκο Β12-ενδογενούς παράγοντα, είναι, ωστόσο, πολύ σπάνια σχετίζεται με αναιμία και φαίνεται να είναι ταχέως αναστρέψιμη με διακοπή του Glucophage ή της βιταμίνης Β12 συμπλήρωση. Η μέτρηση των αιματολογικών παραμέτρων σε ετήσια βάση συνιστάται σε ασθενείς με Glucophage ή Glucophage XR και οι προφανείς ανωμαλίες πρέπει να διερευνηθούν και να αντιμετωπιστούν κατάλληλα (βλ. ΠΡΟΦΥΛΑΞΕΙΣ: Εργαστηριακές δοκιμές).
Ορισμένα άτομα (εκείνα με ανεπαρκή λήψη βιταμίνης Β12 ή πρόσληψη ασβεστίου ή απορρόφηση) φαίνεται να έχουν προδιάθεση να αναπτύξουν υποβρύχια επίπεδα βιταμίνης Β12. Σε αυτούς τους ασθενείς, μπορεί να είναι χρήσιμες οι συνήθεις μετρήσεις βιταμίνης Β12 στον ορό σε διαστήματα 2 έως 3 ετών.
Αλλαγή της κλινικής κατάστασης των ασθενών με προηγουμένως ελεγχόμενο διαβήτη τύπου 2 - Ένας ασθενής με διαβήτη τύπου 2 προηγουμένως καλά ελεγχόμενος σε Glucophage ή Glucophage XR που αναπτύσσουν εργαστηριακές ανωμαλίες ή κλινικές ασθένειες (ιδιαίτερα ασαφείς και κακώς καθορισμένες ασθένειες) πρέπει να αξιολογούνται έγκαιρα για ενδείξεις κετοξέωσης ή γαλακτικού αλκαλική ύφεσις αίματος. Η αξιολόγηση θα πρέπει να περιλαμβάνει ηλεκτρολύτες και κετόνες ορού, γλυκόζη αίματος και, εάν ενδείκνυται, επίπεδα ρΗ στο αίμα, γαλακτικό, πυροσταφυλικό και μετφορμίνη. Εάν παρουσιαστεί οξέωση οποιασδήποτε μορφής, το Glucophage ή το Glucophage XR πρέπει να σταματήσουν αμέσως και να ξεκινήσουν άλλα κατάλληλα διορθωτικά μέτρα (βλέπε επίσης ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ).
Υπογλυκαιμία-Η υπογλυκαιμία δεν εμφανίζεται σε ασθενείς που λαμβάνουν μόνο το Glucophage ή το Glucophage XR υπό συνήθεις συνθήκες χρήσης, αλλά μπορεί να εμφανιστεί όταν η πρόσληψη θερμίδων είναι όταν η έντονη άσκηση δεν αντισταθμίζεται με θερμιδική συμπλήρωση ή κατά τη διάρκεια ταυτόχρονης χρήσης με άλλους παράγοντες μείωσης της γλυκόζης (όπως οι σουλφονυλουρίες και η ινσουλίνη) ή αιθανόλη.
Οι ηλικιωμένοι, οι εξασθενημένοι ή οι υποσιτισμένοι ασθενείς και οι ασθενείς με ανεπάρκεια επινεφριδίων ή υπόφυσης ή δηλητηρίαση με οινόπνευμα είναι ιδιαίτερα ευαίσθητοι σε υπογλυκαιμικά αποτελέσματα. Η υπογλυκαιμία μπορεί να είναι δύσκολο να αναγνωριστεί στους ηλικιωμένους και σε άτομα που λαμβάνουν β-αδρενεργικά φάρμακα αποκλεισμού.
Απώλεια ελέγχου της γλυκόζης στο αίμα - Όταν ένας ασθενής σταθεροποιημένος σε οποιοδήποτε διαβητικό σχήμα εκτίθεται σε άγχος όπως πυρετός, τραύμα, λοίμωξη ή χειρουργική επέμβαση, μπορεί να εμφανιστεί προσωρινή απώλεια γλυκαιμικού ελέγχου. Σε τέτοιες περιπτώσεις μπορεί να χρειαστεί να παρακρατήσετε το Glucophage ή το Glucophage XR και να χορηγήσετε προσωρινά ινσουλίνη. Το Glucophage ή το Glucophage XR μπορεί να επαναληφθεί μετά την επίλυση του οξειδαινού επεισοδίου.
Η αποτελεσματικότητα των από του στόματος αντιδιαβητικών φαρμάκων στη μείωση της γλυκόζης αίματος σε ένα στοχοθετημένο επίπεδο μειώνεται σε πολλούς ασθενείς σε μια χρονική περίοδο. Το φαινόμενο αυτό, το οποίο μπορεί να οφείλεται στην εξέλιξη της υποκείμενης νόσου ή στη μειωμένη ανταπόκριση στο φάρμακο, είναι γνωστή ως δευτερογενής αποτυχία, να την διακρίνει από την πρωτογενή αποτυχία στην οποία το φάρμακο είναι αναποτελεσματικό κατά την αρχική θεραπεία. Εάν παρατηρηθεί δευτερογενής αποτυχία είτε με μονοθεραπεία Glucophage είτε με Glucophage XR ή με σουλφονυλουρία, η συνδυασμένη θεραπεία με Glucophage ή Glucophage XR και σουλφονυλουρία μπορεί να προκαλέσει απόκριση. Εάν εμφανιστεί δευτερογενής αποτυχία με συνδυασμένη θεραπεία με Glucophage / σουλφονυλουρία ή Glucophage XR / θεραπεία με σουλφονυλουρία, μπορεί να χρειαστεί να εξεταστούν θεραπευτικές εναλλακτικές λύσεις, συμπεριλαμβανομένης της έναρξης ινσουλινοθεραπεία.
Πληροφορίες για τους ασθενείς
Οι ασθενείς θα πρέπει να ενημερώνονται για τους πιθανούς κινδύνους και οφέλη του Glucophage ή του Glucophage XR και εναλλακτικών τρόπων θεραπείας. Θα πρέπει επίσης να ενημερώνονται για τη σημασία της τήρησης των διατροφικών οδηγιών, μιας τακτικής άσκησης πρόγραμμα, καθώς και τακτικές εξετάσεις γλυκόζης στο αίμα, γλυκοζυλιωμένη αιμοσφαιρίνη, νεφρική λειτουργία και αιματολογική Παράμετροι.
Οι κίνδυνοι της γαλακτικής οξέωσης, τα συμπτώματά της και οι συνθήκες που προδιαθέτουν στην ανάπτυξή της, όπως αναφέρεται στο ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ και ΠΡΟΦΥΛΑΞΕΙΣ πρέπει να εξηγούνται στους ασθενείς. Οι ασθενείς θα πρέπει να ενημερώνονται αμέσως για τη διακοπή της χορήγησης του Glucophage ή του Glucophage XR και για την ταχεία γνωστοποίηση της υγείας τους εάν υπάρχει ανεξήγητος υπεραερισμός, μυαλγία, κακουχία, ασυνήθιστη υπνηλία ή άλλα μη ειδικά συμπτώματα συμβούν. Μόλις ο ασθενής σταθεροποιηθεί σε οποιοδήποτε επίπεδο δόσης του Glucophage ή του Glucophage XR, τα γαστρεντερικά συμπτώματα, τα οποία είναι κοινά κατά την έναρξη της θεραπείας με μετφορμίνη, είναι απίθανο να σχετίζονται με το φάρμακο. Η μεταγενέστερη εμφάνιση γαστρεντερικών συμπτωμάτων μπορεί να οφείλεται σε γαλακτική οξέωση ή άλλη σοβαρή νόσο.
Οι ασθενείς θα πρέπει να συμβουλεύονται την υπερβολική πρόσληψη αλκοόλ, είτε οξεία είτε χρόνια, ενώ λαμβάνουν Glucophage ή Glucophage XR.
Το Glucophage ή το Glucophage XR μόνο δεν προκαλούν συνήθως υπογλυκαιμία, αν και μπορεί να συμβεί όταν το Glucophage ή το Glucophage XR χρησιμοποιούνται σε συνδυασμό με από του στόματος σουλφονυλουρίες και ινσουλίνη. Κατά την έναρξη της θεραπείας συνδυασμού, οι κίνδυνοι της υπογλυκαιμίας, τα συμπτώματα και η θεραπεία της, και οι συνθήκες που προδιαθέτουν στην ανάπτυξή του θα πρέπει να εξηγούνται στους ασθενείς και στην υπεύθυνη οικογένεια μελών.
Οι ασθενείς θα πρέπει να ενημερώνονται ότι το Glucophage XR πρέπει να καταπίπτει ολόκληρο και να μην συνθλίβεται ή να τα αδρανή συστατικά μπορεί περιστασιακά να εξαλειφθούν στα κόπρανα ως μια μαλακή μάζα που μπορεί να μοιάζει με το πρωτότυπο δισκίο.
Εργαστηριακές δοκιμές
Η απόκριση σε όλες τις διαβητικές θεραπείες θα πρέπει να παρακολουθείται με περιοδικές μετρήσεις του αίματος νηστείας γλυκόζης και επίπεδα γλυκοζυλιωμένης αιμοσφαιρίνης, με στόχο τη μείωση αυτών των επιπέδων προς το φυσιολογικό εύρος. Κατά τη διάρκεια της αρχικής τιτλοποίησης της δόσης, η γλυκόζη νηστείας μπορεί να χρησιμοποιηθεί για τον προσδιορισμό της θεραπευτικής ανταπόκρισης. Στη συνέχεια, θα πρέπει να παρακολουθούνται τόσο η γλυκόζη όσο και η γλυκοζυλιωμένη αιμοσφαιρίνη. Οι μετρήσεις της γλυκοσυλιωμένης αιμοσφαιρίνης μπορεί να είναι ιδιαίτερα χρήσιμες για την αξιολόγηση του μακροπρόθεσμου ελέγχου (βλέπε επίσης ΔΟΣΟΛΟΓΙΑ ΚΑΙ ΧΟΡΗΓΗΣΗ).
Αρχική και περιοδική παρακολούθηση των αιματολογικών παραμέτρων (π.χ. αιμοσφαιρίνη / αιματοκρίτης και ερυθρό αίμα κυτταρικοί δείκτες) και τη νεφρική λειτουργία (κρεατινίνη ορού), τουλάχιστον σε ετήσια βάση. Ενώ η σπειραματοναιμία έχει σπάνια παρατηρηθεί με τη θεραπεία με Glucophage, αν υπάρχει υποψία, η ανεπάρκεια της βιταμίνης Β12 πρέπει να αποκλειστεί.
Αλληλεπιδράσεις φαρμάκων (κλινική αξιολόγηση των αλληλεπιδράσεων φαρμάκων που διεξάγονται με Glucophage)
Γλυβουρίδη - Σε μια μελέτη αλληλεπίδρασης μίας δόσης σε ασθενείς με διαβήτη τύπου 2, συγχορήγηση του η μετφορμίνη και η γλυβουρίδη δεν οδήγησαν σε μεταβολές ούτε στη φαρμακοκινητική της μετφορμίνης ούτε στη φαρμακοκινητική της μετφορμίνης φαρμακοδυναμική. Μειώθηκαν οι AUC και Cmax της γλυβουρίδης, αλλά ήταν πολύ μεταβλητές. Η φύση της μεμονωμένης δόσης αυτής της μελέτης και η έλλειψη συσχέτισης μεταξύ των επιπέδων γλυβουρίδης στο αίμα και των φαρμακοδυναμικών επιδράσεων, καθιστούν αβέβαιη την κλινική σημασία αυτής της αλληλεπίδρασης (βλ. ΔΟΣΟΛΟΓΙΑ ΚΑΙ ΧΟΡΗΓΗΣΗ: Συγχρόνως Glucophage ή Glucophage XR και θεραπεία με σουλφονυλουρία από το στόμα σε ενήλικες ασθενείς).
Φουροσεμίδη - Μία μελέτη αλληλεπίδρασης με μια δόση μεθοφορμίνης-φουροσεμίδης σε υγιή άτομα κατέδειξε ότι οι φαρμακοκινητικές παράμετροι και των δύο ενώσεων επηρεάστηκαν από τη συγχορήγηση. Η φουροσεμίδη αύξησε τη Cmax του πλάσματος και του αίματος της μετφορμίνης κατά 22% και την AUC του αίματος κατά 15%, χωρίς σημαντική αλλαγή στη νεφρική κάθαρση της μετφορμίνης. Όταν χορηγήθηκε με μετφορμίνη, η Cmax και η AUC της φουροσεμίδης ήταν 31% και 12% μικρότερα, αντίστοιχα, από ό, τι όταν χορηγήθηκε μόνη της και ο τελικός χρόνος ημιζωής μειώθηκε κατά 32%, χωρίς σημαντική μεταβολή στο νεφρικό φουροσεμίδιο εκτελωνισμός. Δεν υπάρχουν διαθέσιμες πληροφορίες σχετικά με την αλληλεπίδραση της μετφορμίνης και της φουροσεμίδης όταν συγχορηγούνται χρονικά.
Μελέτη αλληλεπίδρασης με νιφεδιπίνη-Μια μεμονωμένη δόση, μετφορμίνη-νιφεδιπίνη σε φυσιολογικούς υγιείς εθελοντές η συγχορήγηση της νιφεδιπίνης αύξησε τη Cmax και την AUC της μετφορμίνης στο πλάσμα κατά 20% και 9% αντίστοιχα και αύξησε την ποσότητα αποβάλλεται στα ούρα. Η Tmax και ο χρόνος ημίσειας ζωής δεν επηρεάστηκαν. Η νιφεδιπίνη φαίνεται να ενισχύει την απορρόφηση της μετφορμίνης. Η μετφορμίνη είχε ελάχιστες επιδράσεις στη νιφεδιπίνη.
Κατιονικά φάρμακα - Κατιονικά φάρμακα (π.χ., αμιλορίδη, διγοξίνη, μορφίνη, προκαϊναμίδη, κινιδίνη, κινίνη, ρανιτιδίνη, τριαμτερένη, τριμεθοπρίμη ή βανκομυκίνη) που εξαλείφονται με νεφρική σωληναριακή έκκριση, θεωρητικά έχουν τη δυνατότητα αλληλεπίδρασης με μετφορμίνη ανταγωνιζόμενοι για κοινή νεφρική σωληναριακή μεταφορά συστήματα. Αυτή η αλληλεπίδραση μεταξύ της μετφορμίνης και της από του στόματος σιμετιδίνης έχει παρατηρηθεί σε φυσιολογικούς υγιείς εθελοντές τόσο σε μονο- όσο και σε πολλαπλές δόσεις μετφορμίνη-σιμετιδίνη με μελέτες αλληλεπίδρασης με φάρμακα, με αύξηση κατά 60% των συγκεντρώσεων στο πλάσμα της μετφορμίνης στο πλάσμα και του πλήρους αίματος και με 40% αύξηση της μετφορμίνης στο πλάσμα και στο πλήρες αίμα AUC. Δεν παρατηρήθηκε καμία αλλαγή στον χρόνο ημίσειας ζωής αποβολής στη μελέτη μιας δόσης. Η μετφορμίνη δεν είχε καμία επίδραση στη φαρμακοκινητική της σιμετιδίνης. Παρόλο που αυτές οι αλληλεπιδράσεις παραμένουν θεωρητικές (εκτός από τη σιμετιδίνη), η προσεκτική παρακολούθηση από τον ασθενή και η προσαρμογή της δόσης του Glucophage ή του Glucophage XR και / ή το παρεμβαίνον φάρμακο συνιστάται σε ασθενείς που λαμβάνουν κατιονικά φάρμακα που απεκκρίνονται μέσω του κεντρικού νεφρικού σωληναριακού εκκρίματος Σύστημα.
Άλλα - Ορισμένα φάρμακα τείνουν να παράγουν υπεργλυκαιμία και μπορεί να οδηγήσουν σε απώλεια γλυκαιμικού ελέγχου. Αυτά τα φάρμακα περιλαμβάνουν τις θειαζίδες και άλλα διουρητικά, κορτικοστεροειδή, φαινοθειαζίνες, προϊόντα θυρεοειδούς, οιστρογόνα, από του στόματος αντισυλληπτικά, φαινυτοΐνη, νικοτινικό οξύ, συμπαθομιμητικά, φάρμακα αποκλεισμού διαύλων ασβεστίου και ισονιαζίδη. Όταν τέτοια φάρμακα χορηγούνται σε ασθενή που λαμβάνει Glucophage ή Glucophage XR, ο ασθενής θα πρέπει να παρακολουθείται στενά για απώλεια ελέγχου γλυκόζης στο αίμα. Όταν τα φάρμακα αυτά αποσύρονται από ασθενή που λαμβάνει Glucophage ή Glucophage XR, ο ασθενής θα πρέπει να παρακολουθείται στενά για υπογλυκαιμία.
Σε υγιείς εθελοντές, οι φαρμακοκινητικές ιδιότητες της μετφορμίνης και της προπρανολόλης και της μετφορμίνης και της ιβουπροφαίνης δεν επηρεάστηκαν όταν συγχορηγήθηκαν σε μελέτες αλληλεπιδράσεων μίας δόσης.
Η μετφορμίνη δεσμεύεται αμελητέα στις πρωτεΐνες του πλάσματος και είναι επομένως λιγότερο πιθανό να αλληλεπιδράσει με φάρμακα που συνδέονται σε μεγάλο βαθμό με πρωτεΐνες όπως το σαλικυλικά, σουλφοναμίδια, χλωραμφενικόλη και προβενεσίδη, σε σύγκριση με τις σουλφονυλουρίες, οι οποίες συνδέονται εκτεταμένα με τον ορό πρωτεΐνες.
Καρκινογένεση, Μεταλλαξογένεση, Βλάβη της Γονιμότητας
Έχουν διεξαχθεί μακροχρόνιες μελέτες καρκινογένεσης σε αρουραίους (δόση 104 εβδομάδων) και ποντίκια (διάρκεια δοσολόγησης 91 εβδομάδων) σε δόσεις μέχρι και 900 mg / kg / ημέρα και 1500 mg / kg / ημέρα, αντίστοιχα. Αυτές οι δόσεις είναι περίπου 4 φορές μεγαλύτερη από τη μέγιστη συνιστώμενη ανθρώπινη ημερήσια δόση των 2000 mg με βάση τις συγκρίσεις επιφάνειας σώματος. Δεν βρέθηκαν στοιχεία καρκινογένεσης με μετφορμίνη σε αρσενικούς ή θηλυκούς ποντικούς. Παρομοίως, δεν παρατηρήθηκε ογκογονικό δυναμικό με μετφορμίνη σε αρσενικούς αρουραίους. Υπήρχε, ωστόσο, αυξημένη συχνότητα εμφάνισης καλοήθων πολυπόδων στρωματικής μήτρας σε θηλυκούς αρουραίους που έλαβαν θεραπεία με 900 mg / kg / ημέρα.
Δεν υπήρξαν ενδείξεις μεταλλαξιογόνου δυναμικού της μετφορμίνης στις ακόλουθες in vitro δοκιμασίες: Δοκιμή Ames (S. typhimurium), εξέταση γονιδιακής μετάλλαξης (κύτταρα λεμφώματος ποντικού) ή δοκιμασία χρωμοσωμικών εκτροπών (ανθρώπινα λεμφοκύτταρα). Τα αποτελέσματα στην in vivo δοκιμή μικροπυρήνων ποντικού ήταν επίσης αρνητικά.
Η γονιμότητα αρσενικών ή θηλυκών αρουραίων δεν επηρεάστηκε από τη μετφορμίνη όταν χορηγήθηκε σε δόσεις τόσο υψηλές όσο 600 mg / kg / ημέρα, που είναι περίπου τριπλάσια της μέγιστης συνιστώμενης ανθρώπινης ημερήσιας δόσης με βάση την επιφάνεια του σώματος συγκρίσεις.
Εγκυμοσύνη
Τερατογόνες επιδράσεις: Κατηγορία εγκυμοσύνης Β
Οι πρόσφατες πληροφορίες δείχνουν έντονα ότι τα ανώμαλα επίπεδα γλυκόζης στο αίμα κατά τη διάρκεια της εγκυμοσύνης σχετίζονται με υψηλότερη συχνότητα συγγενών ανωμαλιών. Οι περισσότεροι ειδικοί συστήνουν να χρησιμοποιείται ινσουλίνη κατά τη διάρκεια της εγκυμοσύνης για τη διατήρηση των επιπέδων γλυκόζης στο αίμα όσο το δυνατόν πιο κοντά στο φυσιολογικό. Επειδή οι μελέτες αναπαραγωγής σε ζώα δεν είναι πάντοτε προγνωστικές για την ανταπόκριση του ανθρώπου, το Glucophage και το Glucophage XR δεν πρέπει να χρησιμοποιούνται κατά τη διάρκεια της εγκυμοσύνης, εκτός εάν είναι σαφώς απαραίτητο.
Δεν υπάρχουν επαρκείς και καλά ελεγχόμενες μελέτες σε έγκυες γυναίκες με Glucophage ή Glucophage XR. Η μετφορμίνη δεν ήταν τερατογόνος σε αρουραίους και κουνέλια σε δόσεις μέχρι 600 mg / kg / ημέρα. Αυτό αντιπροσωπεύει έκθεση περίπου 2 και 6 φορές τη μέγιστη συνιστώμενη ανθρώπινη ημερήσια δόση των 2000 mg με βάση συγκρίσεις επιφάνειας σώματος για αρουραίους και κουνέλια, αντίστοιχα. Ο προσδιορισμός των συγκεντρώσεων του εμβρύου έδειξε ένα μερικό φραγμό του πλακούντα στη μετφορμίνη.
Θηλάζουσες μητέρες
Μελέτες σε αρουραίους που θηλάζουν δείχνουν ότι η μετφορμίνη απεκκρίνεται στο γάλα και φτάνει επίπεδα συγκρίσιμα με εκείνα του πλάσματος. Παρόμοιες μελέτες δεν έχουν διεξαχθεί σε θηλάζουσες μητέρες. Επειδή μπορεί να υπάρχει το ενδεχόμενο υπογλυκαιμίας σε βρέφη που θηλάζουν, θα πρέπει να αποφασιστεί εάν να διακόψει τη νοσηλεία ή να διακόψει τη λήψη του φαρμάκου, λαμβάνοντας υπόψη τη σημασία του φαρμάκου για το φάρμακο μητέρα. Εάν διακοπεί η χορήγηση του Glucophage ή του Glucophage XR και εάν η δίαιτα είναι μόνο ανεπαρκής για τον έλεγχο της γλυκόζης στο αίμα, θα πρέπει να λαμβάνεται υπόψη η θεραπεία με ινσουλίνη.
Παιδιατρική χρήση
Η ασφάλεια και η αποτελεσματικότητα του Glucophage για τη θεραπεία του διαβήτη τύπου 2 έχουν καθιερωθεί το 2006 παιδιατρικοί ασθενείς ηλικίας 10 έως 16 ετών (μελέτες δεν έχουν διεξαχθεί σε παιδιατρικούς ασθενείς ηλικίας κάτω των 10 ετών έτη). Η χρήση του Glucophage σε αυτήν την ηλικιακή ομάδα υποστηρίζεται από στοιχεία από επαρκείς και καλά ελεγχόμενες μελέτες του Glucophage σε ενήλικες με πρόσθετα δεδομένα από ελεγχόμενη κλινική μελέτη σε παιδιατρικούς ασθενείς ηλικίας 10 έως 16 ετών με διαβήτη τύπου 2, η οποία κατέδειξε παρόμοια απόκριση στον γλυκαιμικό έλεγχο με αυτόν που παρατηρείται στο ενήλικες. (Βλέπω ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ: Παιδιατρικές κλινικές μελέτες.) Σε αυτή τη μελέτη, οι ανεπιθύμητες ενέργειες ήταν παρόμοιες με εκείνες που περιγράφηκαν στους ενήλικες. (Βλέπω ΑΝΕΠΙΘΥΜΗΤΕΣ ΕΝΕΡΓΕΙΕΣ: Παιδιατρικοί ασθενείς.) Συνιστάται μέγιστη ημερήσια δόση 2000 mg. (Βλέπω ΔΟΣΟΛΟΓΙΑ ΚΑΙ ΧΟΡΗΓΗΣΗ: Προτεινόμενο Πρόγραμμα Χορήγησης: Παιδιατρική.)
Η ασφάλεια και η αποτελεσματικότητα του Glucophage XR σε παιδιατρικούς ασθενείς δεν έχουν τεκμηριωθεί.
Γηριατρική χρήση
Οι ελεγχόμενες κλινικές μελέτες του Glucophage και του Glucophage XR δεν περιλάμβαναν επαρκή αριθμό ηλικιωμένων ασθενών για να προσδιορίσουν εάν ανταποκρίνονται διαφορετικά από τους νεότερους ασθενείς, παρόλο που άλλη αναφερθείσα κλινική εμπειρία δεν έχει εντοπίσει διαφορές στις αντιδράσεις μεταξύ των ηλικιωμένων και των νεότερων ασθενείς. Η μετφορμίνη είναι γνωστό ότι εκκρίνεται ουσιαστικά από τους νεφρούς και επειδή ο κίνδυνος σοβαρών ανεπιθύμητων ενεργειών στο φάρμακο είναι μεγαλύτερος σε ασθενείς με διαταραχή της νεφρικής λειτουργίας, το Glucophage και το Glucophage XR πρέπει να χρησιμοποιούνται μόνο σε ασθενείς με φυσιολογική νεφρική λειτουργία (βλ. ΑΝΤΕΝΔΕΙΞΕΙΣ, ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ, και ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ: Φαρμακοκινητική). Επειδή η γήρανση σχετίζεται με μειωμένη νεφρική λειτουργία, το Glucophage ή το Glucophage XR πρέπει να χρησιμοποιούνται με προσοχή καθώς η ηλικία αυξάνεται. Πρέπει να λαμβάνεται μέριμνα για την επιλογή της δόσης και πρέπει να βασίζεται σε προσεκτική και τακτική παρακολούθηση της νεφρικής λειτουργίας. Γενικά, οι ηλικιωμένοι ασθενείς δεν πρέπει να τιτλοδοτούνται στη μέγιστη δόση του Glucophage ή του Glucophage XR (βλ. ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ και ΔΟΣΟΛΟΓΙΑ ΚΑΙ ΧΟΡΗΓΗΣΗ).
μπλουζα
Ανεπιθύμητες ενέργειες
Σε μια διπλή-τυφλή κλινική μελέτη των ΗΠΑ για το Glucophage σε ασθενείς με διαβήτη τύπου 2, συνολικά 141 ασθενείς έλαβαν θεραπεία με Glucophage (μέχρι 2550 mg την ημέρα) και 145 ασθενείς έλαβαν εικονικό φάρμακο. Οι ανεπιθύμητες ενέργειες που αναφέρθηκαν σε ποσοστό μεγαλύτερο από το 5% των ασθενών με Glucophage και οι οποίες ήταν πιο συχνές σε ασθενείς με Glucophage από τους ασθενείς που έλαβαν εικονικό φάρμακο, παρατίθενται στον Πίνακα 11.
Πίνακας 11: Πιο συχνές ανεπιθύμητες αντιδράσεις (> 5,0%) σε ελεγχόμενη με εικονικό φάρμακο κλινική μελέτη μονοθεραπείας με Glucophage *
| Ανεπιθύμητη αντίδραση | Glucophage Μονοθεραπεία (η = 141) |
Εικονικό φάρμακο (η = 145) |
|---|---|---|
| % των ασθενών | ||
| * Αντιδράσεις που ήταν πιο συχνές στο Glucophage - από τους ασθενείς που έλαβαν εικονικό φάρμακο. | ||
| Διάρροια | 53.2 | 11.7 |
| Ναυτία / Εμετός | 25.5 | 8.3 |
| Φούσκωμα | 12.1 | 5.5 |
| Ασθένεια | 9.2 | 5.5 |
| Δυσπεψία | 7.1 | 4.1 |
| Κοιλιακή δυσφορία | 6.4 | 4.8 |
| Πονοκέφαλο | 5.7 | 4.8 |
Η διάρροια οδήγησε σε διακοπή της φαρμακευτικής αγωγής μελέτης στο 6% των ασθενών που έλαβαν θεραπεία με Glucophage. Επιπλέον, οι ακόλουθες ανεπιθύμητες ενέργειες αναφέρθηκαν σε ≥ 1,0% έως ≥ 5,0% των ασθενών με Glucophage και αναφέρθηκαν συχνότερα με το Glucophage από το εικονικό φάρμακο: μη φυσιολογικά κόπρανα, υπογλυκαιμία, μυαλγία, ζάλη, δύσπνοια, διαταραχή των νυχιών, εξάνθημα, αυξημένη εφίδρωση, διαταραχή γεύσης, δυσφορία στο στήθος, ρίγη, σύνδρομο γρίπης, παλμός.
Σε παγκόσμιες κλινικές δοκιμές, πάνω από 900 ασθενείς με διαβήτη τύπου 2 έχουν υποβληθεί σε θεραπεία με Glucophage XR σε μελέτες ελεγχόμενες με εικονικό φάρμακο και με ενεργό έλεγχο. Σε ελεγχόμενες με εικονικό φάρμακο μελέτες, 781 ασθενείς έλαβαν Glucophage XR και 195 ασθενείς έλαβαν εικονικό φάρμακο. Οι ανεπιθύμητες ενέργειες που αναφέρθηκαν σε ποσοστό μεγαλύτερο από το 5% των ασθενών με Glucophage XR και οι οποίες ήταν πιο συχνές στους ασθενείς που έλαβαν θεραπεία με Glucophage XR - από τους ασθενείς που έλαβαν εικονικό φάρμακο, παρατίθενται στον Πίνακα 12.
Πίνακας 12: Πιο συχνές ανεπιθύμητες αντιδράσεις (> 5,0%) στις ελεγχόμενες με εικονικό φάρμακο μελέτες του Glucophage XR *
| Ανεπιθύμητη αντίδραση | Glucophage XR (η = 781) |
Εικονικό φάρμακο (η = 195) |
|---|---|---|
| % των ασθενών | ||
| * Αντιδράσεις που ήταν πιο συχνές στο Glucophage XR- από τους ασθενείς που έλαβαν εικονικό φάρμακο. | ||
| Διάρροια | 9.6 | 2.6 |
| Ναυτία / Εμετός | 6.5 | 1.5 |
Η διάρροια οδήγησε στη διακοπή της φαρμακευτικής αγωγής μελέτης στο 0,6% των ασθενών που έλαβαν θεραπεία με Glucophage XR. Επιπλέον, οι ακόλουθες ανεπιθύμητες ενέργειες αναφέρθηκαν σε ≥ 1,0% έως ≥ 5,0% των ασθενών με Glucophage XR και αναφέρθηκαν συχνότερα με το Glucophage XR από το εικονικό φάρμακο: κοιλιακό άλγος, δυσκοιλιότητα, κοιλιακή δυσφορία, δυσπεψία / καούρα, μετεωρισμός, ζάλη, κεφαλαλγία, λοίμωξη του ανώτερου αναπνευστικού συστήματος, γεύση διατάραξη.
Παιδιατρικοί ασθενείς
Σε κλινικές δοκιμές με Glucophage σε παιδιατρικούς ασθενείς με διαβήτη τύπου 2, το προφίλ των ανεπιθύμητων ενεργειών ήταν παρόμοιο με αυτό που παρατηρήθηκε στους ενήλικες.
μπλουζα
Υπερβολική δόση
Υπήρξε υπερδοσολογία με υδροχλωρική μετφορμίνη, συμπεριλαμβανομένης της κατάποσης ποσών μεγαλύτερων από 50 γραμμάρια. Η υπογλυκαιμία αναφέρθηκε σε περίπου 10% των περιπτώσεων, αλλά δεν έχει διαπιστωθεί αιτιώδης συνάφεια με την υδροχλωρική μετφορμίνη. Η γαλακτική οξέωση έχει αναφερθεί σε περίπου 32% των περιπτώσεων υπερδοσολογίας με μετφορμίνη (βλ ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ). Η μετφορμίνη μπορεί να υποβληθεί σε διαπίδυση με κάθαρση μέχρι 170 mL / min υπό καλές αιμοδυναμικές συνθήκες. Συνεπώς, η αιμοκάθαρση μπορεί να είναι χρήσιμη για την απομάκρυνση συσσωρευμένου φαρμάκου από ασθενείς στους οποίους υπάρχει υπόνοια υπερδοσολογίας με μετφορμίνη.
μπλουζα
Δοσολογία και χορήγηση
Δεν υπάρχει δοσολογία σταθερής δοσολογίας για τη διαχείριση της υπεργλυκαιμίας σε ασθενείς με διαβήτη τύπου 2 με Glucophage ή Glucophage XR ή οποιοδήποτε άλλο φαρμακολογικό παράγοντα. Η δοσολογία του Glucophage ή του Glucophage XR πρέπει να εξατομικεύεται με βάση τόσο την αποτελεσματικότητα όσο και την ανοχή, χωρίς όμως να υπερβαίνει τη μέγιστη συνιστώμενη ημερήσια δόση. Η μέγιστη συνιστώμενη ημερήσια δόση του Glucophage είναι 2550 mg σε ενήλικες και 2000 mg σε παιδιατρικούς ασθενείς (ηλικίας 10-16 ετών). η μέγιστη συνιστώμενη ημερήσια δόση του Glucophage XR σε ενήλικες είναι 2000 mg.
Το Glucophage πρέπει να χορηγείται σε διηρημένες δόσεις με τα γεύματα, ενώ το Glucophage XR πρέπει γενικά να χορηγείται μία φορά την ημέρα με το βραδινό γεύμα. Το Glucophage ή το Glucophage XR πρέπει να ξεκινούν σε χαμηλή δόση, με σταδιακή κλιμάκωση της δόσης, τόσο για τη μείωση γαστρεντερικών παρενεργειών και για να επιτρέψει την ταυτοποίηση της ελάχιστης δόσης που απαιτείται για τον επαρκή γλυκαιμικό έλεγχο του ασθενούς.
Κατά τη διάρκεια της έναρξης της θεραπείας και της τιτλοποίησης της δόσης (βλ. Συνιστώμενο Πρόγραμμα Δοσολογίας παρακάτω), η γλυκόζη πλάσματος νηστείας πρέπει να είναι χρησιμοποιείται για τον προσδιορισμό της θεραπευτικής απόκρισης στο Glucophage ή το Glucophage XR και προσδιορίζει την ελάχιστη αποτελεσματική δόση για το Glucophage υπομονετικος. Στη συνέχεια, η γλυκοζυλιωμένη αιμοσφαιρίνη θα πρέπει να μετράται σε διαστήματα περίπου 3 μηνών. Ο θεραπευτικός στόχος θα πρέπει να είναι η μείωση τόσο των επιπέδων γλυκόζης πλάσματος νηστείας όσο και των επιπέδων γλυκοζυλιωμένης αιμοσφαιρίνης σε φυσιολογικά ή σχεδόν κανονικά επίπεδα χρησιμοποιώντας τη χαμηλότερη αποτελεσματική δόση του Glucophage ή του Glucophage XR, είτε όταν χρησιμοποιείται ως μονοθεραπεία είτε σε συνδυασμό με σουλφονυλουρία ή ινσουλίνη.
Η παρακολούθηση της γλυκόζης στο αίμα και της γλυκοζυλιωμένης αιμοσφαιρίνης θα επιτρέψει επίσης την ανίχνευση της πρωταρχικής αποτυχίας, δηλ. Την ανεπαρκή μείωση της γλυκόζης στο αίμα τη μέγιστη συνιστώμενη δόση φαρμάκου και τη δευτερογενή αποτυχία, δηλαδή την απώλεια ικανοποιητικής ανταπόκρισης μείωσης της γλυκόζης αίματος μετά από αρχική περίοδο αποτελεσματικότητα.
Η βραχυχρόνια χορήγηση του Glucophage ή του Glucophage XR μπορεί να είναι επαρκής κατά τη διάρκεια περιόδων προσωρινής απώλειας ελέγχου σε ασθενείς συνήθως καλώς ελεγχόμενους μόνο με δίαιτα.
Τα δισκία Glucophage XR πρέπει να καταπίνονται ολόκληρα και να μην συνθλίβονται ή να μασώνται. Περιστασιακά, τα αδρανή συστατικά του Glucophage XR θα εξαλειφθούν στα κόπρανα ως μια μαλακή, ενυδατωμένη μάζα.
Συνιστώμενο χρονοδιάγραμμα δόσεων
Ενήλικες
Γενικά, κλινικά σημαντικές αποκρίσεις δεν παρατηρούνται σε δόσεις κάτω των 1500 mg ημερησίως. Ωστόσο, συνιστάται χαμηλότερη συνιστώμενη δόση έναρξης και σταδιακά αυξημένη δοσολογία ώστε να ελαχιστοποιηθούν τα γαστρεντερικά συμπτώματα.
Η συνήθης δόση έναρξης των δισκίων Glucophage (υδροχλωρική μετφορμίνη) είναι 500 mg δύο φορές την ημέρα ή 850 mg μία φορά την ημέρα, χορηγούμενη με τα γεύματα. Οι αυξήσεις της δοσολογίας θα πρέπει να γίνονται σε δόσεις των 500 mg εβδομαδιαίως ή 850 mg κάθε 2 εβδομάδες, μέχρι συνολικά 2000 mg ημερησίως, χορηγούμενες σε διηρημένες δόσεις. Οι ασθενείς μπορούν επίσης να τιτλοφορηθούν από 500 mg δύο φορές την ημέρα στα 850 mg δύο φορές την ημέρα μετά από 2 εβδομάδες. Για τους ασθενείς που χρειάζονται επιπλέον γλυκαιμικό έλεγχο, το Glucophage μπορεί να χορηγηθεί σε μέγιστη ημερήσια δόση 2550 mg την ημέρα. Οι δόσεις άνω των 2000 mg μπορεί να είναι καλύτερα ανεκτές, δεδομένου ότι χορηγούνται 3 φορές την ημέρα με τα γεύματα.
Η συνήθης δόση έναρξης του Glucophage XR (υδροχλωρική μετφορμίνη) δισκία εκτεταμένης απελευθέρωσης είναι 500 mg μία φορά την ημέρα με το βραδινό γεύμα. Οι αυξήσεις της δοσολογίας πρέπει να γίνονται σε δόσεις των 500 mg εβδομαδιαίως, μέχρι το μέγιστο 2000 mg μία φορά την ημέρα με το βραδινό γεύμα. Εάν δεν επιτυγχάνεται γλυκαιμικός έλεγχος στο Glucophage XR 2000 mg μία φορά την ημέρα, θα πρέπει να εξετάζεται μια δοκιμή Glucophage XR 1000 mg δύο φορές ημερησίως. Εάν απαιτούνται υψηλότερες δόσεις μετφορμίνης, το Glucophage θα πρέπει να χρησιμοποιείται σε συνολικές ημερήσιες δόσεις μέχρι 2550 mg χορηγούμενες σε διαιρεμένες ημερήσιες δόσεις, όπως περιγράφεται παραπάνω. (Βλέπω ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ: Κλινικές Μελέτες.)
Σε μια τυχαιοποιημένη μελέτη, οι ασθενείς που υποβλήθηκαν σε θεραπεία με το Glucophage μετατράπηκαν σε Glucophage XR. Τα αποτελέσματα αυτής της δοκιμής υποδεικνύουν ότι οι ασθενείς που λαμβάνουν θεραπεία με Glucophage μπορούν να μετατραπούν με ασφάλεια σε Glucophage XR μία φορά την ημέρα στην ίδια συνολική ημερήσια δόση, μέχρι 2000 mg μία φορά την ημέρα. Μετά από τη μετάβαση από το Glucophage στο Glucophage XR, ο γλυκαιμικός έλεγχος πρέπει να παρακολουθείται στενά και οι προσαρμογές της δοσολογίας να γίνονται ανάλογα (βλ. ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ: Κλινικές Μελέτες).
Παιδιατρική
Η συνήθης δόση έναρξης του Glucophage είναι 500 mg δύο φορές την ημέρα, χορηγούμενη με τα γεύματα. Οι αυξήσεις της δοσολογίας πρέπει να γίνονται σε δόσεις των 500 mg εβδομαδιαίως έως το μέγιστο των 2000 mg ημερησίως, χορηγούμενες σε διηρημένες δόσεις. Η ασφάλεια και η αποτελεσματικότητα του Glucophage XR σε παιδιατρικούς ασθενείς δεν έχουν τεκμηριωθεί.
Μεταφορά από άλλη αντιδιαβητική θεραπεία
Όταν μεταφέρονται ασθενείς από συνήθεις υπογλυκαιμικούς παράγοντες από του στόματος, εκτός από το χλωροπροπαμίδιο, σε Glucophage ή Glucophage XR, δεν απαιτείται γενικά καμία μεταβατική περίοδος. Κατά τη μεταφορά ασθενών από χλωροπροπαμίδη, πρέπει να ασκείται η φροντίδα κατά τη διάρκεια των πρώτων 2 εβδομάδων λόγω της παρατεταμένη κατακράτηση χλωπροπαμιδίου στο σώμα, με αποτέλεσμα αλληλοεπικάλυψη των επιδράσεων των φαρμάκων και πιθανή υπογλυκαιμία.
Συγχρόνως Glucophage ή Glucophage XR και θεραπεία με σουλφονυλουρία από το στόμα σε ενήλικες ασθενείς
Εάν οι ασθενείς δεν έχουν ανταποκριθεί σε 4 εβδομάδες της μέγιστης δόσης μονοθεραπείας με Glucophage ή Glucophage XR, θα πρέπει να εξεταστεί η σταδιακή προσθήκη μια από του στόματος σουλφονυλουρία ενώ συνέχιζε να χορηγείται το Glucophage ή το Glucophage XR στη μέγιστη δόση, ακόμη και αν η προηγούμενη πρωτογενής ή δευτερογενής αποτυχία σουλφονυλουρίας συνέβη. Δεδομένα κλινικής και φαρμακοκινητικής αλληλεπίδρασης φαρμάκου-φαρμάκου είναι διαθέσιμα μόνο για τη μετφορμίνη και τη γλυβουρίδη (γλιβενκλαμίδη).
Με τη συγχορήγηση θεραπείας με Glucophage ή Glucophage XR και σουλφονυλουρίας, ο επιθυμητός έλεγχος της γλυκόζης στο αίμα μπορεί να επιτευχθεί ρυθμίζοντας τη δόση κάθε φαρμάκου. Σε κλινική δοκιμή ασθενών με διαβήτη τύπου 2 και προηγούμενης αποτυχίας στη γλυβουρίδη, οι ασθενείς ξεκίνησαν με Glucophage 500 mg και γλυβουρίδη 20 mg τιτλοποιήθηκαν στα 1000/20 mg, 1500/20 mg, 2000/20 mg ή 2500/20 mg Glucophage και glyburide, αντίστοιχα, για να επιτευχθεί ο στόχος του γλυκαιμικού ελέγχου όπως μετράται με FPG, HbA1c και απόκριση γλυκόζης στο πλάσμα (βλέπω ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ: Κλινικές Μελέτες). Ωστόσο, θα πρέπει να γίνει προσπάθεια προσδιορισμού της ελάχιστης αποτελεσματικής δόσης κάθε φαρμάκου για την επίτευξη αυτού του στόχου. Με ταυτόχρονη θεραπεία με Glucophage ή Glucophage XR και σουλφονυλουρία, ο κίνδυνος υπογλυκαιμίας που σχετίζεται με τη θεραπεία με σουλφονυλουρία συνεχίζεται και μπορεί να αυξηθεί. Πρέπει να λαμβάνονται οι κατάλληλες προφυλάξεις. (Βλέπε ένθετο συσκευασίας της αντίστοιχης σουλφονυλουρίας).
Εάν οι ασθενείς δεν ανταποκρίθηκαν ικανοποιητικά σε 1 έως 3 μήνες συγχορηγούμενης θεραπείας με τη μέγιστη δόση του Glucophage ή του Glucophage XR και τη μέγιστη δόση σουλφονυλουρίας από το στόμα, εξετάστε εναλλακτικές θεραπείες συμπεριλαμβανομένης της μετάβασης στην ινσουλίνη με ή χωρίς το Glucophage ή το Glucophage XR.
Συγχρόνως Glucophage ή Glucophage XR και ινσουλινοθεραπεία σε ενήλικες ασθενείς
Η τρέχουσα δόση ινσουλίνης πρέπει να συνεχιστεί κατά την έναρξη της θεραπείας με Glucophage ή Glucophage XR. Η θεραπεία με Glucophage ή Glucophage XR θα πρέπει να ξεκινά στα 500 mg μία φορά την ημέρα σε ασθενείς που λαμβάνουν θεραπεία με ινσουλίνη. Για τους ασθενείς που δεν ανταποκρίνονται επαρκώς, η δόση του Glucophage ή του Glucophage XR θα πρέπει να αυξηθεί κατά 500 mg μετά από περίπου 1 εβδομάδα και με 500 mg κάθε εβδομάδα στη συνέχεια μέχρι να υπάρξει επαρκής γλυκαιμικός έλεγχος επιτευχθεί. Η μέγιστη συνιστώμενη ημερήσια δόση είναι 2500 mg για το Glucophage και 2000 mg για το Glucophage XR. Συνιστάται η μείωση της δόσης ινσουλίνης κατά 10% έως 25% όταν η γλυκόζη στο πλάσμα νηστείας οι συγκεντρώσεις μειώνονται σε λιγότερο από 120 mg / dL σε ασθενείς που λαμβάνουν ταυτόχρονα ινσουλίνη και Glucophage ή Glucophage XR. Η περαιτέρω προσαρμογή πρέπει να εξατομικεύεται με βάση την απόκριση μείωσης της γλυκόζης.
Ειδικοί πληθυσμοί ασθενών
Το Glucophage ή το Glucophage XR δεν συνιστώνται για χρήση κατά την εγκυμοσύνη. Το Glucophage δεν συνιστάται σε ασθενείς ηλικίας κάτω των 10 ετών. Το Glucophage XR δεν συνιστάται σε παιδιατρικούς ασθενείς (ηλικίας κάτω των 17 ετών).
Η αρχική και συντηρητική δοσολογία του Glucophage ή του Glucophage XR πρέπει να είναι συντηρητική σε ασθενείς με προχωρημένη ηλικία, λόγω της πιθανότητας μειωμένης νεφρικής λειτουργίας σε αυτόν τον πληθυσμό. Κάθε προσαρμογή της δοσολογίας πρέπει να βασίζεται σε προσεκτική αξιολόγηση της νεφρικής λειτουργίας. Γενικά, ηλικιωμένοι, εξασθενημένοι και υποσιτιζόμενοι ασθενείς δεν πρέπει να τιτλοδοτούνται στη μέγιστη δόση του Glucophage ή του Glucophage XR.
Η παρακολούθηση της νεφρικής λειτουργίας είναι απαραίτητη για την πρόληψη της γαλακτικής οξέωσης, ιδιαίτερα στους ηλικιωμένους. (Βλέπω ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ.)
μπλουζα
Πώς παρέχεται
Glucophage® (υδροχλωρική μετφορμίνη)
| 500 mg | Φιάλες των 100 | NDC 0087-6060-05 |
| 500 mg | Φιάλες των 500 | NDC 0087-6060-10 |
| 850 mg | Φιάλες των 100 | NDC 0087-6070-05 |
| 1000 mg | Φιάλες των 100 | NDC 0087-6071-11 |
Τα δισκία Glucophage 500 mg είναι στρογγυλά, λευκά έως υπόλευκα, επικαλυμμένα με λεπτό υμένιο δισκία και φέρουν την ένδειξη "BMS" 6060 "γύρω από την περιφέρεια του δισκίου στη μία πλευρά και το" 500 "με χαρακτήρες σε όλη την επιφάνεια του άλλου πλευρά.
Τα δισκία Glucophage 850 mg είναι στρογγυλά, λευκά έως υπόλευκα, επικαλυμμένα με λεπτό υμένιο δισκία που φέρουν την ένδειξη "BMS" 6070 "γύρω από την περιφέρεια του δισκίου στη μία πλευρά και το" 850 "με χαρακτήρες σε όλη την επιφάνεια του άλλου πλευρά.
Τα δισκία Glucophage 1000 mg είναι λευκά, ωοειδή, αμφίκυρτα, επικαλυμμένα με λεπτό υμένιο δισκία με "BMS 6071" χαραγμένο στη μία πλευρά και "1000" με ανάγλυφη πλευρά και με αμφίδρομη γραμμή.
Glucophage® XR (υδροχλωρική μετφορμίνη) Δισκία εκτεταμένης απελευθέρωσης
| 500 mg | Φιάλες των 100 | NDC 0087-6063-13 |
| 750 mg | Φιάλες των 100 | NDC 0087-6064-13 |
Τα δισκία Glucophage XR 500 mg είναι λευκά έως υπόλευκα, αμφίκυρτα δισκία σε σχήμα καψακίου, με "BMS 6063" χαραγμένο στη μία πλευρά και "500" με ανάγλυφη ετικέτα στην όψη της άλλης πλευράς.
Τα δισκία Glucophage XR 750 mg είναι δισκιοποιημένα δισκία με σχήμα «κάψουλας», με ετικέτα "BMS 6064" με μια εγχάραξη και μία "750" στην άλλη πλευρά. Τα δισκία είναι ανοιχτό κόκκινο και μπορεί να έχουν στροβιλισμένη εμφάνιση.
Αποθήκευση
Φυλάσσεται στους 20 ° -25 ° C (68 ° -77 ° F). οι εκδρομές επιτρέπονται στους 15 ° -30 ° C (59 ° -86 ° F). [Βλέπε ελεγχόμενη θερμοκρασία δωματίου USP]
Διανείμετε σε δοχεία ανθεκτικά στο φως.
Το Glucophage® είναι καταχωρημένο εμπορικό σήμα της Merck Santà © S.A.S., συνεργάτης της Merck KGaA της Darmstadt, Γερμανία. Άδεια στην εταιρεία Bristol-Myers Squibb.
Διανεμήθηκαν από:
Εταιρεία Bristol-Myers Squibb
Princeton, NJ 08543 USA
τελευταία ενημέρωση: 01/2009
Glucomage, υδροχλωρική μετφορμίνη, πληροφορίες για τον ασθενή (στην απλή αγγλική γλώσσα)
Λεπτομερείς πληροφορίες για σημεία, συμπτώματα, αιτίες, θεραπείες διαβήτη
Οι πληροφορίες σε αυτή τη μονογραφία δεν προορίζονται να καλύψουν όλες τις πιθανές χρήσεις, οδηγίες, προφυλάξεις, αλληλεπιδράσεις φαρμάκων ή ανεπιθύμητες ενέργειες. Αυτές οι πληροφορίες είναι γενικευμένες και δεν προορίζονται ως συγκεκριμένες ιατρικές συμβουλές. Εάν έχετε απορίες σχετικά με τα φάρμακα που παίρνετε ή θα θέλατε περισσότερες πληροφορίες, συμβουλευτείτε το γιατρό, το φαρμακοποιό σας ή τη νοσοκόμα.
πίσω στο: Περιηγηθείτε σε όλα τα φάρμακα για τον διαβήτη



