Actos για τον διαβήτη τύπου 2
Εμπορικό όνομα: Actos
Γενική ονομασία: Υδροχλωρική πιγλιταζόνη
Περιεχόμενα:
Περιγραφή
Φαρμακολογία
Ενδείξεις και χρήση
Αντενδείξεις
Προειδοποιήσεις
Προφυλάξεις
Ανεπιθύμητες ενέργειες
Υπερβολική δόση
Δοσολογία και χορήγηση
Πώς παρέχεται
Actos, πιογλιταζόνη hcl, πληροφορίες για τον ασθενή (στην απλή αγγλική γλώσσα)
ΠΡΟΕΙΔΟΠΟΙΗΣΗ: ΑΔΥΝΑΜΙΑ ΚΑΤΑΡΡΥΘΜΗΣ ΚΑΡΔΙΑΣ
- Οι θειαζολιδινεδιόνες, συμπεριλαμβανομένου του Actos, προκαλούν ή επιδεινώνουν την συμφορητική καρδιακή ανεπάρκεια σε ορισμένους ασθενείς (βλ ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ). Μετά την έναρξη του Actos και μετά από αύξηση της δόσης, παρατηρήστε προσεκτικά στους ασθενείς σημεία και συμπτώματα καρδιακής ανεπάρκειας (συμπεριλαμβανομένης της υπερβολικής αύξησης του σωματικού βάρους, της δύσπνοιας ή / και του οιδήματος). Εάν εμφανιστούν αυτά τα σημεία και συμπτώματα, η καρδιακή ανεπάρκεια θα πρέπει να αντιμετωπίζεται σύμφωνα με τα ισχύοντα πρότυπα περίθαλψης. Επιπλέον, πρέπει να ληφθεί υπόψη η διακοπή ή η μείωση της δόσης του Actos.
- Το Actos δεν συνιστάται σε ασθενείς με συμπτωματική καρδιακή ανεπάρκεια. Η έναρξη του Actos σε ασθενείς με καθιερωμένη καρδιακή ανεπάρκεια κατηγορίας III ή IV NYHA αντενδείκνυται (βλ ΑΝΤΕΝΔΕΙΞΕΙΣ και ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ).
Περιγραφή
Το Actos (υδροχλωρική πιογλιταζόνη) είναι ένας από του στόματος αντιδιαβητικός παράγοντας που δρα κυρίως μειώνοντας την αντίσταση στην ινσουλίνη. Το Actos χρησιμοποιείται στη θεραπεία του σακχαρώδους διαβήτη τύπου 2 (γνωστός και ως μη ινσουλινοεξαρτώμενος σακχαρώδης διαβήτης [NIDDM] ή διαβήτης ενηλίκων). Φαρμακολογικές μελέτες δείχνουν ότι το Actos βελτιώνει την ευαισθησία στην ινσουλίνη στον μυϊκό και λιπώδη ιστό και αναστέλλει την ηπατική γλυκονεογένεση. Το Actos βελτιώνει τον γλυκαιμικό έλεγχο μειώνοντας ταυτόχρονα τα επίπεδα της ινσουλίνης που κυκλοφορούν.
Η πιιογλιταζόνη μονοϋδροχλωρική [(±) -5 - [[4- [2- (5-αιθυλ-2-πυριδινυλ) αιθοξυ] φαινυλ] μεθυλ] -2,4-] θειαζολιδινοδιόνη ανήκει σε διαφορετική χημική κατηγορία και έχει διαφορετική φαρμακολογική δράση από ότι οι σουλφονυλουρίες, η μετφορμίνη ή η ϋ-γλυκοσιδάση αναστολείς. Το μόριο περιέχει έναν ασύμμετρο άνθρακα και η ένωση συντίθεται και χρησιμοποιείται ως το ρακεμικό μίγμα. Τα δύο εναντιομερή της αλληλεπίδρασης της πιογλιταζόνης in vivo. Δεν διαπιστώθηκαν διαφορές στη φαρμακολογική δραστικότητα μεταξύ των δύο εναντιομερών. Ο δομικός τύπος είναι όπως φαίνεται:
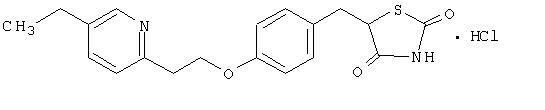
Η υδροχλωρική πιγλιταζόνη είναι λευκή κρυσταλλική σκόνη χωρίς άοσμο που έχει μοριακό τύπο C19H20Ν2Ο3S-HCl και ένα μοριακό βάρος 392,90 daltons. Είναι διαλυτό σε Ν, Ν-διμεθυλοφορμαμίδιο, ελαφρώς διαλυτό σε άνυδρη αιθανόλη, πολύ ελαφρώς διαλυτό σε ακετόνη και ακετονιτρίλιο, πρακτικά αδιάλυτο στο νερό και αδιάλυτο σε αιθέρα.
Το Actos διατίθεται ως δισκίο για από του στόματος χορήγηση που περιέχει 15 mg, 30 mg ή 45 mg πιογλιταζόνης (ως βάση) που τα ακόλουθα έκδοχα: Ι μονοένυδρη ακετόζη NF, υδροξυπροπυλοκυτταρίνη NF, καρβοξυμεθυλοκυτταρίνη ασβέστιο NF και στεατικό μαγνήσιο NF.
μπλουζα
Κλινική Φαρμακολογία
Μηχανισμός δράσης
Το Actos είναι ένας αντιδιαβητικός παράγων θειαζολιδινεδιόνης που εξαρτάται από την παρουσία ινσουλίνης για τον μηχανισμό δράσης του. Το Actos μειώνει την αντίσταση στην ινσουλίνη στην περιφέρεια και στο ήπαρ με αποτέλεσμα την αύξηση της εξάρτησης από γλυκόζη εξαρτώμενη από την ινσουλίνη και τη μείωση της παραγωγής ηπατικής γλυκόζης. Σε αντίθεση με τις σουλφονυλουρίες, η πιογλιταζόνη δεν αποτελεί έκκριση της ινσουλίνης. Η πιογλιταζόνη είναι ένας ισχυρός αγωνιστής για ενεργοποιημένο από πολλαπλασιαστή υπεροξειδάσης υποδοχέα-γ (PPARβ). Οι υποδοχείς PPAR βρίσκονται σε ιστούς σημαντικούς για τη δράση της ινσουλίνης, όπως ο λιπώδης ιστός, ο σκελετικός μυς και το ήπαρ. Η ενεργοποίηση των πυρηνικών υποδοχέων ΡΡΑΚ3 ρυθμίζει τη μεταγραφή ενός αριθμού γονιδίων που ανταποκρίνονται στην ινσουλίνη και εμπλέκονται στον έλεγχο του μεταβολισμού της γλυκόζης και του λιπιδίου.
Σε ζωϊκά μοντέλα διαβήτη, η πιογλιταζόνη μειώνει την υπεργλυκαιμία, την υπερινσουλιναιμία και την υπερτριγλυκεριδαιμία που χαρακτηρίζουν τις ανθεκτικές στην ινσουλίνη καταστάσεις όπως ο διαβήτης τύπου 2. Οι μεταβολικές μεταβολές που προκαλούνται από την πιογλιταζόνη οδηγούν σε αυξημένη ανταπόκριση των ινσουλινοεξαρτώμενων ιστών και παρατηρούνται σε πολυάριθμα ζωικά μοντέλα ανθεκτικότητας στην ινσουλίνη.
Δεδομένου ότι η πιογλιταζόνη ενισχύει τα αποτελέσματα της κυκλοφορούνσης ινσουλίνης (μειώνοντας την αντίσταση στην ινσουλίνη), δεν μειώνει τη γλυκόζη αίματος σε μοντέλα ζώων που δεν διαθέτουν ενδογενή ινσουλίνη.
Φαρμακοκινητική και Μεταβολισμός Φαρμάκων
Οι συγκεντρώσεις ολικής πιογλιταζόνης στον ορό (πιογλιταζόνη συν δραστικοί μεταβολίτες) παραμένουν αυξημένες 24 ώρες μετά τη χορήγηση μιας φορά ημερησίως. Οι συγκεντρώσεις ορού τόσο της πιογλιταζόνης όσο και της συνολικής πιογλιταζόνης στον ορό επιτυγχάνονται εντός 7 ημερών. Σε σταθερή κατάσταση, δύο από τους φαρμακολογικά δραστικούς μεταβολίτες της πιογλιταζόνης, οι μεταβολίτες III (M-III) και IV (M-IV), φθάνουν συγκεντρώσεις ορού ίσες ή μεγαλύτερες από την πιογλιταζόνη. Σε αμφότερους τους υγιείς εθελοντές και σε ασθενείς με διαβήτη τύπου 2, η πιογλιταζόνη περιλαμβάνει περίπου 30% έως 50% του σακχαρώδη διαβήτη τις μέγιστες συνολικές συγκεντρώσεις του pioglitazone στον ορό και το 20% έως 25% της συνολικής περιοχής κάτω από την καμπύλη συγκέντρωσης ορού-χρόνου (AUC).
Μέγιστη συγκέντρωση στον ορό (CΜέγιστη), AUC και ελάχιστες συγκεντρώσεις στον ορό (Cmin) τόσο για την πιογλιταζόνη όσο και για την συνολική πιογλιταζόνη αυξάνονται αναλογικά σε δόσεις των 15 mg και 30 mg ημερησίως. Υπάρχει ελαφρώς μικρότερη από την αναλογική αύξηση της πιογλιταζόνης και της συνολικής πιογλιταζόνης σε δόση των 60 mg ημερησίως.
Απορρόφηση: Μετά από χορήγηση από το στόμα, σε κατάσταση νηστείας, η πιογλιταζόνη μπορεί να μετρηθεί πρώτα στον ορό εντός 30 λεπτών, με τις μέγιστες συγκεντρώσεις να παρατηρούνται εντός 2 ωρών. Η τροφή καθυστερεί ελαφρώς τον χρόνο έως την μέγιστη συγκέντρωση στον ορό σε 3 έως 4 ώρες, αλλά δεν μεταβάλλει την έκταση της απορρόφησης.
Κατανομή: Ο μέσος φαινόμενος όγκος κατανομής (Vd / F) της πιογλιταζόνης μετά τη χορήγηση μιας δόσης είναι 0,63 ± 0,41 (μέση τιμή ± SD) L / kg σωματικού βάρους.
Η πιογλιταζόνη δεσμεύεται εκτενώς σε πρωτεΐνες (> 99%) στον ανθρώπινο ορό, κυρίως στην αλβουμίνη του ορού. Η πιογλιταζόνη δεσμεύεται επίσης με άλλες πρωτεΐνες ορού, αλλά με χαμηλότερη συγγένεια. Οι μεταβολίτες M-III και M-IV επίσης δεσμεύονται εκτεταμένα (> 98%) στην αλβουμίνη του ορού.
Μεταβολισμός: Η πιογλιταζόνη μεταβολίζεται εκτεταμένα με υδροξυλίωση και οξείδωση. οι μεταβολίτες μετατρέπονται επίσης εν μέρει σε συζεύγματα γλυκουρονιδίου ή θειικού. Τα μεταβολίτες M-II και M-IV (υδροξυπαραγώγια της πιογλιταζόνης) και το M-III (κετοπαραγωγό της πιογλιταζόνης) είναι φαρμακολογικώς δραστικά σε ζωικά μοντέλα διαβήτη τύπου 2. Εκτός από την πιογλιταζόνη, το Μ-ΙΙΙ και το Μ-ΐν είναι το κύριο είδος που σχετίζεται με το φάρμακο και βρίσκεται στον ανθρώπινο ορό μετά από πολλαπλές δόσεις. Σε σταθερή κατάσταση, σε υγιείς εθελοντές και σε ασθενείς με διαβήτη τύπου 2, η πιογλιταζόνη περιλαμβάνει περίπου το 30% έως 50% των συνολικών συγκεντρώσεων αιχμής του ορού και το 20% έως 25% του ορού συνολική AUC.
Δεδομένα in vitro καταδεικνύουν ότι πολλαπλές ισομορφές CYP εμπλέκονται στο μεταβολισμό της πιογλιταζόνης. Οι ισομορφές του κυτοχρώματος Ρ450 που εμπλέκονται είναι το CYP2C8 και, σε μικρότερο βαθμό, το CYP3A4 με επιπλέον συνεισφορές από μια ποικιλία άλλων ισομορφών, συμπεριλαμβανομένου του κυρίως εξωηπατικού CYP1A1. Έχουν διεξαχθεί in vivo μελέτες της πιογλιταζόνης σε συνδυασμό με αναστολείς και υποστρώματα του P450 (βλ Αλληλεπιδράσεις με άλλα φάρμακα). Οι αναλογίες ουρολοίμωξης 6α-υδροξυκορτιζόλης / κορτιζόλης που μετρήθηκαν σε ασθενείς που έλαβαν θεραπεία με Actos έδειξαν ότι η πιογλιταζόνη δεν είναι ισχυρός επαγωγέας ενζύμου CYP3A4.
Εξαφάνιση και αποβολή: Μετά την από του στόματος χορήγηση, περίπου 15% έως 30% της δόσης της πιογλιταζόνης ανακτάται στα ούρα. Η νεφρική απέκκριση της πιογλιταζόνης είναι αμελητέα και το φάρμακο απεκκρίνεται πρωτίστως ως μεταβολίτες και των συζυγών τους. Θεωρείται ότι το μεγαλύτερο μέρος της στοματικής δόσης απεκκρίνεται στη χολή είτε αμετάβλητα είτε ως μεταβολίτες και εξαλείφεται στα κόπρανα.
Ο μέσος χρόνος ημιζωής στον ορό της πιογλιταζόνης και της συνολικής πιογλιταζόνης κυμαίνεται από 3 έως 7 ώρες και 16 έως 24 ώρες, αντίστοιχα. Η πιογλιταζόνη έχει εμφανή κάθαρση, CL / F, που υπολογίζεται ότι είναι 5 έως 7 L / ώρα.
Ειδικοί πληθυσμοί
Νεφρική ανεπάρκεια: Ο χρόνος ημιζωής κατά την εξάλειψη της πιογλιταζόνης, M-III και M-IV παραμένει αμετάβλητος σε ασθενείς με μέτρια (κάθαρση κρεατινίνης 30 έως 60 mL / min) έως σοβαρή νεφρική ανεπάρκεια (κάθαρση κρεατινίνης <30 mL / min) σε σύγκριση με την κανονική μαθήματα. Δεν συνιστάται προσαρμογή της δόσης σε ασθενείς με νεφρική δυσλειτουργία (βλ ΔΟΣΟΛΟΓΙΑ ΚΑΙ ΧΟΡΗΓΗΣΗ).
Ηπατική ανεπάρκεια: Σε σύγκριση με τους συνήθεις ελέγχους, τα άτομα με διαταραχή της ηπατικής λειτουργίας (Child-Pugh Βαθμού Β / C) έχουν κατά προσέγγιση μείωση κατά 45% της πιογλιταζόνης και της μέσης μέγιστης συγκεντρώσεως πιογλιταζόνης, αλλά καμία μεταβολή στη μέση AUC αξίες.
Η θεραπεία με Actos δεν πρέπει να ξεκινά εάν ο ασθενής παρουσιάζει κλινικές ενδείξεις ενεργού ηπατικής νόσου ή επίπεδα τρανσαμινάσης στον ορό (ALT) υπερβαίνει το 2,5 φορές το ανώτερο φυσιολογικό όριο (βλ. ΠΡΟΦΥΛΑΞΕΙΣ, Ηπατικές Επιδράσεις).
Ηλικιωμένοι: Σε υγιή ηλικιωμένα άτομα, οι μέγιστες συγκεντρώσεις του pioglitazone στον ορό και η συνολική πιογλιταζόνη δεν είναι αλλά οι τιμές AUC είναι ελαφρώς υψηλότερες και οι τελικές τιμές ημίσειας ζωής ελαφρώς μεγαλύτερες από τις τιμές νεότερα θέματα. Αυτές οι αλλαγές δεν είχαν μέγεθος που θα θεωρούνταν κλινικά σχετικό.
Παιδιατρική: Δεν υπάρχουν διαθέσιμα φαρμακοκινητικά δεδομένα στον παιδιατρικό πληθυσμό.
Φύλο: Ο μέσος όρος CΜέγιστη και οι τιμές AUC αυξήθηκαν από 20% έως 60% στις γυναίκες. Ως μονοθεραπεία και σε συνδυασμό με σουλφονυλουρία, μετφορμίνη ή ινσουλίνη, ο Actos βελτίωσε τον γλυκαιμικό έλεγχο τόσο στους άνδρες όσο και στα θηλυκά. Σε ελεγχόμενες κλινικές δοκιμές, η αιμοσφαιρίνη Α1γ (HbA1γ) μειώθηκε από την αρχική τιμή ήταν γενικά μεγαλύτερη για τις γυναίκες από ό, τι για τους άνδρες (μέση μέση διαφορά στην HbA1γ 0.5%). Δεδομένου ότι η θεραπεία θα πρέπει να εξατομικεύεται για κάθε ασθενή για να επιτευχθεί ο γλυκαιμικός έλεγχος, δεν συνιστάται προσαρμογή της δόσης με βάση μόνο το φύλο.
Εθνικότητα: Δεν υπάρχουν διαθέσιμα φαρμακοκινητικά δεδομένα μεταξύ διαφόρων εθνοτικών ομάδων.
Αλληλεπιδράσεις φαρμάκων-φαρμάκων
Τα ακόλουθα φάρμακα μελετήθηκαν σε υγιείς εθελοντές με συγχορήγηση Actos 45 mg μία φορά την ημέρα. Παρακάτω αναφέρονται τα αποτελέσματα:
Από του στόματος αντισυλληπτικά: Η συγχορήγηση Actos (45 mg μία φορά την ημέρα) και ένα από του στόματος αντισυλληπτικό (1 mg νορεθινδρόνης συν 0,035 mg αιθινυλ οιστραδιόλη μία φορά ημερησίως) για 21 ημέρες, οδήγησε σε 11% και 11-14% μείωση της AUC της αιθυνυλιστραδιόλης (0-24h) και CΜέγιστη αντίστοιχα. Δεν υπήρξαν σημαντικές αλλαγές στην AUC της νορεθινδρόνης (0-24 ώρες) και στο CΜέγιστη. Λόγω της μεγάλης μεταβλητότητας της φαρμακοκινητικής της αιθυνυλοιστραδιόλης, η κλινική σημασία αυτού του ευρήματος είναι άγνωστη.
Fexofenadine HCl: Η συγχορήγηση Actos για 7 ημέρες με 60 mg fexofenadine χορηγούμενη από του στόματος δύο φορές ημερησίως δεν είχε σημαντική επίδραση στη φαρμακοκινητική της πιογλιταζόνης. Το Actos δεν είχε σημαντική επίδραση στη φαρμακοκινητική της φεξοφεναδίνης.
Glipizide: Η συγχορήγηση Actos και 5 mg γλιπιζίδης που χορηγήθηκε από του στόματος μία φορά ημερησίως για 7 ημέρες δεν αλλοίωσε τη φαρμακοκινητική σταθεροποιημένης κατάστασης της γλιπιζίδης.
Διγοξίνη: Η συγχορήγηση Actos με 0,25 mg διγοξίνης χορηγούμενη από του στόματος μία φορά ημερησίως για 7 ημέρες δεν αλλοίωσε τη φαρμακοκινητική της διγοξίνης σε σταθεροποιημένη κατάσταση.
Βαρφαρίνη: Η συγχορήγηση Actos για 7 ημέρες με βαρφαρίνη δεν αλλοίωσε τη φαρμακοκινητική της βαρφαρίνης σε σταθερή κατάσταση. Το Actos δεν έχει κλινικά σημαντική επίδραση στον χρόνο προθρομβίνης όταν χορηγείται σε ασθενείς που λαμβάνουν χρόνια θεραπεία με βαρφαρίνη.
Μετφορμίνη: Η συγχορήγηση μιας μεμονωμένης δόσης μετφορμίνης (1000 mg) και Actos μετά από 7 ημέρες Actos δεν αλλοίωσε τη φαρμακοκινητική της μεμονωμένης δόσης μετφορμίνης.
Μιδαζολάμη: Η χορήγηση του Actos για 15 ημέρες ακολουθούμενη από μία μόνο δόση 7,5 mg σιροπιού μιδαζολάμης οδήγησε σε μείωση κατά 26% της μιδαζολάμης CΜέγιστη και AUC.
Ρανιτιδίνη HCl: Η συγχορήγηση Actos για 7 ημέρες με ρανιτιδίνη χορηγούμενη από του στόματος δύο φορές την ημέρα για 4 ή 7 ημέρες δεν οδήγησε σε σημαντική επίδραση στη φαρμακοκινητική της πιογλιταζόνης. Το Actos δεν έδειξε σημαντική επίδραση στη φαρμακοκινητική της ρανιτιδίνης.
Νιφεδιπίνη ER: Συγχορήγηση Actos για 7 ημέρες με 30 mg νιφεδιπίνης ER που χορηγήθηκε από του στόματος άπαξ ημερησίως για 4 ημέρες έως οι άνδρες και οι γυναίκες εθελοντές είχαν ως αποτέλεσμα τιμές μέσης τετραγωνικής μέσης τιμής (90% CI) για την αμετάβλητη νιφεδιπίνη 0,83 (0,73 - 0,95) για ντοΜέγιστη και 0,88 (0,80 - 0,96) για την AUC. Λόγω της μεγάλης μεταβλητότητας της φαρμακοκινητικής της νιφεδιπίνης, η κλινική σημασία αυτού του ευρήματος είναι άγνωστη.
Κετοκοναζόλη: Συγχορήγηση του Actos για 7 ημέρες με κετοκοναζόλη 200 mg χορηγούμενη δύο φορές ημερήσια έδειξε τιμές μέσης τετραγωνικής μέσης τιμής (90% CI) για την αμετάβλητη πιογλιταζόνη 1,14 (1,06 - 1,23) για το CΜέγιστη, 1,34 (1,26 - 1,41) για την AUC και 1,87 (1,71 - 2,04) για το Cmin.
Ατορβαστατίνη Ασβέστιο: Συγχορήγηση Actos για 7 ημέρες με ασβέστιο ατορβαστατίνης (LIPITOR®) 80 mg μία φορά ημερησίως κατέληξε σε τιμές μέσης τετραγωνικής μέσης τιμής (90% CI) για την αμετάβλητη πιογλιταζόνη 0,69 (0,57 - 0,85) για το CΜέγιστη, 0,76 (0,65 - 0,88) για την AUC και 0,96 (0,87 - 1,05) για το Cmin. Για την αμετάβλητη ατορβαστατίνη οι τιμές της ελάχιστης τετραγωνικής μέσης τιμής (90% CI) ήταν 0,77 (0,66 - 0,90) για την CΜέγιστη, 0,86 (0,78 - 0,94) για την AUC και 0,92 (0,82 - 1,02) για το Cmin.
Θεοφυλλίνη: Η συγχορήγηση Actos για 7 ημέρες με θεοφυλλίνη 400 mg χορηγούμενη δύο φορές ημερησίως δεν είχε ως αποτέλεσμα καμία αλλαγή στη φαρμακοκινητική του κάθε φαρμάκου.
Cytochrome P450: Βλέπε ΠΡΟΦΥΛΑΞΕΙΣ
Gemfibrozil: Συγχορήγηση γεμφιβροζίλης (από του στόματος 600 mg δύο φορές την ημέρα), ενός αναστολέα του CYP2C8, με πιογλιταζόνη (από του στόματος 30 mg) σε 10 υγιείς εθελοντές που είχαν προηγουμένως υποβληθεί σε θεραπεία για 2 ημέρες πριν από τη χορήγηση γεμφιβροζίλης (από του στόματος 600 mg δύο φορές την ημέρα) είχε ως αποτέλεσμα η έκθεση στην πιογλιταζόνη (AUC0-24) να είναι 226% της έκθεσης στην πιογλιταζόνη απουσία γεμφιβροζίλης (βλέπω ΠΡΟΦΥΛΑΞΕΙΣ).
Rifampin: Συγχορήγηση ριφαμπίνης (από του στόματος 600 mg μία φορά την ημέρα), επαγωγέα του CYP2C8 με πιογλιταζόνη (από του στόματος 30 mg) σε 10 υγιείς εθελοντές που είχαν προηγουμένως υποβληθεί σε θεραπεία για 5 ημέρες προηγουμένως με ριφαμπίνη (από του στόματος 600 mg μία φορά την ημέρα) οδήγησε σε μείωση της AUC της πιογλιταζόνης κατά 54% (βλ. ΠΡΟΦΥΛΑΞΕΙΣ).
Φαρμακοδυναμική και Κλινικές Επιδράσεις
Κλινικές μελέτες αποδεικνύουν ότι το Actos βελτιώνει την ευαισθησία στην ινσουλίνη σε ασθενείς με αντοχή στην ινσουλίνη. Το Actos ενισχύει την κυτταρική ανταπόκριση στην ινσουλίνη, αυξάνει την εξαρτώμενη από την ινσουλίνη απόρριψη γλυκόζης, βελτιώνει την ηπατική ευαισθησία στην ινσουλίνη και βελτιώνει τη δυσλειτουργική ομοιόσταση της γλυκόζης. Σε ασθενείς με διαβήτη τύπου 2, η μειωμένη αντίσταση στην ινσουλίνη που προκαλείται από το Actos έχει ως αποτέλεσμα χαμηλότερες συγκεντρώσεις γλυκόζης στο πλάσμα, χαμηλότερα επίπεδα ινσουλίνης στο πλάσμα και χαμηλότερη HbA1γ αξίες. Με βάση τα αποτελέσματα από μια ανοιχτή μελέτη επέκτασης, τα αποτελέσματα μείωσης της γλυκόζης του Actos φαίνεται ότι παραμένουν τουλάχιστον για ένα χρόνο. Σε ελεγχόμενες κλινικές δοκιμές, το Actos σε συνδυασμό με σουλφονυλουρία, μετφορμίνη ή ινσουλίνη είχε πρόσθετο αποτέλεσμα στον γλυκαιμικό έλεγχο.
Ασθενείς με λιπιδικές ανωμαλίες συμπεριλήφθηκαν σε κλινικές δοκιμές με Actos. Συνολικά, οι ασθενείς που έλαβαν θεραπεία με Actos είχαν μέση μείωση των τριγλυκεριδίων, μέσες αυξήσεις της HDL χοληστερόλης και καμία συνεπή μέση μεταβολή της LDL και της ολικής χοληστερόλης.
Σε μια ελεγχόμενη με εικονικό φάρμακο δοσολογία διάρκειας 26 εβδομάδων, τα μέση επίπεδα τριγλυκεριδίων μειώθηκαν στις ομάδες δόσης των 15 mg, 30 mg και 45 mg Actos σε σύγκριση με τη μέση αύξηση της ομάδας του εικονικού φαρμάκου. Τα μέση επίπεδα HDL αυξήθηκαν σε μεγαλύτερο βαθμό σε ασθενείς που έλαβαν Actos απ 'ό, τι στους ασθενείς που έλαβαν εικονικό φάρμακο. Δεν υπήρχαν σταθερές διαφορές για την LDL και την ολική χοληστερόλη σε ασθενείς που έλαβαν Actos σε σύγκριση με το εικονικό φάρμακο (Πίνακας 1).
Πίνακας 1 Λιπίδια σε μια ελεγχόμενη με εικονικό φάρμακο μελέτη διάρκειας 26 εβδομάδων με εικονικό φάρμακο
| Εικονικό φάρμακο | Actos 15 mg Μια φορά Καθημερινά |
Actos 30 mg Μια φορά Καθημερινά |
Actos 45 mg Μια φορά Καθημερινά |
|
| Τα τριγλυκερίδια (mg / dL) | Ν = 79 | Ν = 79 | Ν = 84 | Ν = 77 |
| Βασική γραμμή (μέση τιμή) | 262.8 | 283.8 | 261.1 | 259.7 |
| Ποσοστό μεταβολής από την αρχική τιμή (μέσος όρος) | 4.8% | -9.0% | -9.6% | -9.3% |
| HDL χοληστερόλη (mg / dL) | Ν = 79 | Ν = 79 | Ν = 83 | Ν = 77 |
| Βασική γραμμή (μέση τιμή) | 41.7 | 40.4 | 40.8 | 40.7 |
| Ποσοστό μεταβολής από την αρχική τιμή (μέσος όρος) | 8.1% | 14.1% | 12.2% | 19.1% |
| LDL χοληστερόλη (mg / dL) | Ν = 65 | Ν = 63 | Ν = 74 | Ν = 62 |
| Βασική γραμμή (μέση τιμή) | 138.8 | 131.9 | 135.6 | 126.8 |
| Ποσοστό μεταβολής από την αρχική τιμή (μέσος όρος) | 4.8% | 7.2% | 5.2% | 6.0% |
| Συνολική χοληστερόλη (mg / dL) | Ν = 79 | Ν = 79 | Ν = 84 | Ν = 77 |
| Βασική γραμμή (μέση τιμή) | 224.6 | 220.0 | 222.7 | 213.7 |
| Ποσοστό μεταβολής από την αρχική τιμή (μέσος όρος) | 4.4% | 4.6% | 3.3% | 6.4% |
Στις δύο άλλες μελέτες μονοθεραπείας (24 εβδομάδες και 16 εβδομάδες) και σε μελέτες συνδυασμένης θεραπείας με σουλφονυλουρία (24 εβδομάδες και 16 εβδομάδες) και μετφορμίνη (24 εβδομάδες και 16 εβδομάδες), τα αποτελέσματα ήταν γενικά συνεπή με τα δεδομένα πάνω από. Στις ελεγχόμενες με εικονικό φάρμακο μελέτες, οι μέσες μεταβολές από την αρχική τιμή που είχαν διορθωθεί με εικονικό φάρμακο μειώθηκαν κατά 5% έως 26% για τα τριγλυκερίδια και αυξημένες κατά 6% έως 13% για την HDL σε ασθενείς που έλαβαν Actos. Ένα παρόμοιο πρότυπο των αποτελεσμάτων παρατηρήθηκε σε μελέτες συνδυαστικής θεραπείας 24 ημερών Actos με σουλφονυλουρία ή μετφορμίνη.
Σε μια μελέτη συνδυασμένης θεραπείας με ινσουλίνη (16 εβδομάδες), μειώθηκε επίσης και η μέση ποσοστιαία μεταβολή της τιμής των τριγλυκεριδίων σε ασθενείς που έλαβαν θεραπεία με Actos, διορθωμένη με εικονικό φάρμακο. Μία μέση μεταβολή της βασικής γραμμής σε LDL χοληστερόλη 7% παρατηρήθηκε για την ομάδα δόσης των 15 mg. Παρόμοια αποτελέσματα με αυτά που σημειώθηκαν παραπάνω για την HDL και την ολική χοληστερόλη παρατηρήθηκαν. Ένα παρόμοιο πρότυπο των αποτελεσμάτων παρατηρήθηκε σε μια μελέτη συνδυασμένης θεραπείας 24 εβδομάδων με το Actos με ινσουλίνη.
Κλινικές μελέτες
Μονοθεραπεία
Στις ΗΠΑ διεξήχθησαν τρεις τυχαιοποιημένες, διπλά τυφλές ελεγχόμενες με εικονικό φάρμακο δοκιμές με διάρκεια από 16 έως 26 εβδομάδες για να αξιολογηθεί η χρήση του Actos ως μονοθεραπεία σε ασθενείς με διαβήτη τύπου 2. Αυτές οι μελέτες εξέτασαν το Actos σε δόσεις έως 45 mg ή εικονικό φάρμακο μία φορά την ημέρα σε 865 ασθενείς.
Σε μια μελέτη διάρκειας 26 εβδομάδων, 408 ασθενείς με διαβήτη τύπου 2 τυχαιοποιήθηκαν για να λάβουν 7,5 mg, 15 mg, 30 mg ή 45 mg Actos ή εικονικό φάρμακο μία φορά την ημέρα. Η θεραπεία με οποιονδήποτε προηγούμενο αντιδιαβητικό παράγοντα διακόπτεται 8 εβδομάδες πριν από την διπλά τυφλή περίοδο. Η θεραπεία με 15 mg, 30 mg και 45 mg Actos προκάλεσε στατιστικά σημαντικές βελτιώσεις στην HbA1c και στη γλυκόζη πλάσματος νηστείας (FPG) στο τελικό σημείο σε σύγκριση με το εικονικό φάρμακο (Σχήμα 1, Πίνακας 2).
Το σχήμα 1 δείχνει τη χρονική πορεία των μεταβολών σε FPG και HbA1c για ολόκληρο τον πληθυσμό της μελέτης σε αυτή τη μελέτη διάρκειας 26 εβδομάδων.

Ο Πίνακας 2 δείχνει HbA1γ και τιμές FPG για ολόκληρο τον πληθυσμό της μελέτης.
Πίνακας 2 Γλυκαιμικές Παράμετροι σε μια ελεγχόμενη με εικονικό φάρμακο δόση διάρκειας 26 εβδομάδων
| Εικονικό φάρμακο | Actos 15 mg Μια φορά Καθημερινά |
Actos 30 mg Μια φορά Καθημερινά |
Actos 45 mg Μια φορά Καθημερινά |
|
| ΣΥΝΟΛΙΚΟΣ ΠΛΗΘΥΣΜΟΣ | ||||
| HbA1γ (%) | Ν = 79 | Ν = 79 | Ν = 85 | Ν = 76 |
| Βασική γραμμή (μέση τιμή) | 10.4 | 10.2 | 10.2 | 10.3 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος+) | 0.7 | -0.3 | -0.3 | -0.9 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο+) | -1.0* | -1.0* | -1.6* | |
| FPG (mg / dL) | Ν = 79 | Ν = 79 | Ν = 84 | Ν = 77 |
| Βασική γραμμή (μέση τιμή) | 268 | 267 | 269 | 276 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος+) | 9 | -30 | -32 | -56 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο+) | -39* | -41* | -65* | |
|
+ Προσαρμοσμένη για τη γραμμή βάσης, συγκεντρώνει το κέντρο και συγκεντρώνεται στο κέντρο από την αλληλεπίδραση της θεραπείας * p ‰ ‰ ¤ 0,050 εικονικό φάρμακο |
Ο πληθυσμός της μελέτης περιελάμβανε ασθενείς που δεν είχαν προηγουμένως υποβληθεί σε θεραπεία με αντιδιαβητικά φάρμακα (naive; 31%) και στους ασθενείς που έλαβαν αντιδιαβητική φαρμακευτική αγωγή κατά τη στιγμή της εγγραφής στη μελέτη (προηγουμένως υποβληθεί σε θεραπεία. 69%). Τα δεδομένα για τα υποσύνολα ασθενών που έχουν υποβληθεί προηγουμένως σε θεραπεία και έχουν υποβληθεί σε προηγούμενη θεραπεία παρουσιάζονται στον Πίνακα 3. Όλοι οι ασθενείς εισήλθαν σε περίοδο 8 εβδομάδων έκπλυσης / διαρροής πριν από τη διπλή τυφλή θεραπεία. Αυτή η χρονική περίοδος συσχετίζεται με μικρή αλλαγή στην HbA1γ και τιμές FPG από την εξέταση έως τη βασική γραμμή για τους ασθενείς της νόσου. Ωστόσο, για την ομάδα που είχε προηγουμένως υποβληθεί σε θεραπεία, η απόπλυση από προηγούμενη αντιδιαβητική φαρμακευτική αγωγή είχε ως αποτέλεσμα την επιδείνωση του γλυκαιμικού ελέγχου και την αύξηση της HbA1γ και FPG. Παρόλο που οι περισσότεροι ασθενείς στην ομάδα που είχε προηγουμένως υποβληθεί σε θεραπεία είχαν μείωση από την αρχική τιμή της HbA1γ και FPG με Actos, σε πολλές περιπτώσεις οι τιμές δεν επέστρεφαν στα επίπεδα διαλογής μέχρι το τέλος της μελέτης. Ο σχεδιασμός μελέτης δεν επέτρεψε την αξιολόγηση των ασθενών που μεταπήδησαν απευθείας στο Actos από άλλο αντιδιαβητικό παράγοντα.
Πίνακας 3 Γλυκαιμικές παράμετροι σε μια ελεγχόμενη με εικονικό φάρμακο δόση διάρκειας 26 εβδομάδων
| Εικονικό φάρμακο | Actos 15 mg Μια φορά Καθημερινά |
Actos 30 mg Μια φορά Καθημερινά |
Actos 45 mg Μια φορά Καθημερινά |
|
| Naïve to Therapy HbA1γ (%) |
Ν = 25 | Ν = 26 | Ν = 26 | Ν = 21 |
| Διαλογή (μέσος όρος) | 9.3 | 10.0 | 9.5 | 9.8 |
| Βασική γραμμή (μέση τιμή) | 9.0 | 9.9 | 9.3 | 10.0 |
| Μεταβολή από τη βασική γραμμή (προσαρμοσμένη μέση τιμή *) | 0.6 | -0.8 | -0.6 | -1.9 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένη μέση τιμή *) | -1.4 | -1.3 | -2.6 | |
| FPG (mg / dL) | Ν = 25 | Ν = 26 | Ν = 26 | Ν = 21 |
| Διαλογή (μέσος όρος) | 223 | 245 | 239 | 239 |
| Βασική γραμμή (μέση τιμή) | 229 | 251 | 225 | 235 |
| Μεταβολή από τη βασική γραμμή (προσαρμοσμένη μέση τιμή *) | 16 | -37 | -41 | -64 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένη μέση τιμή *) | -52 | -56 | -80 | |
| Προηγουμένως υποβληθεί σε θεραπεία HbA1γ (%) |
Ν = 54 | Ν = 53 | Ν = 59 | Ν = 55 |
| Διαλογή (μέσος όρος) | 9.3 | 9.0 | 9.1 | 9.0 |
| Βασική γραμμή (μέση τιμή) | 10.9 | 10.4 | 10.4 | 10.6 |
| Μεταβολή από τη βασική γραμμή (προσαρμοσμένη μέση τιμή *) | 0.8 | -0.1 | -0.0 | -0.6 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένη μέση τιμή *) | -1.0 | -0.9 | -1.4 | |
| FPG (mg / dL) | Ν = 54 | Ν = 53 | Ν = 58 | Ν = 56 |
| Διαλογή (μέσος όρος) | 222 | 209 | 230 | 215 |
| Βασική γραμμή (μέση τιμή) | 285 | 275 | 286 | 292 |
| Μεταβολή από τη βασική γραμμή (προσαρμοσμένη μέση τιμή *) | 4 | -32 | -27 | -55 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένη μέση τιμή *) | -36 | -31 | -59 | |
| * Προσαρμοσμένο για το κέντρο βάσης και το συγκεντρωμένο κέντρο |
Σε μια ελεγχόμενη με εικονικό φάρμακο μελέτη διάρκειας 24 εβδομάδων, 260 ασθενείς με διαβήτη τύπου 2 τυχαιοποιήθηκαν σε μία από δύο ομάδες θεραπείας με αναγκαστική τιτλοποίηση του Actos ή σε ομάδα εικονικού εικονικού εικονικού φαρμάκου. Η θεραπεία με οποιονδήποτε προηγούμενο αντιδιαβητικό παράγοντα διακόπτεται 6 εβδομάδες πριν από την περίοδο διπλού-τυφλού. Σε μία ομάδα θεραπείας με Actos, οι ασθενείς έλαβαν αρχική δόση 7,5 mg μία φορά την ημέρα. Μετά από τέσσερις εβδομάδες, η δόση αυξήθηκε στα 15 mg μία φορά την ημέρα και μετά από άλλες τέσσερις εβδομάδες, η δόση αυξήθηκε στα 30 mg μία φορά την ημέρα για το υπόλοιπο της μελέτης (16 εβδομάδες). Στη δεύτερη ομάδα θεραπείας με Actos, οι ασθενείς έλαβαν αρχική δόση των 15 mg μία φορά την ημέρα και τιτλοποιήθηκαν σε 30 mg μία φορά την ημέρα και 45 mg μία φορά την ημέρα με παρόμοιο τρόπο. Η θεραπεία με Actos, όπως περιγράφεται, παρήγαγε στατιστικά σημαντικές βελτιώσεις στην HbA1γ και το FPG στο τελικό σημείο σε σύγκριση με το εικονικό φάρμακο (Πίνακας 4).
Πίνακας 4 Γλυκαιμικές παράμετροι σε μια ελεγχόμενη με εικονικό φάρμακο μελέτη 24 ωρών με εικονικό φάρμακο
| Εικονικό φάρμακο | Actos 30 mg+ Μια φορά τη μέρα |
Actos 45 mg+ Μια φορά τη μέρα |
|
| Συνολικός πληθυσμός HbA1γ (%) |
Ν = 83 | Ν = 85 | Ν = 85 |
| Βασική γραμμή (μέση τιμή) | 10.8 | 10.3 | 10.8 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος++) | 0.9 | -0.6 | -0.6 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο++) | -1.5* | -1.5* | |
| FPG (mg / dL) | Ν = 78 | Ν = 82 | Ν = 85 |
| Βασική γραμμή (μέση τιμή) | 279 | 268 | 281 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος++) | 18 | -44 | -50 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο++) | -62* | -68* | |
|
+ Τελική δόση σε αναγκαστική τιτλοδότηση ++ Προσαρμοσμένη για τη γραμμή βάσης, συγκεντρώνει το κέντρο και συγκεντρώνεται στο κέντρο από την αλληλεπίδραση της θεραπείας * p ‰ ‰ ¤ 0,050 εικονικό φάρμακο |
Για τους ασθενείς που δεν είχαν προηγουμένως λάβει θεραπεία με αντιδιαβητικό φάρμακο (24%), οι μέσες τιμές κατά τη διαλογή ήταν 10,1% για την HbA1γ και 238 mg / dL για FPG. Κατά την έναρξη, η μέση τιμή HbA1γ ήταν 10,2% και η μέση τιμή FPG ήταν 243 mg / dL. Σε σύγκριση με το εικονικό φάρμακο, η θεραπεία με Actos που τιτλοποιήθηκε σε τελική δόση των 30 mg και 45 mg είχε ως αποτέλεσμα μειώσεις από την αρχική τιμή της μέσης HbA1γ 2,3% και 2,6% και μέση τιμή FPG 63 mg / dL και 95 mg / dL, αντίστοιχα. Για τους ασθενείς που είχαν προηγουμένως υποβληθεί σε θεραπεία με αντιδιαβητικό φάρμακο (76%), το φάρμακο αυτό διακόπτεται κατά τον έλεγχο. Οι μέσες τιμές στην εξέταση ήταν 9,4% για την HbA1γ και 216 mg / dL για FPG. Κατά την έναρξη, η μέση τιμή HbA1γ ήταν 10,7% και η μέση τιμή FPG ήταν 290 mg / dL. Σε σύγκριση με το εικονικό φάρμακο, η θεραπεία με Actos που τιτλοποιήθηκε σε τελική δόση των 30 mg και 45 mg είχε ως αποτέλεσμα μειώσεις από την αρχική τιμή της μέσης HbA1γ 1,3% και 1,4% και μέσο όρο FPG των 55 mg / dL και 60 mg / dL, αντίστοιχα. Για πολλούς ασθενείς που υποβλήθηκαν προηγουμένως σε θεραπεία, HbA1γ και η FPG δεν είχε επιστρέψει στα επίπεδα διαλογής μέχρι το τέλος της μελέτης.
Σε μια μελέτη διάρκειας 16 εβδομάδων, 197 ασθενείς με διαβήτη τύπου 2 τυχαιοποιήθηκαν για θεραπεία με 30 mg Actos ή εικονικό φάρμακο μία φορά την ημέρα. Η θεραπεία με οποιονδήποτε προηγούμενο αντιδιαβητικό παράγοντα διακόπτεται 6 εβδομάδες πριν από την περίοδο διπλού-τυφλού. Η θεραπεία με 30 mg Actos προκάλεσε στατιστικά σημαντικές βελτιώσεις στην HbA1γ και FPG στο τελικό σημείο σε σύγκριση με το εικονικό φάρμακο (Πίνακας 5).
Πίνακας 5 Γλυκαιμικές παράμετροι σε ελεγχόμενη με εικονικό φάρμακο μελέτη 16 εβδομάδων
| Εικονικό φάρμακο | Actos 30 mg Μια φορά τη μέρα |
|
| Συνολικός πληθυσμός HbA1γ (%) |
Ν = 93 | Ν = 100 |
| Βασική γραμμή (μέση τιμή) | 10.3 | 10.5 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος+) | 0.8 | -0.6 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο+) | -1.4* | |
| FPG (mg / dL) | Ν = 91 | Ν = 99 |
| Βασική γραμμή (μέση τιμή) | 270 | 273 |
| Μεταβολή από τη γραμμή βάσης (προσαρμοσμένος μέσος όρος+) | 8 | -50 |
| Διαφορά από το εικονικό φάρμακο (προσαρμοσμένο μέσο όρο+) | -58* | |
|
+ Προσαρμοσμένη για τη γραμμή βάσης, συγκεντρώνει το κέντρο και συγκεντρώνεται στο κέντρο από την αλληλεπίδραση της θεραπείας * p ‰ ‰ ¤ 0,050 εικονικό φάρμακο |
Για τους ασθενείς που δεν είχαν προηγουμένως λάβει θεραπεία με αντιδιαβητικό φάρμακο (40%), οι μέσες τιμές κατά τη διαλογή ήταν 10,3% για την HbA1c και 240 mg / dL για FPG. Κατά την έναρξη, η μέση τιμή HbA1γ ήταν 10,4% και η μέση τιμή FPG ήταν 254 mg / dL. Σε σύγκριση με το εικονικό φάρμακο, η θεραπεία με Actos 30 mg είχε ως αποτέλεσμα μειώσεις της μέσης HbA από την αρχική τιμή1γ του 1,0% και του μέσου όρου FPG των 62 mg / dL. Για τους ασθενείς που είχαν προηγουμένως υποβληθεί σε θεραπεία με αντιδιαβητικό φάρμακο (60%), το φάρμακο αυτό διακόπτεται κατά τον έλεγχο. Οι μέσες τιμές στην εξέταση ήταν 9,4% για την HbA1γ και 216 mg / dL για FPG. Κατά την έναρξη, η μέση τιμή HbA1γ ήταν 10,6% και η μέση τιμή FPG ήταν 287 mg / dL. Σε σύγκριση με το εικονικό φάρμακο, η θεραπεία με Actos 30 mg είχε ως αποτέλεσμα μειώσεις της μέσης HbA από την αρχική τιμή1γ 1,3% και μέση τιμή FPG 46 mg / dL. Για πολλούς ασθενείς που υποβλήθηκαν προηγουμένως σε θεραπεία, HbA1γ και η FPG δεν είχε επιστρέψει στα επίπεδα διαλογής μέχρι το τέλος της μελέτης.
Συνδυαστική Θεραπεία
Τρεις εβδομαδιαίως τυχαιοποιημένες, διπλά τυφλές, ελεγχόμενες με εικονικό φάρμακο κλινικές μελέτες και τρεις τυχαιοποιημένες, διπλά τυφλές, ελεγχόμενες με δόση, τυχαιοποιημένες, 24 εβδομάδες πραγματοποιήθηκαν κλινικές μελέτες για την αξιολόγηση των επιδράσεων του Actos σε γλυκαιμικό έλεγχο σε ασθενείς με διαβήτη τύπου 2 οι οποίοι ήταν ανεπαρκείς (HbA1γ ≥ 8%) παρά την τρέχουσα θεραπεία με σουλφονυλουρία, μετφορμίνη ή ινσουλίνη. Προηγούμενη θεραπεία διαβήτη μπορεί να ήταν μονοθεραπεία ή θεραπεία συνδυασμού.
Μελέτες Actos Plus Sulfonylurea
Διεξήχθησαν δύο κλινικές μελέτες με το Actos σε συνδυασμό με μια σουλφονυλουρία. Και οι δύο μελέτες περιελάμβαναν ασθενείς με διαβήτη τύπου 2 σε σουλφονυλουρία, είτε μόνοι είτε σε συνδυασμό με άλλο αντιδιαβητικό παράγοντα. Όλοι οι άλλοι αντιδιαβητικοί παράγοντες απομακρύνθηκαν πριν από την έναρξη της θεραπείας της μελέτης. Στην πρώτη μελέτη, 560 ασθενείς τυχαιοποιήθηκαν για να λάβουν 15 mg ή 30 mg Actos ή εικονικό φάρμακο μία φορά ημερησίως για 16 εβδομάδες επιπλέον της τρέχουσας αγωγής με σουλφονυλουρία. Σε σύγκριση με το εικονικό φάρμακο την εβδομάδα 16, η προσθήκη Actos στη σουλφονυλουρία μείωσε σημαντικά τη μέση HbA1γ κατά 0,9% και 1,3% και μέση τιμή FPG κατά 39 mg / dL και 58 mg / dL για τις δόσεις των 15 mg και 30 mg, αντίστοιχα.
Στη δεύτερη μελέτη, 702 ασθενείς τυχαιοποιήθηκαν για να λάβουν 30 mg ή 45 mg Actos άπαξ ημερησίως για 24 εβδομάδες επιπλέον της τρέχουσας θεραπείας σουλφονυλουρίας. Οι μέσες μειώσεις από την αρχική τιμή την εβδομάδα 24 σε HbA1γ ήταν 1,55% και 1,67% για τις δόσεις των 30 mg και 45 mg, αντίστοιχα. Οι μέσες μειώσεις από την αρχική τιμή σε FPG ήταν 51,5 mg / dL και 56,1 mg / dL.
Το θεραπευτικό αποτέλεσμα του Actos σε συνδυασμό με σουλφονυλουρία παρατηρήθηκε σε ασθενείς ανεξάρτητα από το εάν οι ασθενείς έλαβαν χαμηλές, μεσαίες ή υψηλές δόσεις σουλφονυλουρίας.
Μελέτες Actos Plus Metformin
Διεξήχθησαν δύο κλινικές μελέτες με το Actos σε συνδυασμό με μετφορμίνη. Και οι δύο μελέτες περιελάμβαναν ασθενείς με διαβήτη τύπου 2 με μετφορμίνη, είτε μόνοι είτε σε συνδυασμό με άλλο αντιδιαβητικό παράγοντα. Όλοι οι άλλοι αντιδιαβητικοί παράγοντες απομακρύνθηκαν πριν από την έναρξη της θεραπείας της μελέτης. Στην πρώτη μελέτη, 328 ασθενείς τυχαιοποιήθηκαν να λάβουν είτε 30 mg Actos είτε εικονικό φάρμακο μία φορά ημερησίως για 16 εβδομάδες επιπλέον της τρέχουσας αγωγής με μετφορμίνη. Σε σύγκριση με το εικονικό φάρμακο την εβδομάδα 16, η προσθήκη Actos στη μετφορμίνη μείωσε σημαντικά τη μέση HbA1γ κατά 0,8% και μείωσε τη μέση τιμή FPG κατά 38 mg / dL.
Στη δεύτερη μελέτη, 827 ασθενείς τυχαιοποιήθηκαν για να λάβουν είτε 30 mg είτε 45 mg Actos άπαξ ημερησίως για 24 εβδομάδες επιπλέον της τρέχουσας αγωγής με μετφορμίνη. Οι μέσες μειώσεις από την αρχική τιμή την εβδομάδα 24 σε HbA1γ ήταν 0,80% και 1,01% για τις δόσεις των 30 mg και 45 mg, αντίστοιχα. Οι μέσες μειώσεις από την αρχική τιμή σε FPG ήταν 38,2 mg / dL και 50,7 mg / dL.
Το θεραπευτικό αποτέλεσμα του Actos σε συνδυασμό με μετφορμίνη παρατηρήθηκε σε ασθενείς ανεξάρτητα από το εάν οι ασθενείς έλαβαν χαμηλότερες ή υψηλότερες δόσεις μετφορμίνης.
Μελέτες ινσουλίνης Actos Plus
Διεξήχθησαν δύο κλινικές μελέτες με το Actos σε συνδυασμό με ινσουλίνη. Και οι δύο μελέτες περιελάμβαναν ασθενείς με διαβήτη τύπου 2 σε ινσουλίνη, είτε μόνοι είτε σε συνδυασμό με άλλο αντιδιαβητικό παράγοντα. Όλοι οι άλλοι αντιδιαβητικοί παράγοντες απομακρύνθηκαν πριν από την έναρξη της θεραπείας της μελέτης. Στην πρώτη μελέτη, τυχαιοποιήθηκαν 566 ασθενείς που έλαβαν μέση τιμή 60,5 μονάδων ημερησίως ινσουλίνης λαμβάνουν είτε 15 mg είτε 30 mg Actos ή εικονικό φάρμακο μία φορά την ημέρα για 16 εβδομάδες επιπλέον της ινσουλίνης τους αγωγή. Σε σύγκριση με το εικονικό φάρμακο την εβδομάδα 16, η προσθήκη Actos σε ινσουλίνη μείωσε σημαντικά τόσο την HbA1γ κατά 0,7% και 1,0% και FPG κατά 35 mg / dL και 49 mg / dL για τη δόση των 15 mg και 30 mg, αντίστοιχα.
Στη δεύτερη μελέτη, 690 ασθενείς που έλαβαν μέση τιμή 60,0 μονάδες ημερησίως ινσουλίνης έλαβαν είτε 30 mg είτε 45 mg Actos άπαξ ημερησίως για 24 εβδομάδες, επιπλέον του τρέχοντος σχήματος ινσουλίνης. Οι μέσες μειώσεις από την αρχική τιμή την εβδομάδα 24 σε HbA1γ ήταν 1,17% και 1,46% για τις δόσεις των 30 mg και 45 mg, αντίστοιχα. Οι μέσες μειώσεις από την αρχική τιμή σε FPG ήταν 31,9 mg / dL και 45,8 mg / dL. Ο βελτιωμένος γλυκαιμικός έλεγχος συνοδεύτηκε από μέσες μειώσεις από τις βασικές απαιτήσεις στις απαιτήσεις δόσης ινσουλίνης 6,0% και 9,4% ημερησίως για τη δόση 30 mg και 45 mg, αντίστοιχα.
Η θεραπευτική επίδραση του Actos σε συνδυασμό με ινσουλίνη παρατηρήθηκε σε ασθενείς ανεξάρτητα από το εάν οι ασθενείς έλαβαν χαμηλότερες ή υψηλότερες δόσεις ινσουλίνης.
μπλουζα
Ενδείξεις και χρήση
Το Actos ενδείκνυται ως συμπλήρωμα της δίαιτας και της άσκησης για τη βελτίωση του γλυκαιμικού ελέγχου σε ενήλικες με σακχαρώδη διαβήτη τύπου 2.
μπλουζα
Αντενδείξεις
Η έναρξη του Actos σε ασθενείς με καθιερωμένη καρδιακή ανεπάρκεια κατηγορίας ΙΙΙ ή IV της Νέας Υόρκης (NYHA) αντενδείκνυται (βλ. ΣΥΓΚΕΚΡΙΜΕΝΗ ΠΡΟΣΟΧΗ).
Το Actos αντενδείκνυται σε ασθενείς με γνωστή υπερευαισθησία σε αυτό το προϊόν ή σε οποιοδήποτε από τα συστατικά του.
μπλουζα
Προειδοποιήσεις
Καρδιακή ανεπάρκεια και άλλες καρδιακές επιδράσεις
Το Actos, όπως και άλλα θειαζολιδινοδιόνια, μπορεί να προκαλέσει κατακράτηση υγρών όταν χρησιμοποιείται μόνο του ή σε συνδυασμό με άλλους αντιδιαβητικούς παράγοντες, συμπεριλαμβανομένης της ινσουλίνης. Η κατακράτηση υγρών μπορεί να οδηγήσει ή να επιδεινώσει την καρδιακή ανεπάρκεια. Οι ασθενείς πρέπει να παρακολουθούνται για σημεία και συμπτώματα καρδιακής ανεπάρκειας. Σε περίπτωση εμφάνισης αυτών των σημείων και συμπτωμάτων, η καρδιακή ανεπάρκεια θα πρέπει να αντιμετωπίζεται σύμφωνα με τα ισχύοντα πρότυπα περίθαλψης. Επιπλέον, πρέπει να ληφθεί υπόψη η διακοπή ή η μείωση της δόσης του Actos (βλ ΣΥΓΚΕΚΡΙΜΕΝΗ ΠΡΟΣΟΧΗ). Ασθενείς με καρδιακή κατάσταση κατηγορίας III και IV NYHA δεν μελετήθηκαν κατά τη διάρκεια κλινικών δοκιμών πριν από την έγκριση και το Actos δεν συνιστάται σε αυτούς τους ασθενείς (βλ. ΣΥΓΚΕΚΡΙΜΕΝΗ ΠΡΟΣΟΧΗ και ΑΝΤΕΝΔΕΙΞΕΙΣ).
Σε μία διπλά τυφλή, ελεγχόμενη με εικονικό φάρμακο κλινική δοκιμή διάρκειας 16 εβδομάδων, στην οποία συμμετείχαν 566 ασθενείς με τύπο 2 διαβήτη, το Actos σε δόσεις των 15 mg και 30 mg σε συνδυασμό με ινσουλίνη συγκρίθηκε με τη θεραπεία με ινσουλίνη μόνος. Αυτή η μελέτη περιελάμβανε ασθενείς με μακροχρόνιο διαβήτη και υψηλό επιπολασμό προϋπαρχουσών ιατρικών καταστάσεων, ως εξής: αρτηριακή υπέρταση (57,2%), περιφερική νευροπάθεια (22,6%), στεφανιαία νόσο (19,6%), αμφιβληστροειδοπάθεια (13,1%), μυοκαρδιακή (4,8%), αγγειακή νόσο (6,4%), στηθάγχη (4,4%), εγκεφαλικό επεισόδιο και / ή παροδική ισχαιμική προσβολή (4,1%) και συμφορητική καρδιακή ανεπάρκεια (2,3%).
Στη μελέτη αυτή, δύο από τους 191 ασθενείς που έλαβαν 15 mg Actos συν ινσουλίνη (1,1%) και δύο από τους 188 ασθενείς που έλαβαν 30 mg Το Actos συν ινσουλίνη (1,1%) εμφάνισε συμφορητική καρδιακή ανεπάρκεια σε σύγκριση με κανένα από τους 187 ασθενείς που έλαβαν μόνο ινσουλινοθεραπεία. Και οι τέσσερις από αυτούς τους ασθενείς είχαν προηγούμενες ιστορικές καρδιαγγειακές παθήσεις, συμπεριλαμβανομένης της στεφανιαίας νόσου, προηγούμενες διαδικασίες CABG και έμφραγμα του μυοκαρδίου. Σε μία ελεγχόμενη με δόση μελέτη, στην οποία το Actos συγχορηγήθηκε με ινσουλίνη, 0,3% των ασθενών (1/345) σε 30 mg και 0,9% (3/345) των ασθενών σε 45 mg ανέφεραν CHF ως σοβαρή ανεπιθύμητη ενέργεια .
Η ανάλυση των δεδομένων από αυτές τις μελέτες δεν αναγνώρισε συγκεκριμένους παράγοντες που προβλέπουν αυξημένο κίνδυνο συμφορητικής καρδιακής ανεπάρκειας σε συνδυασμένη θεραπεία με ινσουλίνη.
Σε διαβήτη τύπου 2 και συμφορητική καρδιακή ανεπάρκεια (συστολική δυσλειτουργία)
Διεξήχθη μια μελέτη ασφάλειας 24 εβδομάδων μετά την κυκλοφορία για τη σύγκριση του Actos (n = 262) με τη γλυβουρίδη (n = 256) σε ανεξέλεγκτους διαβητικούς ασθενείς (μέση HbA1γ 8,8% στην αρχική τιμή) με καρδιακή ανεπάρκεια και κλάσμα εξώθησης NYHA κατηγορίας ΙΙ και ΙΙΙ μικρότερη από 40% (μέση τιμή EF 30% κατά την έναρξη). Κατά τη διάρκεια της μελέτης, η νοσοκομειακή νοσοκομειακή περίθαλψη για συμφορητική καρδιακή ανεπάρκεια αναφέρθηκε σε ποσοστό 9,9% στους ασθενείς με Actos σε σύγκριση με το 4,7% των ασθενών σε γλυβουρίδη με διαφορά θεραπείας που παρατηρήθηκε από το 6 εβδομάδες. Αυτό το ανεπιθύμητο συμβάν που συσχετίζεται με το Actos ήταν πιο αξιοσημείωτο σε ασθενείς που έλαβαν ινσουλίνη κατά την έναρξη και σε ασθενείς ηλικίας άνω των 64 ετών. Δεν παρατηρήθηκε διαφορά στην καρδιαγγειακή θνησιμότητα μεταξύ των ομάδων θεραπείας.
Το Actos πρέπει να ξεκινά με τη χαμηλότερη εγκεκριμένη δόση, εάν συνταγογραφείται για ασθενείς με διαβήτη τύπου 2 και συστολική καρδιακή ανεπάρκεια (κατηγορία NYHA II). Εάν απαιτείται μεταγενέστερη κλιμάκωση της δόσης, η δόση πρέπει να αυξηθεί σταδιακά μόνο μετά από αρκετές μήνες θεραπείας με προσεκτική παρακολούθηση για αύξηση βάρους, οίδημα ή σημεία και συμπτώματα CHF παρόξυνση.
Προοπτική κλινική δοκιμή της πιγλιταζόνης σε μακροαγγειακά συμβάματα (PROactive)
Σε PROactive, 5238 ασθενείς με διαβήτη τύπου 2 και προηγούμενο ιστορικό μακροαγγειακής νόσου έλαβαν θεραπεία με Actos (n = 2605), τιτλοφορήθηκαν με δύναμη έως 45 mg μία φορά την ημέρα ή με εικονικό φάρμακο (n = 2633) (βλέπε ΑΝΕΠΙΘΥΜΗΤΕΣ ΕΝΕΡΓΕΙΕΣ). Το ποσοστό των ασθενών που εμφάνισαν σοβαρή καρδιακή ανεπάρκεια ήταν υψηλότερο σε ασθενείς που έλαβαν Actos (5,7%, n = 149) σε σχέση με τους ασθενείς που έλαβαν εικονικό φάρμακο (4,1%, n = 108). Η επίπτωση του θανάτου μετά από έκθεση σοβαρής καρδιακής ανεπάρκειας ήταν 1,5% (n = 40) σε ασθενείς που έλαβαν Actos και 1,4% (n = 37) σε ασθενείς που έλαβαν εικονικό φάρμακο. Σε ασθενείς που έλαβαν θεραπευτική αγωγή με ινσουλίνη κατά την έναρξη της θεραπείας, η επίπτωση σοβαρής καρδιακής ανεπάρκειας ήταν 6,3% (n = 54/864) με Actos και 5,2% (n = 47/896) με εικονικό φάρμακο. Για τους ασθενείς που έλαβαν θεραπευτική αγωγή με σουλφονυλουρία κατά την έναρξη της θεραπείας, η συχνότητα εμφάνισης σοβαρής καρδιακής ανεπάρκειας ήταν 5,8% (n = 94/1624) με Actos και 4,4% (n = 71/1626) με εικονικό φάρμακο.
μπλουζα
Προφυλάξεις
Γενικός
Το Actos ασκεί την αντιυπεργλυκαιμική δράση του μόνο με την παρουσία ινσουλίνης. Επομένως, το Actos δεν πρέπει να χρησιμοποιείται σε ασθενείς με διαβήτη τύπου 1 ή για τη θεραπεία της διαβητικής κετοξέωσης.
Υπογλυκαιμία: Οι ασθενείς που λαμβάνουν Actos σε συνδυασμό με ινσουλίνη ή από του στόματος υπογλυκαιμικούς παράγοντες μπορεί να διατρέχουν κίνδυνο υπογλυκαιμίας και μπορεί να είναι απαραίτητη η μείωση της δόσης του ταυτόχρονου παράγοντα.
Καρδιαγγειακά: Στις κλινικές δοκιμές ελεγχόμενες με εικονικό φάρμακο στις Ηνωμένες Πολιτείες οι οποίες απέκλεισαν τους ασθενείς με καρδιακή κατάσταση κατηγορίας III και IV της Νέας Υόρκης Καρδιάς (NYHA), η συχνότητα εμφάνισης οι σοβαρές καρδιακές ανεπιθύμητες ενέργειες που σχετίζονται με την αύξηση του όγκου δεν αυξήθηκαν σε ασθενείς που έλαβαν Actos ως μονοθεραπεία ή σε συνδυασμό με σουλφονυλουρίες ή μετφορμίνη vs. στους ασθενείς που έλαβαν εικονικό φάρμακο. Σε μελέτες συνδυασμού ινσουλίνης, ένας μικρός αριθμός ασθενών με ιστορικό προϋπηρεσίας καρδιακή νόσος εμφάνισε συμφορητική καρδιακή ανεπάρκεια όταν υποβλήθηκε σε θεραπεία με Actos σε συνδυασμό με ινσουλίνη (βλέπω ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ). Ασθενείς με καρδιακή κατάσταση κατηγορίας III και IV NYHA δεν μελετήθηκαν σε αυτές τις κλινικές δοκιμές του Actos. Το Actos δεν ενδείκνυται σε ασθενείς με καρδιακή κατάσταση κατηγορίας III ή IV NYHA.
Στην εμπειρία μετά την κυκλοφορία του Actos, έχουν αναφερθεί περιπτώσεις συμφορητικής καρδιακής ανεπάρκειας σε ασθενείς με και χωρίς προηγούμενη γνωστή καρδιακή νόσο.
Οίδημα: Το Actos πρέπει να χρησιμοποιείται με προσοχή σε ασθενείς με οίδημα. Σε όλες τις κλινικές δοκιμές των ΗΠΑ, το οίδημα αναφέρθηκε συχνότερα σε ασθενείς που έλαβαν Actos απ 'ότι σε ασθενείς που έλαβαν εικονικό φάρμακο και φαίνεται να σχετίζεται με τη δόση (βλ. ΑΝΕΠΙΘΥΜΗΤΕΣ ΕΝΕΡΓΕΙΕΣ). Στην εμπειρία μετά την κυκλοφορία του φαρμάκου, έχουν ληφθεί αναφορές για έναρξη ή επιδείνωση του οιδήματος. Δεδομένου ότι τα θειαζολιδινεδιόνια, συμπεριλαμβανομένου του Actos, μπορούν να προκαλέσουν κατακράτηση υγρών, τα οποία μπορεί να επιδεινώσουν ή να οδηγήσουν σε συμφορητική καρδιακή ανεπάρκεια, το Actos θα πρέπει να χρησιμοποιείται με προσοχή σε ασθενείς με κίνδυνο καρδιακής ανεπάρκειας. Οι ασθενείς πρέπει να παρακολουθούνται για σημεία και συμπτώματα καρδιακής ανεπάρκειας (βλ ΣΥΓΚΕΚΡΙΜΕΝΗ ΠΡΟΣΟΧΗ, ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ, και ΠΡΟΦΥΛΑΞΕΙΣ).
Αύξηση βάρους: Η αύξηση του σωματικού βάρους που παρατηρήθηκε με δόση παρατηρήθηκε μόνο με Actos και σε συνδυασμό με άλλους υπογλυκαιμικούς παράγοντες (Πίνακας 6). Ο μηχανισμός αύξησης του σωματικού βάρους είναι ασαφής, αλλά πιθανώς συνεπάγεται συνδυασμό συγκράτησης υγρών και συσσώρευσης λίπους.
Πίνακας 6 Αλλαγές βάρους (kg) από την αρχική τιμή κατά τη διάρκεια διπλών τυφλών κλινικών δοκιμών με Actos
| Ομάδα ελέγχου (Εικονικό φάρμακο) |
Actos 15 mg |
Actos 30 mg |
Actos 45 mg |
||
| Διάμεσος (25th/75th εκατοστημόριο) |
Διάμεσος (25th/75th εκατοστημόριο) |
Διάμεσος (25th/75th εκατοστημόριο) |
Διάμεσος (25th/75th εκατοστημόριο) |
||
| Μονοθεραπεία | -1.4 (-2.7/0.0) n = 256 |
0.9(-0.5/3.4) n = 79 |
1.0(-0.9/3.4) n = 188 |
2.6 (0.2/5.4) n = 79 |
|
| Συνδυαστική Θεραπεία | Σουλφονυλουρία | -0.5 (-1.8/0.7) n = 187 |
2.0 (0.2/3.2) n = 183 |
3.1 (1.1/5.4) n = 528 |
4.1 (1.8/7.3) n = 333 |
| Μετφορμίνη | -1.4 (-3.2/0.3) n = 160 |
N / A | 0.9(-0.3/3.2) n = 567 |
1.8(-0.9/5.0) n = 407 |
|
| Ινσουλίνη | 0.2 (-1.4/1.4) n = 182 |
2.3 (0.5/4.3) n = 190 |
3.3 (0.9/6.3) n = 522 |
4.1 (1.4/6.8) n = 338 |
|
| Σημείωση: Διάρκεια δοκιμής 16 έως 26 εβδομάδων |
Ωοθυλακιορρηξία: Η θεραπεία με Actos, όπως και άλλες θειαζολιδινεδιόνες, μπορεί να οδηγήσει σε ωοθυλακιορρηξία σε ορισμένες προεμμηνοπαυσιακές γυναίκες χωρίς ωορρηξία. Ως αποτέλεσμα, αυτοί οι ασθενείς μπορεί να διατρέχουν αυξημένο κίνδυνο εγκυμοσύνης κατά τη λήψη του Actos. Επομένως, θα πρέπει να συνιστάται επαρκής αντισύλληψη σε προεμμηνοπαυσιακές γυναίκες. Αυτό το πιθανό αποτέλεσμα δεν έχει διερευνηθεί σε κλινικές μελέτες, οπότε η συχνότητα αυτού του περιστατικού δεν είναι γνωστή.
Αιματολογικά: Το Actos μπορεί να προκαλέσει μειώσεις της αιμοσφαιρίνης και του αιματοκρίτη. Σε όλες τις κλινικές μελέτες, οι μέσες τιμές αιμοσφαιρίνης μειώθηκαν κατά 2% έως 4% σε ασθενείς που έλαβαν Actos. Αυτές οι αλλαγές εμφανίστηκαν κυρίως κατά τις πρώτες 4 έως 12 εβδομάδες θεραπείας και παρέμειναν σχετικά σταθερές στη συνέχεια. Αυτές οι αλλαγές μπορεί να σχετίζονται με αυξημένο όγκο πλάσματος και έχουν σπάνια συσχετιστεί με οποιεσδήποτε σημαντικές αιματολογικές κλινικές επιδράσεις (βλ ΑΝΕΠΙΘΥΜΗΤΕΣ ΕΝΕΡΓΕΙΕΣ, Εργαστηριακές ανωμαλίες).
Ηπατικές επιδράσεις: Σε κλινικές μελέτες προ-έγκρισης παγκοσμίως, πάνω από 4500 άτομα υποβλήθηκαν σε θεραπεία με Actos. Στις κλινικές μελέτες των ΗΠΑ, περισσότεροι από 4700 ασθενείς με διαβήτη τύπου 2 έλαβαν Actos. Δεν υπήρξαν ενδείξεις επαγόμενης από φάρμακο ηπατοτοξικότητας ή αύξησης των επιπέδων ALT στις κλινικές μελέτες.
Κατά τη διάρκεια προ-έγκρισης ελεγχόμενων με εικονικό φάρμακο κλινικών δοκιμών στις Η.Π.Α., συνολικά 4 από τους 1526 (0,26%) ασθενείς θεραπεία με Actos και 2 από τους 793 (0,25%) ασθενείς που έλαβαν εικονικό φάρμακο είχαν τιμές ALT ≥ 3 φορές το ανώτερο όριο κανονικός. Οι αυξήσεις της ALT σε ασθενείς που έλαβαν Actos ήταν αναστρέψιμες και δεν σχετίζονταν σαφώς με τη θεραπεία με Actos.
Στην εμπειρία μετά την κυκλοφορία του Actos, έχουν ληφθεί αναφορές για ηπατίτιδα και αύξηση των ηπατικών ενζύμων σε 3 ή περισσότερες φορές το ανώτερο φυσιολογικό όριο. Πολύ σπάνια, αυτές οι αναφορές περιελάμβαναν ηπατική ανεπάρκεια με και χωρίς θανατηφόρο έκβαση, αν και δεν έχει διαπιστωθεί αιτιώδης συνάφεια.
Εν αναμονή της διαθεσιμότητας των αποτελεσμάτων των πρόσθετων μεγάλων, μακροπρόθεσμων ελεγχόμενων κλινικών δοκιμών και επιπλέον μετά την κυκλοφορία του προϊόντος στην αγορά, συνιστάται η τακτική παρακολούθηση του ήπατος στους ασθενείς που λαμβάνουν Actos ένζυμα.
Τα επίπεδα ALT του ορού (αλανίνης αμινοτρανσφεράσης) θα πρέπει να αξιολογούνται πριν από την έναρξη της θεραπείας με Actos σε όλους τους ασθενείς και περιοδικά μετά από την κλινική κρίση της υγειονομικής περίθαλψης επαγγελματίας. Οι δοκιμασίες για τη λειτουργία του ήπατος θα πρέπει επίσης να λαμβάνονται για ασθενείς εάν εμφανιστούν συμπτώματα που υποδηλώνουν ηπατική δυσλειτουργία, π.χ. ναυτία, έμετο, κοιλιακό άλγος, κόπωση, ανορεξία ή σκοτεινά ούρα. Η απόφαση για τη συνέχιση του ασθενούς με θεραπεία με Actos θα πρέπει να καθοδηγείται από κλινική κρίση εν αναμονή των εργαστηριακών αξιολογήσεων. Εάν παρατηρηθεί ίκτερος, η φαρμακευτική θεραπεία θα πρέπει να διακόπτεται.
Η θεραπεία με Actos δεν πρέπει να ξεκινά εάν ο ασθενής παρουσιάζει κλινικές ενδείξεις ενεργού ηπατικής νόσου ή τα επίπεδα ALT υπερβαίνουν το 2,5 φορές το ανώτερο φυσιολογικό όριο. Ασθενείς με ήπια αυξημένα ηπατικά ένζυμα (επίπεδα ALT από 1 έως 2,5 φορές το ανώτερο φυσιολογικό όριο) στο η βασική γραμμή ή οποιαδήποτε στιγμή κατά τη διάρκεια της θεραπείας με Actos πρέπει να αξιολογηθεί για να προσδιοριστεί η αιτία του ενζύμου του ήπατος ανύψωση. Η έναρξη ή η συνέχιση της θεραπείας με Actos σε ασθενείς με ήπια αυξημένα ηπατικά ένζυμα πρέπει να συνεχιστεί με προσοχή και περιλαμβάνουν κατάλληλη κλινική παρακολούθηση η οποία μπορεί να περιλαμβάνει πιο συχνό ηπατικό ένζυμο παρακολούθησης. Εάν αυξηθούν τα επίπεδα τρανσαμινάσης στον ορό (ALT> 2,5 φορές το ανώτερο φυσιολογικό όριο), το ήπαρ οι δοκιμασίες λειτουργίας πρέπει να αξιολογούνται συχνότερα μέχρι να επανέλθουν στο φυσιολογικό επίπεδο ή πριν από την προεπεξεργασία αξίες. Εάν τα επίπεδα ALT υπερβαίνουν το τριπλάσιο του ανώτερου φυσιολογικού ορίου, η δοκιμή πρέπει να επαναληφθεί το συντομότερο δυνατόν. Εάν τα επίπεδα ALT παραμείνουν> 3 φορές το ανώτερο φυσιολογικό όριο ή εάν ο ασθενής είναι λανθάνουσα, η θεραπεία με Actos θα πρέπει να διακόπτεται.
Οίδημα της ωχράς κηλίδας: Έχει παρατηρηθεί οίδημα της ωχράς κηλίδας στην εμπειρία μετά την κυκλοφορία σε διαβητικούς ασθενείς που έλαβαν πιογλιταζόνη ή άλλη θειαζολιδινοδιόνη. Μερικοί ασθενείς παρουσίαζαν θολή όραση ή μειωμένη οπτική οξύτητα, αλλά μερικοί ασθενείς φαίνεται ότι έχουν διαγνωσθεί σε οφθαλμολογική εξέταση ρουτίνας. Μερικοί ασθενείς είχαν περιφερικό οίδημα τη στιγμή διάγνωσης του οιδήματος της ωχράς κηλίδας. Μερικοί ασθενείς είχαν βελτίωση στο οίδημα της ωχράς κηλίδας μετά τη διακοπή της θειαζολιδινοδιόνης τους. Δεν είναι γνωστό αν υπάρχει ή όχι αιτιώδης σχέση μεταξύ της πιογλιταζόνης και του οιδήματος της ωχράς κηλίδας. Οι ασθενείς με διαβήτη πρέπει να λαμβάνουν τακτικά οφθαλμολογικές εξετάσεις από έναν οφθαλμίατρο, σύμφωνα με τα πρότυπα περίθαλψης της Αμερικανικής Ένωσης Διαβήτη. Επιπρόσθετα, οποιοσδήποτε διαβητικός που αναφέρει οποιοδήποτε είδος οπτικού συμπτώματος θα πρέπει να παραπέμπεται αμέσως σε οφθαλμίατρο, ανεξάρτητα από τα υποκείμενα φάρμακα του ασθενούς ή άλλα φυσικά ευρήματα (βλ. ΑΝΕΠΙΘΥΜΗΤΕΣ ΕΝΕΡΓΕΙΕΣ).
Κατάγματα: Σε μια τυχαιοποιημένη δοκιμή (PROactive) σε ασθενείς με διαβήτη τύπου 2 (μέση διάρκεια διαβήτη 9,5 έτη) παρατηρήθηκε αυξημένη συχνότητα εμφάνισης καταγμάτων οστών σε γυναίκες που έλαβαν πιογλιταζόνη. Κατά τη διάρκεια μέσης παρακολούθησης 34,5 μηνών, η συχνότητα εμφάνισης καταγμάτων οστών σε γυναίκες ήταν 5,1% (44/870) για την πιογλιταζόνη έναντι 2,5% (23/905) για το εικονικό φάρμακο. Η διαφορά αυτή παρατηρήθηκε μετά το πρώτο έτος θεραπείας και παρέμεινε κατά τη διάρκεια της μελέτης. Η πλειονότητα των καταγμάτων που παρατηρήθηκαν σε γυναίκες ασθενείς ήταν μη σπονδυλικά κατάγματα συμπεριλαμβανομένου του κάτω άκρου και του απώτερου άνω άκρου. Δεν παρατηρήθηκε αύξηση των ρυθμών κατάγματος σε άνδρες που έλαβαν θεραπεία με πιογλιταζόνη 1,7% (30/1735) έναντι εικονικού φαρμάκου 2,1% (37/1728). Ο κίνδυνος θραύσης πρέπει να λαμβάνεται υπόψη στη φροντίδα των ασθενών, ιδιαίτερα των γυναικών που υποβάλλονται σε θεραπεία η πιογλιταζόνη και θα πρέπει να δοθεί προσοχή στην αξιολόγηση και τη διατήρηση της υγείας των οστών σύμφωνα με τα ισχύοντα πρότυπα της φροντίδας.
Μακροαγγειακά αποτελέσματα: Δεν έχουν υπάρξει κλινικές μελέτες που να αποδεικνύουν την ύπαρξη τεκμηριωμένων ενδείξεων για μείωση του μακροαγγειακού κινδύνου με Actos ή οποιοδήποτε άλλο αντιδιαβητικό φάρμακο.
Εργαστηριακές δοκιμές
FPG και HbA1γ οι μετρήσεις θα πρέπει να πραγματοποιούνται περιοδικά για την παρακολούθηση του γλυκαιμικού ελέγχου και της θεραπευτικής ανταπόκρισης στο Actos.
Η παρακολούθηση των ενζύμων του ήπατος συνιστάται πριν από την έναρξη της θεραπείας με Actos σε όλους τους ασθενείς και περιοδικά μετά από την κλινική κρίση του επαγγελματία υγείας (βλ. ΠΡΟΦΥΛΑΞΕΙΣ, Γενικά, Ηπατικές Επιδράσεις και ΑΝΕΠΙΘΥΜΗΤΕΣ ΕΝΕΡΓΕΙΕΣ, Επίπεδα Τρανσαμινάσης Ορού).
Πληροφορίες για τους ασθενείς
Είναι σημαντικό να δοθούν οδηγίες στους ασθενείς να τηρούν διατροφικές οδηγίες και να ελέγχουν τακτικά γλυκόζη αίματος και γλυκοζυλιωμένη αιμοσφαιρίνη. Κατά τη διάρκεια περιόδων στρες, όπως πυρετός, τραύμα, λοίμωξη ή χειρουργική επέμβαση, οι φαρμακευτικές απαιτήσεις ενδέχεται να αλλάξουν και οι ασθενείς θα πρέπει να υπενθυμίζονται να ζητούν αμέσως ιατρική συμβουλή.
Ασθενείς που παρουσιάζουν ασυνήθιστα γρήγορη αύξηση βάρους ή οίδημα ή που εμφανίζουν δύσπνοια ή άλλα συμπτώματα καρδιακής ανεπάρκειας ενώ το Actos πρέπει να αναφέρει αμέσως αυτά τα συμπτώματα γιατρός.
Οι ασθενείς θα πρέπει να ενημερώνονται ότι οι εξετάσεις αίματος για ηπατική λειτουργία θα εκτελούνται πριν από την έναρξη της θεραπείας και περιοδικά μετά από την κλινική κρίση του επαγγελματία υγείας. Οι ασθενείς θα πρέπει να ενημερώνονται για να αναζητήσουν άμεσες ιατρικές συμβουλές για ανεξήγητη ναυτία, έμετο, κοιλιακό άλγος, κόπωση, ανορεξία ή σκοτεινά ούρα.
Οι ασθενείς πρέπει να ενημερώνονται για τη λήψη του Actos άπαξ ημερησίως. Το Actos μπορεί να λαμβάνεται με ή χωρίς γεύματα. Εάν μία δόση χάνεται σε μία ημέρα, η δόση δεν θα πρέπει να διπλασιαστεί την επόμενη ημέρα.
Όταν χρησιμοποιούνται συνδυασμένη θεραπεία με ινσουλίνη ή από του στόματος υπογλυκαιμικούς παράγοντες, οι κίνδυνοι υπογλυκαιμίας, τα συμπτώματά της και η θεραπεία και οι συνθήκες που προδιαθέτουν στην ανάπτυξή της πρέπει να εξηγούνται στους ασθενείς και την οικογένειά τους μελών.
Η θεραπεία με Actos, όπως και άλλες θειαζολιδινοδιόνες, μπορεί να οδηγήσει σε ωορρηξία σε μερικές γυναίκες που υποβάλλονται σε προεμμηνοπαυσιακή ανεπάρκεια. Ως αποτέλεσμα, αυτοί οι ασθενείς μπορεί να διατρέχουν αυξημένο κίνδυνο εγκυμοσύνης κατά τη λήψη του Actos. Επομένως, θα πρέπει να συνιστάται επαρκής αντισύλληψη σε προεμμηνοπαυσιακές γυναίκες. Αυτό το πιθανό αποτέλεσμα δεν έχει διερευνηθεί σε κλινικές μελέτες, οπότε η συχνότητα αυτού του περιστατικού δεν είναι γνωστή.
Αλληλεπιδράσεις με άλλα φάρμακα
Οι in vivo μελέτες αλληλεπίδρασης φαρμάκου-φαρμάκου έχουν δείξει ότι η πιογλιταζόνη μπορεί να είναι ένας ασθενής επαγωγέας του ισόμορφου υποστρώματος 3Α4 του CYP 450 (βλ. ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ, Μεταβολισμός και Αλληλεπιδράσεις φαρμάκων-φαρμάκων).
Ένας αναστολέας ενζύμου του CYP2C8 (όπως η γεμφιβροζίλη) μπορεί να αυξήσει σημαντικά την AUC της η πιογλιταζόνη και ένας επαγωγέας ενζύμων του CYP2C8 (όπως η ριφαμπίνη) μπορεί να μειώσει σημαντικά την AUC της πιογλιταζόνη. Συνεπώς, εάν ένας αναστολέας ή επαγωγέας του CYP2C8 ξεκινήσει ή διακοπεί κατά τη διάρκεια της θεραπείας με πιογλιταζόνη, μπορεί να χρειαστούν αλλαγές στη θεραπεία του διαβήτη με βάση την κλινική ανταπόκριση (βλ. ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ, Αλληλεπιδράσεις φαρμάκων-φαρμάκων).
Καρκινογένεση, Μεταλλαξογένεση, Βλάβη της Γονιμότητας
Διεξήχθη διετής μελέτη καρκινογένεσης σε αρσενικούς και θηλυκούς αρουραίους σε από του στόματος δόσεις μέχρι 63 mg / kg (περίπου 14 φορές μεγαλύτερη από τη μέγιστη συνιστώμενη από του στόματος δόση των 45 mg με βάση τα mg / m2). Οι όγκοι που προκαλούνται από φάρμακα δεν παρατηρήθηκαν σε κανένα όργανο εκτός από την ουροδόχο κύστη. Κακοήθη και / ή κακοήθη νεοπλάσματα μεταβατικών κυττάρων παρατηρήθηκαν σε αρσενικούς αρουραίους στα 4 mg / kg / ημέρα και άνω (περίπου ίσο με τη μέγιστη συνιστώμενη δόση από του στόματος για ανθρώπους με βάση τα mg / m2). Διεξήχθη διετής μελέτη καρκινογένεσης σε αρσενικούς και θηλυκούς ποντικούς σε από του στόματος δόσεις έως 100 mg / kg / ημέρα (περίπου 11 φορές μεγαλύτερη από τη μέγιστη συνιστώμενη από του στόματος χορηγούμενη από του στόματος δόση σε mg / m2). Δεν παρατηρήθηκαν όγκοι που προκαλούνται από φάρμακα σε οποιοδήποτε όργανο.
Κατά τη διάρκεια της προοπτικής αξιολόγησης της κυτταρολογίας των ουροφόρων οδών, στην οποία συμμετείχαν περισσότεροι από 1800 ασθενείς που έλαβαν Actos σε κλινικές δοκιμές μέχρι ενός έτους, δεν εντοπίστηκαν νέες περιπτώσεις όγκων ουροδόχου κύστης. Σε δύο τριετείς μελέτες στις οποίες η πιογλιταζόνη συγκρίθηκε με εικονικό φάρμακο ή γλυβουρίδη, υπήρχαν 16/3656 (0,44%) αναφορές καρκίνου της ουροδόχου κύστης σε ασθενείς που έλαβαν πιογλιταζόνη σε σύγκριση με 5/3679 (0,14%) σε ασθενείς που δεν έλαβαν πιογλιταζόνη. Μετά τον αποκλεισμό των ασθενών στους οποίους η έκθεση στο φάρμακο μελέτης ήταν μικρότερη του ενός έτους κατά τη διάγνωση του καρκίνου της ουροδόχου κύστης, υπήρχαν έξι (0,16%) περιπτώσεις για την πιογλιταζόνη και δύο (0,05%) για το εικονικό φάρμακο.
Η πιγλιταζόνη HCl δεν ήταν μεταλλαξιογόνος σε μια σειρά γενετικών τοξικολογικών μελετών, συμπεριλαμβανομένης της βακτηριακής ανάλυσης Ames, ενός προωθητικού γονιδίου κυττάρων θηλαστικού δοκιμασία μετάλλαξης (CHO / HPRT και AS52 / XPRT), έναν in vitro κυτταρογενετικό προσδιορισμό που χρησιμοποιεί κύτταρα CHL, έναν μη προγραμματισμένο προσδιορισμό σύνθεσης ϋΝΑ και έναν ίη νίνο μικροπυρήνα χημική δοκιμή.
Δεν παρατηρήθηκαν ανεπιθύμητες ενέργειες στη γονιμότητα σε αρσενικούς και θηλυκούς αρουραίους σε από του στόματος δόσεις μέχρι 40 mg / kg πιογλιταζόνης HCl ημερησίως πριν και κατά τη διάρκεια του ζευγαρώματος και της κύησης (περίπου 9 φορές τη μέγιστη συνιστώμενη δόση από του στόματος για ανθρώπους με βάση τα mg / m2).
Τοξικολογία των ζώων
Έχει παρατηρηθεί μεγέθυνση της καρδιάς σε ποντίκια (100 mg / kg), αρουραίους (4 mg / kg και άνω) και σκύλους (3 mg / kg) που λαμβάνουν από του στόματος (περίπου 11, 1 και 2 φορές τη μέγιστη συνιστώμενη δόση από του στόματος για ανθρώπους για ποντίκια, αρουραίους και σκύλους, αντίστοιχα, με βάση τα mg / m2). Σε μία μελέτη ετησίως για αρουραίους, ο πρώιμος θάνατος που σχετίζεται με το φάρμακο οφείλεται σε εμφανή καρδιακή δυσλειτουργία και εμφανίστηκε σε μία δόση από του στόματος 160 mg / kg / ημέρα (περίπου 35 φορές μεγαλύτερη από τη μέγιστη συνιστώμενη δόση από του στόματος για ανθρώπους με βάση το mg / m2). Η αύξηση της καρδιάς παρατηρήθηκε σε μελέτη 13 εβδομάδων σε πιθήκους σε δόσεις από του στόματος 8,9 mg / kg και άνω (περίπου 4 φορές τη μέγιστη συνιστώμενη δόση από του στόματος για ανθρώπους με βάση τα mg / m2), αλλά όχι σε μελέτη διάρκειας 52 εβδομάδων σε δόσεις από το στόμα μέχρι 32 mg / kg (περίπου 13 φορές τη μέγιστη συνιστώμενη δόση από του στόματος για ανθρώπους με βάση τα mg / m2).
Εγκυμοσύνη
Κατηγορία Γ εγκυμοσύνης. Η πιογλιταζόνη δεν ήταν τερατογόνος σε αρουραίους σε από του στόματος δόσεις μέχρι 80 mg / kg ή σε κουνέλια που έλαβαν έως 160 mg / kg κατά τη διάρκεια της οργανογένεσης (περίπου 17 και 40 φορές τη μέγιστη συνιστώμενη από του στόματος χορηγούμενη από του στόματος δόση) σε mg / m2, αντίστοιχα). Ο καθυστερημένος τοκετός και η εμβρυοτοξικότητα (όπως αποδεικνύεται από τις αυξημένες απώλειες μετά την εμφύτευση, την καθυστερημένη ανάπτυξη και τα μειωμένα βάρη του εμβρύου) παρατηρήθηκαν σε αρουραίους σε δόσεις από του στόματος των 40 mg / kg / ημέρα και άνω (περίπου 10 φορές τη μέγιστη συνιστώμενη από του στόματος δόση για ανθρώπους με βάση το mg / m2). Δεν παρατηρήθηκε λειτουργική ή συμπεριφορική τοξικότητα στους απογόνους των αρουραίων. Σε κουνέλια παρατηρήθηκε εμβρυοτοξικότητα σε δόση 160 mg / kg από το στόμα (περίπου 40 φορές τη μέγιστη συνιστώμενη δόση από του στόματος για ανθρώπους με βάση τα mg / m2). Η καθυστερημένη μεταγεννητική ανάπτυξη, που αποδίδεται σε μειωμένο σωματικό βάρος, παρατηρήθηκε στους απογόνους αρουραίων σε δόσεις από του στόματος των 10 mg / kg και άνω κατά την περίοδο καθυστερημένης κύησης και γαλουχίας (περίπου 2 φορές τη μέγιστη συνιστώμενη από του στόματος δόση για ανθρώπους με βάση το mg / m2).
Δεν υπάρχουν επαρκείς και καλά ελεγχόμενες μελέτες σε έγκυες γυναίκες. Το Actos θα πρέπει να χρησιμοποιείται κατά τη διάρκεια της εγκυμοσύνης μόνο εάν το πιθανό όφελος δικαιολογεί τον πιθανό κίνδυνο για το έμβρυο.
Επειδή οι τρέχουσες πληροφορίες υποδηλώνουν έντονα ότι τα ανώμαλα επίπεδα γλυκόζης στο αίμα κατά τη διάρκεια της εγκυμοσύνης συνδέονται με υψηλότερη συχνότητα συγγενών ανωμαλιών, καθώς και λόγω αυξημένης νεογνικής νοσηρότητας και θνησιμότητας, οι περισσότεροι ειδικοί συστήνουν να χρησιμοποιείται ινσουλίνη κατά τη διάρκεια της εγκυμοσύνης για τη διατήρηση των επιπέδων γλυκόζης στο αίμα όσο πιο κοντά στην κανονική δυνατόν.
Θηλάζουσες μητέρες
Η πιογλιταζόνη εκκρίνεται στο γάλα θηλαζόντων αρουραίων. Δεν είναι γνωστό αν το Actos εκκρίνεται στο ανθρώπινο γάλα. Επειδή πολλά φάρμακα απεκκρίνονται στο ανθρώπινο γάλα, το Actos δεν πρέπει να χορηγείται σε θηλάζουσα γυναίκα.
Παιδιατρική χρήση
Η ασφάλεια και η αποτελεσματικότητα του Actos σε παιδιατρικούς ασθενείς δεν έχουν τεκμηριωθεί.
Ηλικιωμένοι Χρήση
Περίπου 500 ασθενείς σε ελεγχόμενες με εικονικό φάρμακο κλινικές δοκιμές του Actos ήταν 65 ετών και άνω. Δεν παρατηρήθηκαν σημαντικές διαφορές στην αποτελεσματικότητα και την ασφάλεια μεταξύ αυτών των ασθενών και των νεότερων ασθενών.
μπλουζα
Ανεπιθύμητες ενέργειες
Περισσότεροι από 8500 ασθενείς με διαβήτη τύπου 2 έχουν υποβληθεί σε θεραπεία με Actos σε τυχαιοποιημένες, διπλά τυφλές, ελεγχόμενες κλινικές δοκιμές. Αυτό περιλαμβάνει 2605 ασθενείς υψηλού κινδύνου με διαβήτη τύπου 2 που έλαβαν θεραπεία με Actos από την κλινική δοκιμή PROactive. Περισσότεροι από 6000 ασθενείς έχουν υποβληθεί σε θεραπεία για 6 μήνες ή περισσότερο και πάνω από 4500 ασθενείς για ένα έτος ή περισσότερο. Πάνω από 3000 ασθενείς έλαβαν Actos για τουλάχιστον 2 χρόνια.
Η συνολική επίπτωση και οι τύποι ανεπιθύμητων ενεργειών που αναφέρθηκαν σε ελεγχόμενες με εικονικό φάρμακο κλινικές δοκιμές της μονοθεραπείας Actos σε δόσεις των 7,5 mg, 15 mg, 30 mg ή 45 mg μία φορά ημερησίως παρουσιάζονται στον Πίνακα 7.
Πίνακας 7 Κλινικές Μελέτες με Μονοθεραπεία Actos Ελεγχόμενες με εικονικό φάρμακο: Ανεπιθύμητες ενέργειες που αναφέρθηκαν με συχνότητα ≥ 5% των ασθενών που έλαβαν θεραπεία με Actos
| (% των ασθενών) | ||
| Εικονικό φάρμακο Ν = 259 |
Actos Ν = 606 |
|
| Οίδημα της άνω αναπνευστικής οδού | 8.5 | 13.2 |
| Πονοκέφαλο | 6.9 | 9.1 |
| Ιγμορίτιδα | 4.6 | 6.3 |
| Μυαλγία | 2.7 | 5.4 |
| Διαταραχή των δοντιών | 2.3 | 5.3 |
| Ο σακχαρώδης διαβήτης επιδεινώνεται | 8.1 | 5.1 |
| Φαρυγγίτιδα | 0.8 | 5.1 |
Για τις περισσότερες κλινικές ανεπιθύμητες ενέργειες η συχνότητα εμφάνισης ήταν παρόμοια για τις ομάδες που έλαβαν μονοθεραπεία με Actos και εκείνες που έλαβαν θεραπεία σε συνδυασμό με σουλφονυλουρίες, μετφορμίνη και ινσουλίνη. Υπήρξε αύξηση της εμφάνισης οιδήματος στους ασθενείς που έλαβαν Actos και ινσουλίνη συγκριτικά με την ινσουλίνη μόνο.
Σε μια 16-εβδομάδα, ελεγχόμενη με εικονικό φάρμακο δοκιμασία Actos συν ινσουλίνη (n = 379), 10 ασθενείς που έλαβαν θεραπεία με Actos plus η ινσουλίνη ανέπτυξε δύσπνοια και, σε κάποια στιγμή κατά τη διάρκεια της θεραπείας τους, ανέπτυξε είτε αλλαγή βάρους είτε οίδημα. Επτά από αυτούς τους 10 ασθενείς έλαβαν διουρητικά για τη θεραπεία αυτών των συμπτωμάτων. Αυτό δεν αναφέρθηκε στην ομάδα ινσουλίνης συν εικονικού φαρμάκου.
Η συχνότητα των αποσύρσεων από ελεγχόμενες με εικονικό φάρμακο κλινικές δοκιμές λόγω ανεπιθύμητου συμβάντος εκτός της υπεργλυκαιμίας ήταν παρόμοια για τους ασθενείς που έλαβαν εικονικό φάρμακο (2,8%) ή Actos (3,3%).
Σε μελέτες ελεγχόμενης συνδυασμένης θεραπείας με σουλφονυλουρία ή ινσουλίνη, αναφέρθηκε ήπια έως μέτρια υπογλυκαιμία, η οποία φαίνεται ότι σχετίζεται με τη δόση (βλ. ΠΡΟΦΥΛΑΞΕΙΣ, Γενικά, Υπογλυκαιμία και Δοσολογία και χορήγηση, Συνδυαστική Θεραπεία).
Στις διπλές τυφλές μελέτες των ΗΠΑ, αναιμία αναφέρθηκε σε ≥ 2% των ασθενών που έλαβαν Actos συν σουλφονυλουρία, μετφορμίνη ή ινσουλίνη (βλ. ΠΡΟΦΥΛΑΞΕΙΣ, Γενικά, Αιματολογικά).
Στις μελέτες μονοθεραπείας, το οίδημα αναφέρθηκε για 4,8% (με δόσεις από 7,5 mg έως 45 mg) των ασθενών που έλαβαν Actos έναντι 1,2% των ασθενών που έλαβαν εικονικό φάρμακο. Σε μελέτες συνδυασμένης θεραπείας, το οίδημα αναφέρθηκε στο 7,2% των ασθενών που έλαβαν Actos και σουλφονυλουρίες σε σύγκριση με το 2,1% των ασθενών που έλαβαν μόνο σουλφονυλουρίες. Σε μελέτες συνδυασμένης θεραπείας με μετφορμίνη, αναφέρθηκε οίδημα στο 6,0% των ασθενών που λάμβαναν συνδυασμένη θεραπεία συγκριτικά με το 2,5% των ασθενών με μόνο μετφορμίνη. Σε μελέτες συνδυασμένης θεραπείας με ινσουλίνη, το οίδημα αναφέρθηκε στο 15,3% των ασθενών σε συνδυασμένη θεραπεία συγκριτικά με το 7,0% των ασθενών με ινσουλίνη μόνο. Τα περισσότερα από αυτά τα γεγονότα θεωρήθηκαν ήπια ή μέτρια σε ένταση (βλ ΠΡΟΦΥΛΑΞΕΙΣ, Γενικά, Οίδημα).
Σε μία κλινική μελέτη 16 εβδομάδων συνδυασμένης θεραπείας με ινσουλίνη και Actos, περισσότεροι ασθενείς εμφάνισαν συμφορητική καρδιακή ανεπάρκεια στην συνδυασμένη θεραπεία (1,1%) σε σύγκριση με καμία σε ινσουλίνη μόνο (βλ. ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ, Καρδιακή ανεπάρκεια και άλλες καρδιακές επιδράσεις).
Προοπτική κλινική δοκιμή της πιγλιταζόνης σε μακροαγγειακά συμβάματα (PROactive)
Στην ομάδα PROactive, 5238 ασθενείς με διαβήτη τύπου 2 και προηγούμενο ιστορικό μακροαγγειακής νόσου ήταν (n = 2605), τιτλοφορήθηκαν με δύναμη μέχρι 45 mg ημερησίως ή με εικονικό φάρμακο (n = 2633), επιπλέον του της φροντίδας. Σχεδόν όλα τα άτομα (95%) έλαβαν καρδιαγγειακά φάρμακα (βήτα αναστολείς, αναστολείς ACE, ARBs, αναστολείς διαύλων ασβεστίου, νιτρικά, διουρητικά, ασπιρίνη, στατίνες, φιμπράτες). Οι ασθενείς είχαν μέση ηλικία 61,8 ετών, μέση διάρκεια διαβήτη 9,5 έτη και μέση HbA1c 8,1%. Η μέση διάρκεια παρακολούθησης ήταν 34,5 μήνες. Ο πρωταρχικός στόχος αυτής της δοκιμής ήταν να εξεταστεί η επίδραση του Actos στη θνησιμότητα και μακροαγγειακή νοσηρότητα σε ασθενείς με σακχαρώδη διαβήτη τύπου 2 οι οποίοι διατρέχουν υψηλό κίνδυνο μακροαγγειακά συμβάντα. Η κύρια μεταβλητή αποτελεσματικότητας ήταν ο χρόνος έως την πρώτη εμφάνιση οποιουδήποτε συμβάντος στο καρδιαγγειακό σύνθετο τελικό σημείο (βλ. Πίνακα 8 παρακάτω). Παρόλο που δεν υπήρχε στατιστικά σημαντική διαφορά μεταξύ του Actos και του εικονικού φαρμάκου για την τριετή συχνότητα εμφάνισης ένα πρώτο γεγονός μέσα σε αυτό το σύνθετο, δεν υπήρξε αύξηση της θνησιμότητας ή των συνολικών μακροαγγειακών συμβάντων με Actos.
Πίνακας 8 Αριθμός πρώτων και συνολικών συμβάντων για κάθε συστατικό στο καρδιαγγειακό σύνθετο τελικό σημείο
| Εικονικό φάρμακο Ν = 2633 |
Actos Ν = 2605 |
|||
| Καρδιαγγειακά συμβάματα | Πρώτα γεγονότα (Ν) |
Σύνολο συμβάντων (Ν) |
Πρώτα γεγονότα (Ν) |
Σύνολο συμβάντων (Ν) |
| Οποιαδήποτε περίπτωση | 572 | 900 | 514 | 803 |
| Η θνησιμότητα από κάθε αιτία | 122 | 186 | 110 | 177 |
| Μη θανατηφόρος ΜΙ | 118 | 157 | 105 | 131 |
| Εγκεφαλικό | 96 | 119 | 76 | 92 |
| ACS | 63 | 78 | 42 | 65 |
| Καρδιακή παρέμβαση | 101 | 240 | 101 | 195 |
| Μεγάλη ακρωτηριασμό του ποδιού | 15 | 28 | 9 | 28 |
| Επανεγγυή ποδιού | 57 | 92 | 71 | 115 |
Έχουν επίσης ληφθεί αναφορές μετά την κυκλοφορία του φαρμάκου για νέα εμφάνιση ή επιδείνωση του διαβητικού οίδημα της ωχράς κηλίδας με μειωμένη οπτική οξύτητα (βλ. ΠΡΟΦΥΛΑΞΕΙΣ, Γενικά, Οίδημα της ωχράς κηλίδας).
Εργαστηριακές ανωμαλίες
Αιματολογικά: Το Actos μπορεί να προκαλέσει μειώσεις της αιμοσφαιρίνης και του αιματοκρίτη. Η πτώση της αιμοσφαιρίνης και του αιματοκρίτη με Actos φαίνεται να σχετίζεται με τη δόση. Σε όλες τις κλινικές μελέτες, οι μέσες τιμές αιμοσφαιρίνης μειώθηκαν κατά 2% έως 4% σε ασθενείς που έλαβαν Actos. Αυτές οι αλλαγές εμφανίστηκαν γενικά μέσα στις πρώτες 4 έως 12 εβδομάδες της θεραπείας και παρέμειναν σχετικά σταθερές στη συνέχεια. Αυτές οι αλλαγές μπορεί να σχετίζονται με τον αυξημένο όγκο πλάσματος που σχετίζεται με τη θεραπεία με Actos και έχουν σπάνια συσχετιστεί με οποιεσδήποτε σημαντικές αιματολογικές κλινικές επιδράσεις.
Επίπεδα τρανσαμινάσης ορού: Σε όλες τις κλινικές μελέτες στις ΗΠΑ, 14 από τους 4780 (0,30%) ασθενείς που έλαβαν θεραπεία με Actos είχαν τιμές ALT ≥ 3 φορές το ανώτερο φυσιολογικό όριο κατά τη διάρκεια της θεραπείας. Όλοι οι ασθενείς με τιμές παρακολούθησης είχαν αναστρέψιμες αυξήσεις της ALT. Στον πληθυσμό των ασθενών που έλαβαν Actos, οι μέσες τιμές για χολερυθρίνη, AST, ALT, αλκαλική φωσφατάση και GGT μειώθηκαν στην τελική επίσκεψη σε σύγκριση με την αρχική τιμή. Λιγότερο από το 0,9% των ασθενών που έλαβαν θεραπεία με Actos αποσύρθηκαν από κλινικές δοκιμές στις ΗΠΑ λόγω μη φυσιολογικών δοκιμασιών ηπατικής λειτουργίας.
Σε κλινικές δοκιμές πριν από την έγκριση, δεν υπήρξαν περιπτώσεις ιδιοπαθών αντιδράσεων φαρμάκων που να οδηγούν σε ηπατική ανεπάρκεια (βλ ΠΡΟΦΥΛΑΞΕΙΣ, Γενικά, Ηπατικές Επιδράσεις).
Επίπεδα CPK: Κατά τη διάρκεια των απαιτούμενων εργαστηριακών εξετάσεων σε κλινικές δοκιμές παρατηρήθηκαν σποραδικές, παροδικές αυξήσεις των επιπέδων της κρεατινοφωσφοκινάσης (CPK). Μία απομονωμένη ανύψωση σε περισσότερο από 10 φορές το ανώτερο φυσιολογικό όριο σημειώθηκε σε 9 ασθενείς (τιμές 2150 έως 11400 IU / L). Έξι από αυτούς τους ασθενείς συνέχισαν να λαμβάνουν Actos, δύο ασθενείς είχαν ολοκληρώσει τη μελέτη φάρμακα κατά τη στιγμή της αυξημένης αξίας και ένας ασθενής διέκοψε τη φαρμακευτική αγωγή της μελέτης λόγω του ανύψωση. Αυτές οι ανυψώσεις διαλύθηκαν χωρίς εμφανή κλινικά επακόλουθα. Η σχέση αυτών των συμβάντων με τη θεραπεία με Actos είναι άγνωστη.
μπλουζα
Υπερβολική δόση
Κατά τη διάρκεια ελεγχόμενων κλινικών δοκιμών, αναφέρθηκε μία περίπτωση υπερδοσολογίας με Actos. Ένας αρσενικός ασθενής έλαβε 120 mg ημερησίως για τέσσερις ημέρες και έπειτα 180 mg ημερησίως για επτά ημέρες. Ο ασθενής αρνήθηκε οποιαδήποτε κλινικά συμπτώματα κατά τη διάρκεια αυτής της περιόδου.
Σε περίπτωση υπερδοσολογίας, πρέπει να ξεκινά κατάλληλη υποστηρικτική θεραπεία ανάλογα με τα κλινικά σημεία και συμπτώματα του ασθενούς.
μπλουζα
Δοσολογία και χορήγηση
Το Actos πρέπει να λαμβάνεται άπαξ ημερησίως ανεξάρτητα από τα γεύματα.
Η αντιμετώπιση της αντιδιαβητικής θεραπείας πρέπει να εξατομικεύεται. Ιδανικά, η απόκριση στη θεραπεία θα πρέπει να αξιολογείται χρησιμοποιώντας HbA1γ που είναι ένας καλύτερος δείκτης μακροπρόθεσμου γλυκαιμικού ελέγχου από ό, τι μόνο ο FPG. HbA1γ αντανακλά τη γλυκαιμία τους τελευταίους δύο έως τρεις μήνες. Κατά την κλινική χρήση, συνιστάται στους ασθενείς να λαμβάνουν θεραπεία με Actos για μια χρονική περίοδο επαρκή για την αξιολόγηση της μεταβολής της HbA1γ (τρεις μήνες) εκτός εάν επιδεινωθεί ο γλυκαιμικός έλεγχος. Μετά την έναρξη του Actos ή με αύξηση της δόσης, οι ασθενείς πρέπει να παρακολουθούνται προσεκτικά για ανεπιθύμητες ενέργειες που σχετίζονται με την κατακράτηση υγρών (βλ ΣΥΓΚΕΚΡΙΜΕΝΗ ΠΡΟΣΟΧΗ και ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ).
Μονοθεραπεία
Η μονοθεραπεία Actos σε ασθενείς που δεν ελέγχονται επαρκώς με δίαιτα και άσκηση μπορεί να ξεκινήσει στα 15 mg ή 30 mg μία φορά την ημέρα. Για τους ασθενείς που ανταποκρίνονται ανεπαρκώς στην αρχική δόση του Actos, η δόση μπορεί να αυξηθεί σε βήματα μέχρι 45 mg μία φορά την ημέρα. Για ασθενείς που δεν ανταποκρίνονται επαρκώς στη μονοθεραπεία, θα πρέπει να λαμβάνεται υπόψη συνδυαστική θεραπεία.
Συνδυαστική Θεραπεία
Σουλφονυλουρίες: Το Actos σε συνδυασμό με μια σουλφονυλουρία μπορεί να ξεκινήσει στα 15 mg ή 30 mg μία φορά την ημέρα. Η τρέχουσα δόση σουλφονυλουρίας μπορεί να συνεχιστεί κατά την έναρξη της θεραπείας με Actos. Εάν οι ασθενείς αναφέρουν υπογλυκαιμία, η δόση της σουλφονυλουρίας πρέπει να μειωθεί.
Μετφορμίνη: Το Actos σε συνδυασμό με μετφορμίνη μπορεί να ξεκινήσει στα 15 mg ή 30 mg μία φορά την ημέρα. Η τρέχουσα δόση της μετφορμίνης μπορεί να συνεχιστεί κατά την έναρξη της θεραπείας με Actos. Είναι απίθανο η δόση της μετφορμίνης να απαιτεί προσαρμογή λόγω υπογλυκαιμίας κατά τη διάρκεια της συνδυασμένης θεραπείας με Actos.
Ινσουλίνη: Το Actos σε συνδυασμό με ινσουλίνη μπορεί να ξεκινήσει στα 15 mg ή 30 mg μία φορά την ημέρα. Η τρέχουσα δόση ινσουλίνης μπορεί να συνεχιστεί κατά την έναρξη της θεραπείας με Actos. Σε ασθενείς που λαμβάνουν Actos και ινσουλίνη, η δόση ινσουλίνης μπορεί να μειωθεί κατά 10% έως 25% εάν ο ασθενής αναφέρει την υπογλυκαιμία ή εάν οι συγκεντρώσεις γλυκόζης στο πλάσμα μειωθούν σε λιγότερο από 100 mg / dL. Οι περαιτέρω προσαρμογές πρέπει να εξατομικεύονται με βάση την απόκριση μείωσης της γλυκόζης.
Μέγιστη συνιστώμενη δόση
Η δόση Actos δεν πρέπει να υπερβαίνει τα 45 mg μία φορά την ημέρα σε μονοθεραπεία ή σε συνδυασμό με σουλφονυλουρία, μετφορμίνη ή ινσουλίνη.
Η προσαρμογή της δόσης σε ασθενείς με νεφρική ανεπάρκεια δεν συνιστάται (βλ ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ, Φαρμακοκινητική και μεταβολισμός φαρμάκων).
Η θεραπεία με Actos δεν πρέπει να ξεκινά εάν ο ασθενής παρουσιάζει κλινικές ενδείξεις ενεργού ηπατικής νόσου ή αυξημένα επίπεδα τρανσαμινασών στον ορό (ALT μεγαλύτερο από 2,5 φορές το ανώτερο φυσιολογικό όριο) κατά την έναρξη της θεραπείας (βλέπω ΠΡΟΦΥΛΑΞΕΙΣ, Γενικά, Ηπατικές Επιδράσεις και ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ, Ειδικοί Πληθυσμοί, Ηπατική Ανεπάρκεια). Η παρακολούθηση των ενζύμων του ήπατος συνιστάται σε όλους τους ασθενείς πριν από την έναρξη της θεραπείας με Actos και περιοδικά στη συνέχεια (βλ ΠΡΟΦΥΛΑΞΕΙΣ, Γενικά, Ηπατικές Επιδράσεις).
Δεν υπάρχουν δεδομένα σχετικά με τη χρήση του Actos σε ασθενείς κάτω των 18 ετών. Συνεπώς, η χρήση του Actos σε παιδιατρικούς ασθενείς δεν συνιστάται.
Δεν υπάρχουν διαθέσιμα δεδομένα σχετικά με τη χρήση του Actos σε συνδυασμό με άλλη θειαζολιδινοδιόνη.
μπλουζα
Πώς παρέχεται
Το Actos διατίθεται σε δισκία των 15 mg, 30 mg και 45 mg ως εξής:
15 mg δισκίο: Λευκό έως υπόλευκο, στρογγυλό, κυρτό, μη βαθμολογημένο δισκίο με "Actos" στη μια πλευρά και "15" στην άλλη, διαθέσιμο σε:
NDC 64764-151-04 Φιάλες των 30
NDC 64764-151-05 Φιάλες του 90
NDC 64764-151-06 Φιάλες των 500
30 mg δισκίο: Λευκό έως υπόλευκο, στρογγυλό, επίπεδο, μη βαθμολογημένο δισκίο με "Actos" στη μια πλευρά και "30" στην άλλη, διαθέσιμο σε:
NDC 64764-301-14 Φιάλες 30
NDC 64764-301-15 Φιάλες των 90
NDC 64764-301-16 Φιάλες των 500
45 mg δισκίο: Λευκό έως υπόλευκο, στρογγυλό, επίπεδο, μη βαθμολογημένο δισκίο με "Actos" στη μια πλευρά και "45" στην άλλη, διαθέσιμο σε:
NDC 64764-451-24 Φιάλες των 30
NDC 64764-451-25 Φιάλες των 90
NDC 64764-451-26 Φιάλες των 500
ΑΠΟΘΗΚΕΥΣΗ
Φυλάσσεται στους 25 ° C (77 ° F). επιτρέπονται εκδρομές στους 15-30 ° C (59-86 ° F) [βλέπε USP Ελεγχόμενη θερμοκρασία δωματίου]. Διατηρείτε το δοχείο ερμητικά κλειστό και προστατεύστε από την υγρασία και την υγρασία.
μπλουζα
βιβλιογραφικές αναφορές
- Deng, LJ, et αϊ. Επίδραση της γεμφιβροζίλης στη φαρμακοκινητική της πιογλιταζόνης. Eur J Clin Pharmacol 2005; 61: 831-836, Πίνακας 1.
2. Jaakkola, Τ, et αϊ. Επίδραση της ριφαμπικίνης στη φαρμακοκινητική της πιογλιταζόνης. Clin Pharmacol. Brit Jour 2006; 61:1 70-78.
Rx μόνο
Κατασκευασμένο από:
Takeda Pharmaceutical Company Limited
Οσάκα, Ιαπωνία
Διατίθεται από:
Η Takeda Pharmaceuticals America, Inc.
Ένα πάρκο Takeda
Deerfield, IL 60015
Actos® είναι εμπορικό σήμα της Takeda Pharmaceutical Company Limited και χρησιμοποιείται με άδεια της Takeda Pharmaceuticals America, Inc.
Όλα τα άλλα εμπορικά σήματα είναι ιδιοκτησία των αντίστοιχων κατόχων τους.
Τελευταία ενημέρωση: 08/09
Actos, πιογλιταζόνη hcl, πληροφορίες για τον ασθενή (στην απλή αγγλική γλώσσα)
Λεπτομερείς πληροφορίες για σημεία, συμπτώματα, αιτίες, θεραπείες διαβήτη
Οι πληροφορίες σε αυτή τη μονογραφία δεν προορίζονται να καλύψουν όλες τις πιθανές χρήσεις, οδηγίες, προφυλάξεις, αλληλεπιδράσεις φαρμάκων ή ανεπιθύμητες ενέργειες. Αυτές οι πληροφορίες είναι γενικευμένες και δεν προορίζονται ως συγκεκριμένες ιατρικές συμβουλές. Εάν έχετε απορίες σχετικά με τα φάρμακα που παίρνετε ή θέλετε περισσότερες πληροφορίες, επικοινωνήστε με το γιατρό σας, το φαρμακοποιό ή τη νοσοκόμα σας.
πίσω στο: Περιηγηθείτε σε όλα τα φάρμακα για τον διαβήτη


