Citrine καφεΐνης: Διεγερτικό (πληροφορίες πλήρους συνταγογράφησης)
Εμπορικό σήμα: Cafcit
Γενική ονομασία: Κιτρική καφεΐνη
Φόρμα δοσολογίας: ένεση
Κιτρική καφεΐνη είναι ένα διεγερτικό του κεντρικού νευρικού συστήματος που είναι διαθέσιμο ως Cafcit, το οποίο χρησιμοποιείται για τη θεραπεία της άπνοιας στα μωρά. Χρήση, δοσολογία, παρενέργειες.
Περιεχόμενα:
Περιγραφή
Κλινική Φαρμακολογία
Ενδείξεις και χρήση
Προειδοποιήσεις
Προφυλάξεις
Ανεπιθύμητες ενέργειες
Υπερδοσολογία
Δοσολογία και χορήγηση
Πώς παρέχεται
Πληροφορίες για τον ασθενή με κιτρικό κάλιο (στην απλή αγγλική γλώσσα)
Περιγραφή
Τόσο η ένεση κιτρικού κιτρικού για ενδοφλέβια χορήγηση όσο και το πόσιμο διάλυμα κιτρικού κιτρικού είναι διαυγή, άχρωμα, αποστειρωμένα, μη πυρετογόνα, υδατικά διαλύματα χωρίς συντηρητικά ρυθμισμένα σε ρΗ 4,7. Κάθε ml περιέχει 20 mg κιτρικού καφεΐνης (που ισοδυναμεί με 10 mg βάσης καφεΐνης) που παρασκευάζεται στο διαλύματος με προσθήκη 10 mg άνυδρης καφεΐνης, USP σε 5 mg μονοένυδρου κιτρικού οξέος, USP, 8,3 mg διένυδρου κιτρικού νατρίου, USP και νερού για Ένεση, USP.
Η καφεΐνη, ένα διεγερτικό του κεντρικού νευρικού συστήματος, είναι μια άσπρη κρυσταλλική σκόνη ή κόκκοι άοσμου, με πικρή γεύση. Είναι ελάχιστα διαλυτό σε νερό και αιθανόλη σε θερμοκρασία δωματίου. Η χημική ονομασία της καφεΐνης είναι η 3,7-διϋδρο-1,3,7-τριμεθυλ-1Η-πουριν-2,6-διόνη. Παρουσία κιτρικού οξέος σχηματίζει άλας κιτρικού κιτρικού σε διάλυμα. Ο δομικός τύπος και το μοριακό βάρος της κιτρικής καφεΐνης ακολουθεί.
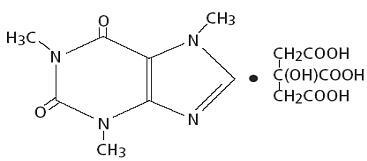
Citrate καφεΐνης
C14H18N4O9 ΜοΙ. Wt. 386.31
μπλουζα
Κλινική Φαρμακολογία
Μηχανισμός δράσης
Η καφεΐνη σχετίζεται δομικά με άλλες μεθυλξανθίνες, θεοφυλλίνη και θεοβρωμίνη. Πρόκειται για ένα βρογχικό λείο μυοχαλαρωτικό, ένα διεγερτικό του ΚΝΣ, ένα διεγερτικό καρδιακού μυός και ένα διουρητικό.
συνεχίστε την παρακάτω ιστορία
Παρόλο που ο μηχανισμός δράσης της καφεΐνης στην άπνοια του πρόωρου τοκετού δεν είναι γνωστός, έχουν υποτεθεί αρκετοί μηχανισμοί. Αυτά περιλαμβάνουν: (1) διέγερση του αναπνευστικού κέντρου, (2) αυξημένο αερισμό λεπτών, (3) μειωμένο κατώφλι έως υπερκαπνία, (4) αυξημένη απόκριση (5) αυξημένος τόνος σκελετικού μυός, (6) μειωμένη κόπωση του διαφράγματος, (7) αυξημένος ρυθμός μεταβολισμού, και (8) αυξημένο οξυγόνο κατανάλωση.
Τα περισσότερα από αυτά τα αποτελέσματα έχουν αποδοθεί στον ανταγωνισμό των υποδοχέων αδενοσίνης, και των δύο υποτύπων Α1 και Α2, από την καφεΐνη, η οποία έχει αποδειχθεί σε δοκιμασίες δέσμευσης υποδοχέα και παρατηρείται σε συγκεντρώσεις που προσεγγίζουν εκείνες που επιτυγχάνονται θεραπευτικά.
Φαρμακοκινητική
Απορρόφηση: Μετά την από του στόματος χορήγηση 10 mg βάσης καφεΐνης / kg σε πρόωρα νεογνά, το μέγιστο επίπεδο στο πλάσμα (CΜέγιστη) για την καφεΐνη κυμάνθηκε από 6-10 mg / L και ο μέσος χρόνος για να φτάσει η μέγιστη συγκέντρωση (TΜέγιστη) κυμαίνονταν από 30 λεπτά έως 2 ώρες. Το ΤΜέγιστη δεν επηρεάστηκε από τη διατροφή των τύπων. Η απόλυτη βιοδιαθεσιμότητα, ωστόσο, δεν εξετάστηκε πλήρως σε πρόωρα νεογνά.
Κατανομή: Η καφεΐνη κατανέμεται ταχέως στον εγκέφαλο. Τα επίπεδα καφεΐνης στο εγκεφαλονωτιαίο υγρό των πρόωρων νεογνών προσεγγίζουν τα επίπεδα στο πλάσμα τους. Ο μέσος όγκος κατανομής της καφεΐνης στα βρέφη (0,8-0,9 L / kg) είναι ελαφρώς υψηλότερος από αυτόν των ενηλίκων (0,6 L / kg). Δεν υπάρχουν διαθέσιμα δεδομένα δέσμευσης πρωτεΐνης πλάσματος για νεογνά ή βρέφη. Σε ενήλικες, η μέση δέσμευση πρωτεΐνης πλάσματος in vitro αναφέρεται περίπου 36%.
Μεταβολισμός: Το ηπατικό κυτόχρωμα P450 1A2 (CYP1A2) εμπλέκεται στη βιομετατροπή της καφεΐνης. Ο μεταβολισμός της καφεΐνης σε πρόωρα νεογνά περιορίζεται λόγω των ανώριμων ηπατικών ενζυμικών συστημάτων τους.
Η ενδομετατροπή μεταξύ καφεΐνης και θεοφυλλίνης έχει αναφερθεί σε πρόωρα νεογνά. τα επίπεδα καφεΐνης είναι περίπου 25% των επιπέδων θεοφυλλίνης μετά τη χορήγηση θεοφυλλίνης και περίπου 3-8% της χορηγούμενης καφεΐνης αναμένεται να μετατραπεί σε θεοφυλλίνη.
Αποβολή: Στα νεαρά βρέφη, η αποβολή της καφεΐνης είναι πολύ βραδύτερη από αυτή στους ενήλικες λόγω της ανώριμης ηπατικής και / ή νεφρικής λειτουργίας. Ο μέσος χρόνος ημιζωής (Τ1/2) και το κλάσμα απεκκρίνεται αμετάβλητο στα ούρα (Αμι) της καφεΐνης σε βρέφη έχει αποδειχθεί ότι αντιστρόφως σχετίζεται με την εποχή της κύησης / μετασχηματισμού. Στα νεογνά, το Τ1/2 είναι περίπου 3-4 ημέρες και το Αμι είναι περίπου 86% (εντός 6 ημερών). Μέχρι την ηλικία των 9 μηνών, ο μεταβολισμός της καφεΐνης προσεγγίζει αυτό που παρατηρείται στους ενήλικες (Τ1/2 = 5 ώρες και Ae = 1%).
Ειδικοί πληθυσμοί: Δεν έχουν διεξαχθεί μελέτες που εξετάζουν τη φαρμακοκινητική της καφεΐνης σε νεογνά με ηπατική ή νεφρική ανεπάρκεια. Η κιτρική καφεΐνη θα πρέπει να χορηγείται με προσοχή σε πρόωρα νεογνά με μειωμένη νεφρική ή ηπατική λειτουργία. Οι συγκεντρώσεις της καφεΐνης στον ορό θα πρέπει να παρακολουθούνται και η χορήγηση της δόσης του κιτρικού καφεΐνης θα πρέπει να προσαρμόζεται για να αποφευχθεί η τοξικότητα σε αυτόν τον πληθυσμό.
Κλινικές μελέτες
Μια πολυκεντρική, τυχαιοποιημένη, διπλή-τυφλή δοκιμή συνέκρινε το κιτρικό καφεΐνη με το εικονικό φάρμακο σε ογδόντα (85) πρόωρα βρέφη (ηλικία κύησης 28 έως <33 εβδομάδων) με άπνοια προδοσίας. Η άπνοια του πρωινού προσδιορίστηκε ως έχουσα τουλάχιστον 6 επεισόδια άπνοιας με διάρκεια μεγαλύτερη των 20 δευτερολέπτων σε περίοδο 24 ωρών χωρίς άλλη αναγνωρίσιμη αιτία άπνοιας. Παρασκευάσθηκε ενδοφλέβια δόση φόρτωσης 1 ml / kg (20 mg / kg κιτρική καφεΐνη που παρείχε 10 mg / kg ως βάση καφεΐνης), ακολουθούμενη από 0,25 ml / kg (5 mg / kg κιτρικού καφεΐνης παρέχοντας 2,5 mg / kg βάσης καφεΐνης) καθημερινή δόση συντήρησης χορηγούμενη είτε ενδοφλεβίως είτε από του στόματος σωλήνας). Η διάρκεια της θεραπείας στη μελέτη αυτή περιορίστηκε σε 10 έως 12 ημέρες. Το πρωτόκολλο επέτρεψε στα βρέφη να «διασπαστούν» με ανοιχτή θεραπεία με κιτρικό κάλιο αν η άπνοια τους παρέμεινε ανεξέλεγκτη κατά τη διάρκεια της διπλά τυφλής φάσης της δοκιμής.
Το ποσοστό των ασθενών χωρίς άπνοια την 2η ημέρα της θεραπείας (24-48 ώρες μετά τη δόση φόρτωσης) ήταν σημαντικά μεγαλύτερο με το κιτρικό καφεΐνης από το εικονικό φάρμακο. Ο παρακάτω πίνακας συνοψίζει τα κλινικά σχετικά τελικά σημεία που αξιολογήθηκαν σε αυτή τη μελέτη: κλιπ
| Citrate καφεΐνης | Εικονικό φάρμακο | p-value | |
|---|---|---|---|
| Αριθμός ασθενών που αξιολογήθηκαν * | 45 | 37 | |
| % των ασθενών με μηδενικά περιστατικά άπνοιας την 2η ημέρα | 26.7 | 8.1 | 0.03 |
| Ποσοστό άπνοιας την ημέρα 2 (ανά 24 ώρες) | 4.9 | 7.2 | 0.134 |
| % των ασθενών με 50% μείωση των συμβάντων άπνοιας από τη βασική γραμμή την ημέρα 2 | 76 | 57 | 0.07 |
| * Από τους 85 ασθενείς που έλαβαν φάρμακο, 3 δεν συμπεριλήφθηκαν στην ανάλυση αποτελεσματικότητας επειδή είχαν <6 επεισόδια άπνοιας / 24 ώρες κατά την έναρξη. |
Σε αυτή τη δοκιμή 10-12 ημερών, ο μέσος αριθμός ημερών με μηδενικά περιστατικά άπνοιας ήταν 3 στην ομάδα του κιτρικού καφεΐνης και 1,2 στην ομάδα του εικονικού φαρμάκου. Ο μέσος αριθμός ημερών με μείωση κατά 50% από τα αρχικά περιστατικά στις εκδηλώσεις άπνοιας ήταν 6,8 στην ομάδα του κιτρικού καφεΐνης και 4,6 στην ομάδα του εικονικού φαρμάκου.
μπλουζα
Ενδείξεις και χρήση
Η ένεση κιτρικού καφεΐνης και το πόσιμο διάλυμα κιτρικής καφεΐνης στο στόμα ενδείκνυνται για τη βραχυχρόνια θεραπεία της άπνοιας των νεογνών σε βρέφη ηλικίας 28 έως και 33 εβδομάδων κύησης.
μπλουζα
Αντενδείξεις
Η έγχυση κιτρικού κιτρικού και το πόσιμο διάλυμα κιτρικού κιτρικού άλατος αντενδείκνυνται σε ασθενείς που έχουν παρουσιάσει υπερευαισθησία σε οποιοδήποτε από τα συστατικά του.
μπλουζα
Προειδοποιήσεις
Κατά τη διάρκεια της διπλά τυφλής, ελεγχόμενης με εικονικό φάρμακο κλινικής μελέτης, αναπτύχθηκαν έξι από τα 85 βρέφη που μελετήθηκαν (καφεΐνη = 46, εικονικό φάρμακο = 39) με 6 περιπτώσεις νεκρωτικής εντεροκολίτιδας, με 3 περιπτώσεις με θάνατο. Πέντε από τους έξι ασθενείς με νεκρωτική εντεροκολίτιδα τυχαιοποιήθηκαν ή είχαν εκτεθεί σε κιτρικό καφεΐνη.
Οι αναφορές στη δημοσιευμένη βιβλιογραφία έθεσαν μια ερώτηση σχετικά με την πιθανή σχέση μεταξύ της χρήσης μεθυλξανθινών και ανάπτυξη νεκρωτικής εντεροκολίτιδας, αν και δεν υπήρξε αιτιώδης σχέση μεταξύ της χρήσης μεθυλξανθίνης και της νεκρωτικής εντεροκολίτιδας καθιερωμένος. Επομένως, όπως και σε όλα τα πρόωρα βρέφη, οι ασθενείς που λαμβάνουν θεραπεία με κιτρικό καφεΐνη πρέπει να παρακολουθούνται προσεκτικά για την ανάπτυξη νεκρωτικής εντεροκολίτιδας.
μπλουζα
Προφυλάξεις
Γενικός
Η άπνοια του πρωινού είναι μια διάγνωση αποκλεισμού. Άλλες αιτίες άπνοιας (π.χ., διαταραχές του κεντρικού νευρικού συστήματος, πρωτογενής πνευμονική νόσο, αναιμία, σηψαιμία, μεταβολικές διαταραχές, καρδιαγγειακές ανωμαλίες ή αποφρακτική άπνοια) πρέπει να αποκλειστούν ή να υποβληθούν σε κατάλληλη θεραπεία πριν από την έναρξη της καφεΐνης Κιτρικό άλας.
Η καφεΐνη είναι διεγερτικό του κεντρικού νευρικού συστήματος και σε περιπτώσεις υπερβολικής δόσης καφεΐνης έχουν αναφερθεί κρίσεις. Η κιτρική καφεΐνη θα πρέπει να χρησιμοποιείται με προσοχή σε βρέφη με διαταραχές των επιληπτικών κρίσεων.
Η διάρκεια της θεραπείας της άπνοιας του νεογέννητου στην ελεγχόμενη με εικονικό φάρμακο δοκιμή περιορίστηκε σε 10 έως 12 ημέρες. Η ασφάλεια και η αποτελεσματικότητα του Citrate Caffeine για μεγαλύτερες περιόδους θεραπείας δεν έχουν τεκμηριωθεί. Ασφάλεια και αποτελεσματικότητα του κιτρικού καφεΐνης για χρήση στην προφυλακτική θεραπεία του ξαφνικού θανάτου του βρέφους (SIDS) ή πριν από την εκσπλαχνισμό σε βρέφη με μηχανική αναπνοή δεν έχουν επίσης καθιερωμένος.
Καρδιαγγειακά
Παρόλο που δεν αναφέρθηκαν περιπτώσεις καρδιακής τοξικότητας στην ελεγχόμενη με εικονικό φάρμακο μελέτη, η καφεΐνη έχει αποδειχθεί ότι αυξάνει τον καρδιακό ρυθμό, την παραγωγή της αριστερής κοιλίας και τον όγκο του εγκεφαλικού επεισοδίου σε δημοσιευμένες μελέτες. Επομένως, το κιτρικό καφεΐνη πρέπει να χρησιμοποιείται με προσοχή σε βρέφη με καρδιαγγειακή νόσο.
Νεφρικά και ηπατικά συστήματα
Η κιτρική καφεΐνη θα πρέπει να χορηγείται με προσοχή σε βρέφη με μειωμένη νεφρική ή ηπατική λειτουργία. Οι συγκεντρώσεις της καφεΐνης στον ορό θα πρέπει να παρακολουθούνται και η χορήγηση της δόσης του κιτρικού καφεΐνης θα πρέπει να προσαρμόζεται για να αποφευχθεί η τοξικότητα σε αυτόν τον πληθυσμό. (Βλέπω Κλινική Φαρμακολογία, Εξάλειψη, Ειδικοί Πληθυσμοί.)
Πληροφορίες για τους ασθενείς
Οι γονείς / φροντιστές των ασθενών που λαμβάνουν πόσιμο διάλυμα κιτρικού κιτρικού πρέπει να λάβουν τις ακόλουθες οδηγίες:
- Το πόσιμο διάλυμα του κιτρικού κιτρικού δεν περιέχει κανένα συντηρητικό και κάθε φιαλίδιο είναι μόνο για μία χρήση. Κάθε μη χρησιμοποιημένο μέρος του φαρμάκου θα πρέπει να απορρίπτεται.
- Είναι σημαντικό η δόση του πόσιμου διαλύματος κιτρικού κιτρικού να μετρηθεί με ακρίβεια, δηλ. Με 1cc ή άλλη κατάλληλη σύριγγα.
- Συμβουλευτείτε το γιατρό σας εάν το μωρό εξακολουθεί να έχει συμβάντα άπνοιας. μην αυξάνετε τη δόση του πόσιμου διαλύματος κιτρικού κιτρικού χωρίς ιατρική συμβουλή.
- Συμβουλευτείτε το γιατρό σας εάν το μωρό αρχίσει να εμφανίζει σημάδια γαστρεντερικής δυσανεξίας, όπως κοιλιακή διαταραχή, έμετο ή αιματηρά κόπρανα ή φαίνεται λήθαργος.
- Το πόσιμο διάλυμα του κιτρικού κιτρικού θα πρέπει να επιθεωρείται οπτικά για σωματιδιακή ύλη και αποχρωματισμό πριν από τη χορήγηση του. Τα φιαλίδια που περιέχουν αποχρωματισμένο διάλυμα ή ορατά σωματίδια πρέπει να απορρίπτονται.
Εργαστηριακές δοκιμές
Πριν από την έναρξη του κιτρικού καφεΐνης, τα βασικά επίπεδα ορού της καφεΐνης θα πρέπει να μετρηθούν σε τα βρέφη που έχουν προηγουμένως υποβληθεί σε θεραπεία με θεοφυλλίνη, καθώς τα πρόωρα βρέφη μεταβολίζουν τη θεοφυλλίνη σε καφεΐνη. Παρομοίως, τα βασικά επίπεδα ορού της καφεΐνης θα πρέπει να μετριούνται σε βρέφη που γεννιούνται από μητέρες που κατανάλωναν καφεΐνη πριν την παράδοση, αφού η καφεΐνη διέσχισε εύκολα τον πλακούντα.
Στην ελεγχόμενη με εικονικό φάρμακο κλινική δοκιμή, τα επίπεδα καφεΐνης κυμαίνονταν από 8 έως 40 mg / L. Ένα θεραπευτικό εύρος συγκέντρωσης καφεΐνης στο πλάσμα δεν μπορούσε να καθοριστεί από την ελεγχόμενη με εικονικό φάρμακο κλινική δοκιμή. Έχει αναφερθεί σοβαρή τοξικότητα στη βιβλιογραφία όταν τα επίπεδα καφεΐνης του ορού υπερβαίνουν τα 50 mg / L. Οι συγκεντρώσεις της καφεΐνης στον ορό μπορεί να χρειάζεται να παρακολουθούνται περιοδικά καθ 'όλη τη διάρκεια της θεραπείας για να αποφευχθεί η τοξικότητα.
Σε κλινικές μελέτες που αναφέρθηκαν στη βιβλιογραφία, παρατηρήθηκαν περιπτώσεις υπογλυκαιμίας και υπεργλυκαιμίας. Επομένως, η γλυκόζη του ορού μπορεί να πρέπει να παρακολουθείται περιοδικά σε βρέφη που λαμβάνουν κιτρικό καφεΐνη.
Αλληλεπιδράσεις με άλλα φάρμακα
Το κυτόχρωμα P450 1A2 (CYP1A2) είναι γνωστό ότι είναι το κύριο ένζυμο που εμπλέκεται στον μεταβολισμό της καφεΐνης. Επομένως, η καφεΐνη έχει τη δυνατότητα να αλληλεπιδράσει με φάρμακα που είναι υποστρώματα για το CYP1A2, αναστέλλουν το CYP1A2 ή επάγουν το CYP1A2.
Λίγα δεδομένα υπάρχουν σχετικά με τις αλληλεπιδράσεις φαρμάκων με καφεΐνη στα πρόωρα νεογνά. Με βάση τα δεδομένα για ενήλικες, μπορεί να χρειαστούν χαμηλότερες δόσεις καφεΐνης μετά από συγχορήγηση φαρμάκων τα οποία αναφέρθηκαν ότι μειώνουν την απομάκρυνση της καφεΐνης (π.χ. σιμετιδίνη και κετοκοναζόλη) και μεγαλύτερες δόσεις καφεΐνης μπορεί να χρειαστούν μετά από συγχορήγηση φαρμάκων που αυξάνουν την απομάκρυνση της καφεΐνης (π.χ. φαινοβαρβιτάλη και φαινυτοΐνη).
Η καφεΐνη που χορηγήθηκε ταυτόχρονα με την κετοπροφαίνη μείωσε τον όγκο των ούρων σε τέσσερις υγιείς εθελοντές. Η κλινική σημασία αυτής της αλληλεπίδρασης σε πρόωρα νεογνά δεν είναι γνωστή.
Η ενδομετατροπή μεταξύ καφεΐνης και θεοφυλλίνης έχει αναφερθεί σε πρόωρα νεογνά. Η ταυτόχρονη χρήση αυτών των φαρμάκων δεν συνιστάται.
Καρκινογένεση, Μεταλλαξογένεση, Βλάβη της Γονιμότητας
Σε μια διετή μελέτη σε αρουραίους Sprague-Dawley, η καφεΐνη (ως βάση καφεΐνης) που χορηγήθηκε σε πόσιμο νερό δεν ήταν καρκινογόνος σε αρσενικούς αρουραίους σε δόσεις μέχρι 102 mg / kg ή σε θηλυκούς αρουραίους σε δόσεις μέχρι 170 mg / kg (περίπου 2 και 4 φορές, αντίστοιχα, η μέγιστη συνιστώμενη δόση ενδοφλέβιας φόρτωσης για βρέφη σε mg / m2 βάση). Σε μελέτη 18 μηνών σε ποντίκια C57BL / 6, δεν παρατηρήθηκε καμία ένδειξη ογκογονικότητας σε δόσεις διατροφής έως 55 mg / kg (μικρότερη από τη μέγιστη συνιστώμενη δόση ενδοφλέβιας φόρτωσης για βρέφη σε mg / m2 βάση).
Η καφεΐνη (ως βάση καφεΐνης) αύξησε την αλληλεπίδραση SCE / κυτταρικής μεταφάσεως της αδελφής χρωματοειδούς (SCE) (εξαρτώμενη από την έκθεση σε χρόνο) σε ανάλυση in vivo μετάφρασης ποντικού. Η καφεΐνη ενίσχυσε επίσης τη γονιδιοτοξικότητα γνωστών μεταλλαξιογόνων παραγόντων και ενίσχυσε τον σχηματισμό μικροπυρήνων (5 φορές) σε ποντίκια με ανεπάρκεια φυλλικού οξέος. Ωστόσο, η καφεΐνη δεν αύξησε τις χρωμοσωμικές ανωμαλίες σε δοκιμασίες κυττάρων ωοθήκης κινέζικου χάμστερ in vitro (CHO) και ανθρώπινων λεμφοκυττάρων και δεν είναι μεταλλαξιογόνο σε δοκιμασία μετάλλαξης γονιδίου CHO / υποξανθίνης γουανίνης φωσφοριβοσυλοτρανσφεράσης (HGPRT) in vitro, εκτός από την κυτταροτοξική συγκεντρώσεις. Επιπροσθέτως, η καφεΐνη δεν ήταν κλαστογόνος σε έναν in νίνο προσδιορισμό μικροπυρήνων ποντικού.
Η καφεΐνη (ως βάση καφεΐνης) χορηγούμενη σε αρσενικούς αρουραίους στα 50 mg / kg / ημέρα υποδορίως (περίπου ίση με τη μέγιστη συνιστώμενη δόση ενδοφλέβιας φόρτωσης για βρέφη σε mg / m2 βάση) για 4 ημέρες πριν από το ζευγάρωμα με μη υποβληθέντα σε αγωγή θηλυκά, προκάλεσε μειωμένη αναπαραγωγική απόδοση των αρσενικών εκτός από την πρόκληση εμβρυοτοξικότητας. Επιπλέον, η μακροχρόνια έκθεση σε υψηλές από του στόματος δόσεις καφεΐνης (3 g για 7 εβδομάδες) ήταν τοξική για τους όρχεις αρουραίων όπως εκδηλώνεται με εκφυλισμό των σπερματογόνων κυττάρων.
Εγκυμοσύνη: Εγκυμοσύνη Κατηγορία Γ
Η ανησυχία για την τερατογένεση της καφεΐνης δεν έχει σημασία όταν χορηγείται σε βρέφη. Σε μελέτες που πραγματοποιήθηκαν σε ενήλικα ζώα, η καφεΐνη (ως βάση καφεΐνης) που χορηγήθηκε σε έγκυες ποντίκια ως δισκία παρατεταμένης απελευθέρωσης στα 50 mg / kg (μικρότερη από τη μέγιστη συνιστώμενη δόση ενδοφλέβιας φόρτωσης για βρέφη σε mg / m2 βάση), κατά τη διάρκεια της οργανογένεσης, προκάλεσε χαμηλή συχνότητα εμφάνισης σχισίματος στον ουρανίσκο και εγκεφαλία στα έμβρυα. Δεν υπάρχουν επαρκείς και καλά ελεγχόμενες μελέτες σε έγκυες γυναίκες.
μπλουζα
Ανεπιθύμητες ενέργειες
Συνολικά, ο αναφερόμενος αριθμός ανεπιθύμητων ενεργειών στην διπλά τυφλή περίοδο της ελεγχόμενης δοκιμής ήταν παρόμοιος για τις ομάδες του κιτρικού καφεΐνης και του εικονικού φαρμάκου. Ο παρακάτω πίνακας δείχνει τα ανεπιθύμητα συμβάντα που εμφανίστηκαν στην διπλά τυφλή περίοδο της ελεγχόμενης δοκιμής και τα οποία ήταν συχνότερα σε ασθενείς που έλαβαν κιτρικό καφεΐνη από το εικονικό φάρμακο.
| Ανεπιθύμητη ενέργεια (AE) | Citrate καφεΐνης Ν = 46 n (%) |
Εικονικό φάρμακο Ν = 39 n (%) |
|---|---|---|
| Ο ΣΩΜΑ ΩΣ ΟΛΟΚΛΗΡΟ | ||
| Τραυματικός τραυματισμός | 1 (2.2) | 0 (0.0) |
| Διατροφική μισαλλοδοξία | 4 (8.7) | 2 (5.1) |
| Σήψη | 2 (4.3) | 0 (0.0) |
| ΚΑΡΔΙΑΓΓΕΙΑΚΟ ΣΥΣΤΗΜΑ | ||
| Αιμορραγία | 1 (2.2) | 0 (0.0) |
| ΠΕΠΤΙΚΟ ΣΥΣΤΗΜΑ | ||
| Νεκροποιητική εντεροκολίτιδα | 2 (4.3) | 1 (2.6) |
| Γαστρίτιδα | 1 (2.2) | 0 (0.0) |
| Γαστρεντερική αιμορραγία | 1 (2.2) | 0 (0.0) |
| ΗΜΙΚΟ ΚΑΙ ΛΥΜΠΑΤΙΚΟ ΣΥΣΤΗΜΑ | ||
| Διάχυτη ενδοαγγειακή πήξη | 1 (2.2) | 0 (0.0) |
| ΜΕΤΑΒΟΛΙΚΕΣ ΚΑΙ ΔΙΑΤΡΟΦΙΚΕΣ ΔΙΑΤΑΡΑΧΕΣ | ||
| Αλκαλική ύφεσις αίματος | 1 (2.2) | 0 (0.0) |
| Θεραπεία μη φυσιολογική | 1 (2.2) | 0 (0.0) |
| ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ | ||
| Εγκεφαλική αιμορραγία | 1 (2.2) | 0 (0.0) |
| ΑΝΑΠΝΕΥΣΤΙΚΟ ΣΥΣΤΗΜΑ | ||
| Δύσπνοια | 1 (2.2) | 0 (0.0) |
| Οίδημα πνεύμονα | 1 (2.2) | 0 (0.0) |
| ΔΕΡΜΑ ΚΑΙ ΠΑΡΑΔΕΙΓΜΑΤΑ | ||
| Ξηρό δέρμα | 1 (2.2) | 0 (0.0) |
| Εξάνθημα | 4 (8.7) | 3 (7.7) |
| Καταστροφή του δέρματος | 1 (2.2) | 0 (0.0) |
| ΕΙΔΙΚΕΣ ΑΙΣΘΗΤΙΚΕΣ | ||
| Αμφιβληστροειδοπάθεια του πρόωρου | 1 (2.2) | 0 (0.0) |
| ΟΡΓΑΝΙΚΟ ΣΥΣΤΗΜΑ | ||
| Νεφρική ανεπάρκεια | 1 (2.2) | 0 (0.0) |
Εκτός από τις παραπάνω περιπτώσεις, διαγνώστηκαν τρεις περιπτώσεις νεκρωτικής εντεροκολίτιδας σε ασθενείς που έλαβαν κιτρικό καφεΐνη κατά την ανοιχτή φάση της μελέτης.
Τρία από τα βρέφη που ανέπτυξαν νεκρωτική εντεροκολίτιδα κατά τη διάρκεια της δίκης πέθαναν. Όλα είχαν εκτεθεί στην καφεΐνη. Δύο τυχαιοποιήθηκαν στην καφεΐνη και ένας ασθενής με εικονικό φάρμακο "διασώθηκε" με ανοικτή καφεΐνη για ανεξέλεγκτη άπνοια.
Τα ανεπιθύμητα συμβάντα που περιγράφονται στη δημοσιευμένη βιβλιογραφία περιλαμβάνουν: διέγερση του κεντρικού νευρικού συστήματος (δηλ. Ευερεθιστότητα, ανησυχία, τρανταξία), καρδιαγγειακές επιδράσεις (δηλ. ταχυκαρδία, αυξημένη έξοδος της αριστερής κοιλίας και αυξημένο όγκο εγκεφαλικού), γαστρεντερικές επιδράσεις (δηλ. αυξημένη γαστρική αναρρόφηση, γαστρεντερική δυσανεξία), μεταβολές στη γλυκόζη στον ορό (υπογλυκαιμία και υπεργλυκαιμία) και νεφρικές επιδράσεις (αυξημένος ρυθμός ροής ούρων, αυξημένη κάθαρση κρεατινίνης και αυξημένο νάτριο και ασβέστιο απέκκριση). Δημοσιευμένες μακροπρόθεσμες μελέτες παρακολούθησης δεν έδειξαν ότι η καφεΐνη επηρεάζει δυσμενώς την νευρολογική ανάπτυξη ή τις παραμέτρους ανάπτυξης.
μπλουζα
Υπερδοσολογία
Μετά την υπερδοσολογία, τα επίπεδα καφεΐνης στον ορό κυμαίνονταν από περίπου 24 mg / L (μετά την κυκλοφορία του προϊόντος στο εμπόριο αυθόρμητη αναφορά κρούσματος στην οποία ένα βρέφος εξέθεσε ευερεθιστότητα, κακή διατροφή και αϋπνία) έως 350 χλστγρ / λίτρο. Σοβαρή τοξικότητα έχει συσχετιστεί με επίπεδα ορού μεγαλύτερα από 50 mg / L (βλ Προφυλάξεις-Εργαστηριακές δοκιμές και Δοσολογία και χορήγηση). Τα συμπτώματα και τα συμπτώματα που αναφέρθηκαν στη βιβλιογραφία μετά από υπερδοσολογία με καφεΐνη σε πρόωρα βρέφη περιλαμβάνουν πυρετό, ταχυπενία, θόρυβο, αϋπνία, λεπτό τρόμο των άκρων, υπερτονία, οπισθοτόνη, τονοκλονικές κινήσεις, μη χρησιμοποιούμενες κινήσεις των γνάθων και των χειλιών, έμετος, υπεργλυκαιμία, αυξημένο άζωτο ουρίας αίματος και αυξημένα ολικά λευκοκύτταρα συγκέντρωση. Κατασχέσεις έχουν επίσης αναφερθεί σε περιπτώσεις υπερδοσολογίας. Έχει αναφερθεί μία περίπτωση υπερδοσολογίας καφεΐνης που περιπλέκεται από την ανάπτυξη ενδοκοιλιακής αιμορραγίας και μακροπρόθεσμων νευρολογικών επιπτώσεων. Άλλη περίπτωση υπερδοσολογίας με κιτρική καφεΐνη (από τη Νέα Ζηλανδία) περίπου 600 mg κιτρίνης καφεΐνης (περίπου 322 mg / kg) που χορηγήθηκε σε διάστημα 40 λεπτών, περιπλέκεται από ταχυκαρδία, κατάθλιψη ST, αναπνευστική δυσχέρεια, καρδιακή ανεπάρκεια, γαστρική διαταραχή, οξέωση και σοβαρή εγκαύματα εξαγγείωσης με νέκρωση ιστού στην περιφερική ενδοφλέβια στο σημείο της ένεσης. Δεν έχουν αναφερθεί θανάτους που σχετίζονται με την υπερβολική δόση καφεΐνης σε πρόωρα βρέφη.
Η θεραπεία της υπερβολικής δόσης της καφεΐνης είναι κυρίως συμπτωματική και υποστηρικτική. Τα επίπεδα καφεΐνης έχει αποδειχθεί ότι μειώνονται μετά από μεταγγίσεις ανταλλαγής. Οι σπασμοί μπορούν να αντιμετωπιστούν με ενδοφλέβια χορήγηση διαζεπάμης ή βαρβιτουρικού οξέος όπως το νατριούχο πεντοβαρβιτάλη.
μπλουζα
Δοσολογία και χορήγηση
Πριν από την έναρξη του κιτρικού καφεΐνης, τα βασικά επίπεδα ορού της καφεΐνης θα πρέπει να μετρηθούν σε τα βρέφη που έχουν προηγουμένως υποβληθεί σε θεραπεία με θεοφυλλίνη, καθώς τα πρόωρα βρέφη μεταβολίζουν τη θεοφυλλίνη σε καφεΐνη. Παρομοίως, τα βασικά επίπεδα ορού της καφεΐνης θα πρέπει να μετριούνται σε βρέφη που γεννιούνται από μητέρες που κατανάλωναν καφεΐνη πριν την παράδοση, αφού η καφεΐνη διέσχισε εύκολα τον πλακούντα.
Συνιστάται η συνιστώμενη δόση φόρτωσης και οι δόσεις συντήρησης της κιτρικής καφεΐνης.
| Δόση του κιτρικού καφεΐνης Ενταση ΗΧΟΥ |
Δόση του κιτρικού καφεΐνης mg / kg |
Διαδρομή | Συχνότητα | |
|---|---|---|---|---|
| Αρχική δόση | 1 mL / kg | 20 mg / kg | Ενδοφλέβια * (πάνω από 30 λεπτά) | Μια φορά |
| Δόση συντήρησης | 0,25 mL / kg | 5 mg / kg | Ενδοφλέβια * (πάνω από 10 λεπτά) ή από το στόμα | Κάθε 24 ώρες ** |
| * χρησιμοποιώντας μια αντλία έγχυσης σύριγγας ** αρχίζοντας 24 ώρες μετά τη δόση φόρτωσης |
ΣΗΜΕΙΩΣΤΕ ΟΤΙ Η ΔΟΣΗ ΒΑΣΗΣ ΚΑΦΕΪΝΗΣ ΕΙΝΑΙ ΜΙΑ ΕΞΕΛΙΞΗ ΤΗΣ ΔΟΣΗΣ ΟΠΩΣ ΕΚΦΡΑΖΕΤΑΙ ΩΣ ΚΙΤΡΙΝΗ ΚΑΦΑΙΝΗΣ (π.χ. 20 mg κιτρικού καφεΐνης ισοδυναμεί με 10 mg βάσης καφεΐνης).
Οι συγκεντρώσεις της καφεΐνης στον ορό μπορεί να χρειάζεται να παρακολουθούνται περιοδικά καθ 'όλη τη διάρκεια της θεραπείας για να αποφευχθεί η τοξικότητα. Σοβαρή τοξικότητα έχει συσχετιστεί με επίπεδα ορού μεγαλύτερα από 50 mg / L.
Η ένεση κιτρικού καφέ και το πόσιμο διάλυμα κιτρικού κιτρικού θα πρέπει να επιθεωρούνται οπτικά για σωματιδιακή ύλη και αποχρωματισμό πριν από τη χορήγηση. Τα φιαλίδια που περιέχουν αποχρωματισμένο διάλυμα ή ορατά σωματίδια πρέπει να απορρίπτονται.
Συμβατότητα με τα ναρκωτικά
Για να ελεγχθεί η συμβατότητα του φαρμάκου με κοινά ενδοφλέβια διαλύματα ή φάρμακα, χρησιμοποιήθηκαν 20 mL έγχυσης κιτρικού κιτρικού σε συνδυασμό με 20 mL διαλύματος ή φαρμάκου, με εξαίρεση ένα μείγμα Intralipid®, το οποίο συνδυάστηκε ως 80 mL / 80 mL. Η φυσική εμφάνιση των συνδυασμένων διαλυμάτων αξιολογήθηκε για καταβύθιση. Τα μίγματα αναμίχθηκαν για 10 λεπτά και στη συνέχεια αναλύθηκαν για καφεΐνη. Τα μίγματα στη συνέχεια αναμίχθηκαν συνεχώς για 24 ώρες, με περαιτέρω δειγματοληψία για προσδιορισμούς καφεΐνης στις 2, 4, 8 και 24 ώρες.
Με βάση αυτή τη δοκιμή, η έγχυση του Caffeine Citrate, 60 mg / 3 mL, είναι χημικά σταθερή για 24 ώρες σε θερμοκρασία δωματίου όταν συνδυάζεται με τα ακόλουθα προϊόντα δοκιμής.
- Ένεση δεξτρόζης, USP 5%
- 50% ένεση δεξτρόζης USP
- Intralipid® 20% γαλακτώματος λίπους IV
- Aminosyn® 8,5% διάλυμα κρυσταλλικού αμινοξέος
- Ενέσιμο ΗΟΙ ντοπαμίνης, USP 40 mg / mL αραιωμένο σε 0,6 mg / mL με έγχυση δεξτρόζης, USP 5%
- Ενέσιμο γλυκονικό ασβέστιο, USP 10% (0,465 mEq / Ca + 2 / mL)
- Ενέσιμο διάλυμα νατρίου ηπαρίνης, USP 1000 μονάδες / mL αραιωμένο σε 1 μονάδα / mL με ένεση δεξτρόζης, USP 5%
- Ενέσιμο διάλυμα κιτρικού φεντανυλίου, USP 50 μg / mL αραιωμένο σε 10 μg / mL με ένεση δεξτρόζης, USP 5%
μπλουζα
Πώς παρέχεται
Τόσο η ένεση κιτρικού καφεΐνης όσο και το πόσιμο διάλυμα κιτρικού κιτρικού είναι διαθέσιμα ως διαυγή, άχρωμα, στείρα, μη πυρετογόνα, χωρίς συντηρητικά, υδατικά διαλύματα σε 5 ml άχρωμων γυάλινων φιαλιδίων. Τα φιαλίδια της ένεσης Caffeine Citrate σφραγίζονται με γκρι ελαστικό πώμα και λευκό σφραγιστικό αλουμινίου τυπωμένο με κόκκινο χρώμα "FOR INTRAVENOUS USE ONLY" μόνο. Τα φιαλίδια του πόσιμου διαλύματος κιτρικού κιτρικού σφραγίζονται με γκρι ελαστικό πώμα και σκούρο μπλε χρώμα ματ φινίρισμα, ξεκλειδώστε σφραγίδα αλουμινίου τυπωμένη με "FOR FOREAL USE ONLY - FLIP UP & TEAR" σε λευκό.
Τόσο τα φιαλίδια ένεσης όσο και το στόμα διαλύματος περιέχουν 3 mL διαλύματος σε συγκέντρωση 20 mg / mL κιτρική καφεΐνη (60 mg / φιαλίδιο) ισοδύναμη με βάση καφεΐνης 10 mg / mL (30 mg / φιαλίδιο).
Εισαγωγή κιτρικού κιτρικού, USP
NDC 47335-289-40: φιαλίδιο 3 mL, συσκευασμένο ξεχωριστά σε χαρτοκιβώτιο.
Πόσιμο διάλυμα κιτρικού κιτρικού, USP
NDC 47335-290-44: φιαλίδιο 3 mL (μη ανθεκτικό στο βρέφος), 10 φιαλίδια ανά λευκό
δοχείο από πολυπροπυλένιο για παιδιά.
Φυλάσσεται στους 20 ° έως 25 ° C (68 ° έως 77 ° F). επιτρεπόμενες εκδρομές μεταξύ 15 ° και 30 ° C (59 ° και 86 ° F) [βλέπε USP Ελεγχόμενη θερμοκρασία δωματίου].
Χωρίς συντηρητικά. Μόνο για μία χρήση. Απορρίψτε το μη χρησιμοποιημένο τμήμα.
ΠΡΟΣΟΧΗ ΦΑΡΜΑΚΟΣΤΟΣ: Αποσυνδέστε "Οδηγίες Χρήσης" από το ένθετο της συσκευασίας και μην χορηγείτε συνταγή για το διάλυμα Caffeine Citrate.
Διανεμήθηκαν από:
Caraco Pharmaceutical Laboratories, Ltd.
1150 Elijah McCoy Drive, Ντιτρόιτ, MI 48202
Κατασκευασμένο από:
Sun Pharmaceutical Ind. Ε.Π.Ε.
Η οδό Halol-Baroda,
Halol-389 350, Gujarat, Ινδία.
Τελευταία ενημέρωση 02/2010
Πληροφορίες για τον ασθενή με κιτρικό κάλιο (στην απλή αγγλική γλώσσα)
Λεπτομερείς πληροφορίες σχετικά με Σημεία, συμπτώματα, αιτίες, θεραπείες διαταραχών ύπνου
Οι πληροφορίες σε αυτή τη μονογραφία δεν προορίζονται να καλύψουν όλες τις πιθανές χρήσεις, οδηγίες, προφυλάξεις, αλληλεπιδράσεις φαρμάκων ή ανεπιθύμητες ενέργειες. Αυτές οι πληροφορίες είναι γενικευμένες και δεν προορίζονται ως συγκεκριμένες ιατρικές συμβουλές. Εάν έχετε απορίες σχετικά με τα φάρμακα που παίρνετε ή θέλετε περισσότερες πληροφορίες, επικοινωνήστε με το γιατρό σας, το φαρμακοποιό ή τη νοσοκόμα σας.
πίσω στο:
~ όλα τα άρθρα σχετικά με τις διαταραχές του ύπνου



