NovoLog για τη θεραπεία του διαβήτη
Εμπορικό σήμα: NovoLog
Γενικό όνομα: ινσουλίνη aspart
Μορφή δοσολογίας: ένεση
Περιεχόμενα:
Ενδείξεις και χρήση
Δοσολογία και χορήγηση
Φόρμες Δοσολογίας και Strenghts
Αντενδείξεις
Προειδοποιήσεις και προφυλάξεις
Ανεπιθύμητες ενέργειες
Αλληλεπιδράσεις με άλλα φάρμακα
Χρήση σε συγκεκριμένους πληθυσμούς
Υπερδοσολογία
Περιγραφή
Κλινική Φαρμακολογία
Μη κλινική τοξικολογία
Κλινικές μελέτες
Πώς παρέχεται / αποθήκευση και χειρισμός
NovoLog, ινσουλίνη aspart, πληροφορίες για τον ασθενή (στην απλή αγγλική γλώσσα)
Ενδείξεις και χρήση
Θεραπεία του σακχαρώδους διαβήτη
Το NovoLog είναι ένα ανάλογο ινσουλίνης που υποδεικνύεται για τη βελτίωση του γλυκαιμικού ελέγχου σε ενήλικες και παιδιά με σακχαρώδη διαβήτη.
μπλουζα
Δοσολογία και χορήγηση
Δοσολογία
Το NovoLog είναι ένα ανάλογο ινσουλίνης με προηγούμενη έναρξη δράσης από την κανονική ανθρώπινη ινσουλίνη. Η δοσολογία του NovoLog πρέπει να εξατομικευθεί. Το NovoLog που χορηγείται με υποδόρια ένεση θα πρέπει γενικά να χρησιμοποιείται σε σχήματα με ενδιάμεση ή μακράς δράσης ινσουλίνη [βλ
Προειδοποιήσεις και προφυλάξεις, Πώς παρέχεται / αποθήκευση και χειρισμός]. Η συνολική ημερήσια απαίτηση ινσουλίνης μπορεί να ποικίλει και είναι συνήθως μεταξύ 0,5 και 1,0 μονάδων / kg / ημέρα. Όταν χρησιμοποιείται σε θεραπευτική αγωγή με υποδόρια ένεση σχετιζόμενη με το γεύμα, 50 έως 70% της συνολικής ινσουλίνης οι απαιτήσεις μπορούν να παρέχονται από το NovoLog και το υπόλοιπο να παρέχεται από ένα ενδιάμεσο ή ινσουλίνη μακράς δράσης. Λόγω της συγκριτικά γρήγορης έναρξης και βραχείας διάρκειας της δραστηριότητας μείωσης της γλυκόζης του NovoLog, ορισμένοι ασθενείς ενδέχεται να χρειαστούν περισσότερα βασική ινσουλίνη και περισσότερη ολική ινσουλίνη για την πρόληψη της υπεργλυκαιμίας πριν από το γεύμα κατά τη χρήση του NovoLog από ό, τι όταν χρησιμοποιείται ανθρώπινη κανονική ινσουλίνη.Μην χρησιμοποιείτε το NovoLog που είναι παχύρρευστο (παχύρρευστο) ή θολό. χρήση μόνο εάν είναι διαυγές και άχρωμο. Το NovoLog δεν πρέπει να χρησιμοποιείται μετά την ημερομηνία εκτύπωσης.
Υποδόρια ένεση
Το NovoLog πρέπει να χορηγείται με υποδόρια ένεση στην περιοχή της κοιλιάς, στους γλουτούς, στον μηρό ή στον άνω βραχίονα. Επειδή το NovoLog έχει ταχύτερη έναρξη και μικρότερη διάρκεια δραστηριότητας σε σχέση με την κανονική ινσουλίνη, θα πρέπει να εγχέεται αμέσως (εντός 5-10 λεπτών) πριν το γεύμα. Οι θέσεις έγχυσης πρέπει να περιστρέφονται στην ίδια περιοχή για να μειωθεί ο κίνδυνος λιποδυστροφίας. Όπως με όλες τις ινσουλίνες, η διάρκεια δράσης του NovoLog θα ποικίλει ανάλογα με τη δόση, το σημείο της ένεσης, τη ροή του αίματος, τη θερμοκρασία και το επίπεδο φυσικής δραστηριότητας.
Το NovoLog μπορεί να αραιωθεί με μέσο αραίωσης ινσουλίνης για το NovoLog για υποδόρια ένεση. Το διάλυμα NovoLog σε εννέα μέρη αραιωτικού θα δώσει συγκέντρωση 1/10 της συγκέντρωσης του NovoLog (ισοδύναμη με U-10). Αραίωση ενός μέρους του NovoLog σε διαλύτη ενός μέρους θα αποδώσει συγκέντρωση μισή από αυτή του NovoLog (ισοδύναμη με U-50).
Συνεχής υποδόρια έγχυση ινσουλίνης (CSII) με εξωτερική αντλία
Το NovoLog μπορεί επίσης να εγχυθεί υποδόρια με εξωτερική αντλία ινσουλίνης [βλ Προειδοποιήσεις και προφυλάξεις, Πώς παρέχεται / αποθήκευση και χειρισμός]. Η αραιωμένη ινσουλίνη δεν πρέπει να χρησιμοποιείται σε εξωτερικές αντλίες ινσουλίνης. Επειδή το NovoLog έχει πιο γρήγορη έναρξη και μικρότερη διάρκεια δραστηριότητας από την κανονική ινσουλίνη, οι βλωμοί του NovoLog πριν από το γεύμα πρέπει να εγχυθούν αμέσως (εντός 5-10 λεπτών) πριν από το γεύμα. Οι θέσεις έγχυσης πρέπει να περιστρέφονται στην ίδια περιοχή για να μειωθεί ο κίνδυνος λιποδυστροφίας. Ο αρχικός προγραμματισμός της εξωτερικής αντλίας έγχυσης ινσουλίνης θα πρέπει να βασίζεται στη συνολική ημερήσια δόση ινσουλίνης του προηγούμενου σχήματος. Αν και υπάρχει σημαντική μεταβλητότητα μεταξύ των ασθενών, περίπου το 50% της συνολικής δόσης χορηγείται συνήθως ως βότανα NovoLog που σχετίζονται με το γεύμα και το υπόλοιπο χορηγείται ως βασική έγχυση. Αλλάξτε το NovoLog στη δεξαμενή, τα σετ έγχυσης και το σημείο εισαγωγής του σετ έγχυσης τουλάχιστον κάθε 48 ώρες.
Ενδοφλέβια χρήση
Το NovoLog μπορεί να χορηγηθεί ενδοφλέβια υπό ιατρική παρακολούθηση για έλεγχο γλυκαιμίας με προσεκτική παρακολούθηση των επιπέδων γλυκόζης και καλίου στο αίμα για την αποφυγή υπογλυκαιμίας και υποκαλιαιμίας [βλ. Προειδοποιήσεις και προφυλάξεις, Πώς παρέχεται / αποθήκευση και χειρισμός]. Για ενδοφλέβια χρήση, το NovoLog θα πρέπει να χρησιμοποιείται σε συγκεντρώσεις από 0,05 U / mL έως 1,0 U / mL ινσουλίνης aspart σε συστήματα έγχυσης χρησιμοποιώντας σακούλες έγχυσης από πολυπροπυλένιο. Το NovoLog έχει αποδειχθεί ότι είναι σταθερό σε υγρά έγχυσης όπως το χλωριούχο νάτριο 0,9%.
Επιθεωρήστε το NovoLog για σωματίδια και αποχρωματισμό πριν από την παρεντερική χορήγηση.
μπλουζα
Φόρμες Δοσολογίας και Strenghts
Το NovoLog διατίθεται στα ακόλουθα μεγέθη συσκευασίας: κάθε παρουσίαση περιέχει 100 μονάδες ασπαρτικής ινσουλίνης ανά mL (U-100).
- Φιαλίδια των 10 mL
- 3 mL PenFill φυσίγγια για τη συσκευή χορήγησης φυσιγγίων 3 mL PenFill (με ή χωρίς την προσθήκη ενός NovoPen® 3 PenMate®) με βελόνες μιας χρήσης NovoFine®
- 3 mL NovoLog FlexPen προγεμισμένη σύριγγα
μπλουζα
Αντενδείξεις
Το NovoLog αντενδείκνυται
- κατά τη διάρκεια επεισοδίων υπογλυκαιμίας
- σε ασθενείς με υπερευαισθησία στο NovoLog ή σε κάποιο από τα έκδοχα του.
μπλουζα
Προειδοποιήσεις και προφυλάξεις
Διαχείριση
Το NovoLog έχει ταχύτερη έναρξη δράσης και μικρότερη διάρκεια δραστηριότητας από την κανονική ανθρώπινη ινσουλίνη. Μια ένεση του NovoLog πρέπει να ακολουθείται αμέσως από ένα γεύμα μέσα σε 5-10 λεπτά. Λόγω της μικρής διάρκειας δράσης του NovoLog, μια ινσουλίνη με μεγαλύτερη διάρκεια δράσης πρέπει επίσης να χρησιμοποιείται σε ασθενείς με διαβήτη τύπου 1 και μπορεί επίσης να χρειαστεί σε ασθενείς με διαβήτη τύπου 2. Η παρακολούθηση της γλυκόζης συνιστάται για όλους τους ασθενείς με διαβήτη και είναι ιδιαίτερα σημαντική για τους ασθενείς που χρησιμοποιούν εξωτερική θεραπεία με έγχυση με αντλία.
Οποιαδήποτε αλλαγή της δόσης ινσουλίνης πρέπει να γίνεται προσεκτικά και μόνο υπό ιατρική παρακολούθηση. Η αλλαγή από ένα προϊόν ινσουλίνης σε άλλη ή η αλλαγή της αντοχής ινσουλίνης μπορεί να οδηγήσει στην ανάγκη για αλλαγή στη δοσολογία. Όπως συμβαίνει με όλα τα σκευάσματα ινσουλίνης, η χρονική πορεία της δράσης NovoLog μπορεί να ποικίλει σε διαφορετικά άτομα ή σε διαφορετικούς χρόνους στο ίδιο άτομο και εξαρτάται από πολλές καταστάσεις, συμπεριλαμβανομένης της θέσης ένεσης, της τοπικής παροχής αίματος, της θερμοκρασίας και της σωματικής δραστηριότητας. Οι ασθενείς που αλλάζουν το επίπεδο φυσικής τους δραστηριότητας ή το σχέδιο γεύματός τους μπορεί να χρειαστούν προσαρμογή των δόσεων ινσουλίνης. Οι ανάγκες σε ινσουλίνη μπορεί να μεταβάλλονται κατά τη διάρκεια ασθένειας, συναισθηματικών διαταραχών ή άλλων πιέσεων.
Οι ασθενείς που χρησιμοποιούν συνεχή υποδόρια θεραπεία αντλίας με έγχυση ινσουλίνης πρέπει να εκπαιδεύονται για τη χορήγηση ινσουλίνης με ένεση και να διαθέτουν εναλλακτική θεραπεία ινσουλίνης σε περίπτωση βλάβης της αντλίας.
Υπογλυκαιμία
Η υπογλυκαιμία είναι η πιο συχνή ανεπιθύμητη ενέργεια όλων των θεραπειών ινσουλίνης, συμπεριλαμβανομένου του NovoLog. Η σοβαρή υπογλυκαιμία μπορεί να οδηγήσει σε απώλεια συνείδησης και / ή σπασμούς και μπορεί να οδηγήσει σε προσωρινή ή μόνιμη βλάβη της εγκεφαλικής λειτουργίας ή του θανάτου. Σοβαρή υπογλυκαιμία που απαιτεί τη βοήθεια άλλου προσώπου και / ή παρεντερική έγχυση γλυκόζης ή η χορήγηση γλυκαγόνης έχει παρατηρηθεί σε κλινικές δοκιμές με ινσουλίνη, συμπεριλαμβανομένων δοκιμασιών με NovoLog.
Ο χρονισμός της υπογλυκαιμίας συνήθως αντανακλά το προφίλ χρονικής δράσης των χορηγούμενων συνθέσεων ινσουλίνης [βλέπε Clincal Pharmacology]. Άλλοι παράγοντες όπως οι αλλαγές στην πρόσληψη τροφής (π.χ. ποσότητα τροφής ή χρονική στιγμή γευμάτων), σημείο ένεσης, άσκηση και ταυτόχρονα φάρμακα μπορεί επίσης να μεταβάλλουν τον κίνδυνο υπογλυκαιμίας [βλ. Αλληλεπιδράσεις με άλλα φάρμακα]. Όπως και με όλες τις ινσουλίνες, πρέπει να είστε προσεκτικοί σε ασθενείς με άγνοια της υπογλυκαιμίας και σε ασθενείς που μπορεί να είναι προδιατεθειμένοι στην υπογλυκαιμία (π.χ. ασθενείς που έχουν νηστεία ή έχουν ασταθή πρόσληψη τροφής). Η ικανότητα του ασθενούς να συγκεντρωθεί και να αντιδράσει μπορεί να επηρεαστεί ως αποτέλεσμα της υπογλυκαιμίας. Αυτό μπορεί να παρουσιάσει κίνδυνο σε καταστάσεις όπου αυτές οι ικανότητες είναι ιδιαίτερα σημαντικές, όπως η οδήγηση ή η λειτουργία άλλων μηχανημάτων.
Οι γρήγορες αλλαγές στα επίπεδα γλυκόζης στον ορό μπορεί να προκαλέσουν συμπτώματα υπογλυκαιμίας σε άτομα με διαβήτη, ανεξάρτητα από την τιμή γλυκόζης. Τα πρόδρομα προειδοποιητικά συμπτώματα της υπογλυκαιμίας μπορεί να είναι διαφορετικά ή λιγότερο έντονα υπό ορισμένες συνθήκες, όπως π.χ. μακροχρόνιο διαβήτη, ασθένεια διαβητικού νεύρου, χρήση φαρμάκων όπως βήτα-αναστολείς ή εντατικοποιημένο διαβήτη ελέγχου [βλ Αλληλεπιδράσεις με άλλα φάρμακα]. Αυτές οι καταστάσεις μπορεί να οδηγήσουν σε σοβαρή υπογλυκαιμία (και, ενδεχομένως, απώλεια συνείδησης) πριν από την ευαισθητοποίηση του ασθενούς για υπογλυκαιμία. Η ενδοφλέβια χορηγούμενη ινσουλίνη έχει ταχύτερη έναρξη της δράσης από την υποδόρια χορηγούμενη ινσουλίνη, απαιτώντας πιο στενή παρακολούθηση για την υπογλυκαιμία.
Υποκαλιαιμία
Όλα τα προϊόντα ινσουλίνης, συμπεριλαμβανομένου του NovoLog, προκαλούν μετατόπιση του καλίου από τον εξωκυτταρικό σε ενδοκυτταρικό χώρο, ενδεχομένως να οδηγήσει σε υποκαλιαιμία που, εάν αφεθεί χωρίς θεραπεία, μπορεί να προκαλέσει αναπνευστική παράλυση, κοιλιακή αρρυθμία και θάνατος. Να είστε προσεκτικοί σε ασθενείς που ενδέχεται να διατρέχουν κίνδυνο υποκαλιαιμίας (π.χ. ασθενείς που χρησιμοποιούν φάρμακα μείωσης του καλίου, ασθενείς λαμβάνοντας φάρμακα ευαίσθητα στις συγκεντρώσεις καλίου στον ορό και στους ασθενείς που έλαβαν ενδοφλέβια χορήγηση ινσουλίνη).
Νεφρική δυσλειτουργία
Όπως και με άλλες ινσουλίνες, οι απαιτήσεις δόσης για το NovoLog μπορεί να μειωθούν σε ασθενείς με νεφρική δυσλειτουργία [βλ Κλινική Φαρμακολογία].
Ηπατική ανεπάρκεια
Όπως και με άλλες ινσουλίνες, οι απαιτήσεις δόσης για το NovoLog μπορεί να μειωθούν σε ασθενείς με ηπατική δυσλειτουργία [βλ Κλινική Φαρμακολογία].
Υπερευαισθησία και αλλεργικές αντιδράσεις
Τοπικές αντιδράσεις - Όπως και με άλλη θεραπεία με ινσουλίνη, οι ασθενείς μπορεί να εμφανίσουν ερυθρότητα, οίδημα ή φαγούρα στο σημείο της ένεσης του NovoLog. Αυτές οι αντιδράσεις συνήθως λύνονται σε λίγες μέρες έως μερικές εβδομάδες, αλλά σε ορισμένες περιπτώσεις μπορεί να απαιτούν τη διακοπή του NovoLog. Σε ορισμένες περιπτώσεις, αυτές οι αντιδράσεις μπορεί να σχετίζονται με άλλους παράγοντες εκτός από την ινσουλίνη, όπως ερεθιστικά μέσα σε ένα μέσο καθαρισμού του δέρματος ή με κακή τεχνική ένεσης. Οι τοπικές αντιδράσεις και οι γενικευμένες μυαλγίες έχουν αναφερθεί με την ενέσιμη μετακρεσόλη, η οποία είναι ένα έκδοχο στο NovoLog.
Συστηματικές αντιδράσεις - Μπορεί να εμφανιστεί σοβαρή, απειλητική για τη ζωή, γενικευμένη αλλεργία, συμπεριλαμβανομένης αναφυλαξίας, με οποιοδήποτε προϊόν ινσουλίνης, συμπεριλαμβανομένου του NovoLog. Οι αναφυλακτικές αντιδράσεις με το NovoLog έχουν αναφερθεί μετά την έγκριση. Η γενικευμένη αλλεργία στην ινσουλίνη μπορεί επίσης να προκαλέσει εξάνθημα ολόκληρου του σώματος (συμπεριλαμβανομένου του κνησμού), δύσπνοια, συριγμό, υπόταση, ταχυκαρδία ή διαφωτισμό. Σε ελεγχόμενες κλινικές δοκιμές, αναφέρθηκαν αλλεργικές αντιδράσεις σε 3 από τους 735 ασθενείς (0,4%) που έλαβαν κανονική ινσουλίνη και 10 στους 1394 ασθενείς (0,7%) που έλαβαν NovoLog. Σε ελεγχόμενες και ανεξέλεγκτες κλινικές δοκιμές, 3 από τους 2341 (0,1%) ασθενείς που έλαβαν NovoLog διέκοψαν λόγω αλλεργικών αντιδράσεων.
Παραγωγή αντισωμάτων
Αυξήσεις των τίτλων αντισωμάτων κατά της ινσουλίνης που αντιδρούν με ανθρώπινη ινσουλίνη και ασπαρτική ινσουλίνη έχουν παρατηρηθεί σε ασθενείς που έλαβαν NovoLog. Αυξήσεις των αντισωμάτων κατά της ινσουλίνης παρατηρούνται συχνότερα με το NovoLog από ότι με την κανονική ανθρώπινη ινσουλίνη. Δεδομένα από ελεγχόμενη μελέτη 12 μηνών σε ασθενείς με διαβήτη τύπου 1 υποδηλώνουν ότι η αύξηση αυτών των αντισωμάτων είναι παροδική και οι διαφορές σε επίπεδα αντισωμάτων μεταξύ των ομάδων θεραπείας κανονικής ανθρώπινης ινσουλίνης και ασπαρτικής ινσουλίνης που παρατηρήθηκαν στους 3 και 6 μήνες δεν ήταν πλέον εμφανείς στις 12 μήνες. Η κλινική σημασία αυτών των αντισωμάτων δεν είναι γνωστή. Αυτά τα αντισώματα δεν φαίνεται να προκαλούν επιδείνωση του γλυκαιμικού ελέγχου ή να απαιτούν αύξηση της δόσης ινσουλίνης.
Μίξη ινσουλινών
- Η ανάμειξη του NovoLog με την ανθρώπινη ινσουλίνη NPH αμέσως πριν από την ένεση εξασθενίζει τη μέγιστη συγκέντρωση του NovoLog, χωρίς να επηρεάζεται σημαντικά ο χρόνος μέχρι τη μέγιστη συγκέντρωση ή τη συνολική βιοδιαθεσιμότητα του NovoLog. Εάν το NovoLog αναμειχθεί με την ανθρώπινη ινσουλίνη NPH, το NovoLog θα πρέπει πρώτα να τραβηχτεί στη σύριγγα και το μείγμα θα πρέπει να εγχυθεί αμέσως μετά την ανάμειξη.
- Η αποτελεσματικότητα και η ασφάλεια της ανάμειξης του NovoLog με παρασκευάσματα ινσουλίνης που παράγονται από άλλους κατασκευαστές δεν έχουν μελετηθεί.
- Τα μίγματα ινσουλίνης δεν πρέπει να χορηγούνται ενδοφλεβίως.
Συνεχής υποδόρια έγχυση ινσουλίνης από εξωτερική αντλία
Όταν χρησιμοποιείται σε εξωτερική υποδόρια αντλία έγχυσης ινσουλίνης, το NovoLog δεν πρέπει να αναμειγνύεται με καμία άλλη ινσουλίνη ή αραιωτικό. Όταν χρησιμοποιείτε το NovoLog σε εξωτερική αντλία ινσουλίνης, θα πρέπει να ακολουθούνται οι συγκεκριμένες πληροφορίες του NovoLog (π.χ. χρόνος χρήσης, συχνότητα αλλαγής των συνόλων έγχυσης) επειδή οι πληροφορίες που αφορούν ειδικά το NovoLog ενδέχεται να διαφέρουν από το γενικό εγχειρίδιο αντλίας οδηγίες.
Ανεπιθύμητες ενδείξεις δυσλειτουργίας ή αποικοδόμησης ινσουλίνης μπορεί να οδηγήσουν σε ταχεία εμφάνιση υπεργλυκαιμίας και κέτωσης εξαιτίας της μικρής υποδόριας αποθήκης ινσουλίνης. Αυτό είναι ιδιαίτερα σημαντικό για τα ανάλογα ινσουλίνης ταχείας δράσης που απορροφώνται ταχύτερα μέσω του δέρματος και έχουν μικρότερη διάρκεια δράσης. Είναι απαραίτητη η ταχεία αναγνώριση και διόρθωση της αιτίας της υπεργλυκαιμίας ή της κέτωσης. Μπορεί να απαιτείται προσωρινή θεραπεία με υποδόρια ένεση [βλ Δοσολογία και χορήγηση, Προειδοποιήσεις και προφυλάξεις, και Πώς παρέχεται / αποθήκευση και χειρισμός].
Το NovoLog συνιστάται για χρήση σε συστήματα αντλίας κατάλληλα για έγχυση ινσουλίνης όπως αναφέρεται παρακάτω.
Γοβάκια:
Σειρά MiniMed 500 και άλλες ισοδύναμες αντλίες.
Δεξαμενές και σύνολα έγχυσης:
Το NovoLog συνιστάται για χρήση σε δοχεία δεξαμενής και έγχυσης που είναι συμβατά με την ινσουλίνη και τη συγκεκριμένη αντλία. Οι μελέτες in-vitro έχουν δείξει ότι η δυσλειτουργία της αντλίας, η απώλεια μετακρεσόλης και η υποβάθμιση της ινσουλίνης μπορεί να εμφανιστούν όταν το NovoLog διατηρείται σε σύστημα αντλίας για περισσότερο από 48 ώρες. Οι δεξαμενές και τα σετ έγχυσης πρέπει να αλλάζονται τουλάχιστον κάθε 48 ώρες.
Το NovoLog δεν πρέπει να εκτίθεται σε θερμοκρασίες μεγαλύτερες από 37 ° C (98,6 ° F). Το NovoLog που πρόκειται να χρησιμοποιηθεί σε αντλία δεν πρέπει να αναμιγνύεται με άλλη ινσουλίνη ή με αραιωτικό [βλέπε Δοσολογία και χορήγηση, Προειδοποιήσεις και προφυλάξεις, και Πώς παρέχεται / αποθήκευση και χειρισμός].
μπλουζα
Ανεπιθύμητες ενέργειες
Κλινική δοκιμαστική εμπειρία
Επειδή οι κλινικές δοκιμές διεξάγονται με ευρέως διαφορετικά σχέδια, τα ποσοστά ανεπιθύμητων αντιδράσεων που αναφέρθηκαν σε μία κλινική δοκιμή μπορεί να μην είναι να συγκρίνονται εύκολα με τα ποσοστά που αναφέρονται σε άλλη κλινική δοκιμή και ενδέχεται να μην αντικατοπτρίζουν τους ρυθμούς που παρατηρούνται στην κλινική πράξη πρακτική.
- Υπογλυκαιμία
Η υπογλυκαιμία είναι η συχνότερα παρατηρηθείσα ανεπιθύμητη ενέργεια σε ασθενείς που χρησιμοποιούν ινσουλίνη, συμπεριλαμβανομένου του NovoLog [βλ Προειδοποιήσεις και προφυλάξεις].
- Ενάρρωση ινσουλίνης και εντατικοποίηση ελέγχου γλυκόζης
Η εντατικοποίηση ή η ταχεία βελτίωση του ελέγχου της γλυκόζης έχει συσχετιστεί με μια μεταβατική, αναστρέψιμη οφθαλμολογική διαθλαστική διαταραχή, επιδείνωση της διαβητικής αμφιβληστροειδοπάθειας και οξεία επώδυνη περιφερική νευροπόθεια. Ωστόσο, ο μακροχρόνιος γλυκαιμικός έλεγχος μειώνει τον κίνδυνο διαβητικής αμφιβληστροειδοπάθειας και νευροπάθειας.
- Λιποδυστροφία
Η μακροχρόνια χρήση ινσουλίνης, συμπεριλαμβανομένου του NovoLog, μπορεί να προκαλέσει λιποδυστροφία στη θέση επαναλαμβανόμενων ενέσεων ή έγχυσης ινσουλίνης. Η λιποδυστροφία περιλαμβάνει λιποϋπερτροφία (πάχυνση του λιπώδους ιστού) και λιποατροφία (αραίωση λιπώδους ιστού) και μπορεί να επηρεάσει την απορρόφηση της ινσουλίνης. Περιστρέψτε τις θέσεις έγχυσης ή έγχυσης ινσουλίνης στην ίδια περιοχή για να μειώσετε τον κίνδυνο λιποδυστροφίας.
- Αύξηση βάρους
Η αύξηση σωματικού βάρους μπορεί να συμβεί με ορισμένες θεραπείες ινσουλίνης, συμπεριλαμβανομένου του NovoLog, και έχει αποδοθεί στις αναβολικές επιδράσεις της ινσουλίνης και στη μείωση της γλυκοζουρίας.
- Περιφερικό οίδημα
Η ινσουλίνη μπορεί να προκαλέσει κατακράτηση νατρίου και οίδημα, ιδιαίτερα εάν βελτιωθεί προηγουμένως ο μεταβολικός έλεγχος με εντατική θεραπεία ινσουλίνης.
- Συχνότητες ανεπιθύμητων ενεργειών
Οι συχνότητες των ανεπιθύμητων ενεργειών κατά τη διάρκεια των κλινικών μελετών NovoLog σε ασθενείς με σακχαρώδη διαβήτη τύπου 1 και σακχαρώδη διαβήτη τύπου 2 παρατίθενται στους παρακάτω πίνακες.
Πίνακας 1: Εμφανισμένα ανεπιθύμητα συμβάματα σε ασθενείς με σακχαρώδη διαβήτη τύπου 1 (Ανεπιθύμητες ενέργειες με συχνότητα ≥ 5% και συμβαίνουν συχνότερα με το NovoLog σε σύγκριση με την ανθρώπινη τακτική ινσουλίνη απαριθμούνται)
|
NovoLog + NPH Ν = 596 |
Ανθρώπινη τακτική ινσουλίνη + NPH Ν = 286 |
|||
| Προτιμώμενος όρος | Ν | (%) | Ν | (%) |
| Υπογλυκαιμία * | 448 | 75% | 205 | 72% |
| Πονοκέφαλο | 70 | 12% | 28 | 10% |
| Τραυματισμός τυχαία | 65 | 11% | 29 | 10% |
| Ναυτία | 43 | 7% | 13 | 5% |
| Διάρροια | 28 | 5% | 9 | 3% |
* Η υπογλυκαιμία ορίζεται ως ένα επεισόδιο συγκέντρωσης γλυκόζης στο αίμα
Πίνακας 2: Εμφανή ανεπιθύμητα συμβάματα θεραπείας σε ασθενείς με σακχαρώδη διαβήτη τύπου 2 (εκτός από την υπογλυκαιμία, ανεπιθύμητες ενέργειες με συχνότητα ≥ 5% και συχνότερα εμφανίζονται με το NovoLog σε σύγκριση με την κανονική ανθρώπινη ινσουλίνη απαριθμούνται)
|
NovoLog + NPH Ν = 91 |
Ανθρώπινη τακτική ινσουλίνη + NPH Ν = 91 |
|||
| Ν | (%) | Ν | (%) | |
| Υπογλυκαιμία * | 25 | 27% | 33 | 36% |
| Υπερεφλεξία | 10 | 11% | 6 | 7% |
| Ονυχομυκητίαση | 9 | 10% | 5 | 5% |
| Αισθητική διαταραχή | 8 | 9% | 6 | 7% |
| Λοίμωξη του ουροποιητικού συστήματος | 7 | 8% | 6 | 7% |
| Πόνος στο στήθος | 5 | 5% | 3 | 3% |
| Πονοκέφαλο | 5 | 5% | 3 | 3% |
| Διαταραχή του δέρματος | 5 | 5% | 2 | 2% |
| Κοιλιακός πόνος | 5 | 5% | 1 | 1% |
| Ιγμορίτιδα | 5 | 5% | 1 | 1% |
* Η υπογλυκαιμία ορίζεται ως ένα επεισόδιο συγκέντρωσης γλυκόζης στο αίμα
Δεδομένα μετά τη διάθεση στην αγορά
Οι ακόλουθες επιπρόσθετες ανεπιθύμητες ενέργειες εντοπίστηκαν κατά τη διάρκεια της χρήσης NovoLog μετά τη χορήγηση. Επειδή αυτές οι ανεπιθύμητες ενέργειες αναφέρθηκαν οικειοθελώς από πληθυσμό αβέβαιου μεγέθους, δεν είναι γενικά δυνατή η αξιόπιστη εκτίμηση της συχνότητας τους. Σφάλματα φαρμακευτικής αγωγής στα οποία άλλα ινσουλίνες έχουν αντικατασταθεί τυχαία από το NovoLog έχουν ταυτοποιηθεί κατά τη διάρκεια της χρήσης μετά την έγκριση.
μπλουζα
Αλληλεπιδράσεις με άλλα φάρμακα
Ορισμένες ουσίες επηρεάζουν τον μεταβολισμό της γλυκόζης και μπορεί να απαιτούν προσαρμογή της δόσης ινσουλίνης και ιδιαίτερα στενή παρακολούθηση.
- Τα παρακάτω είναι παραδείγματα ουσιών που μπορούν να αυξήσουν την επίδραση μείωσης της γλυκόζης αίματος και ευαισθησία στην υπογλυκαιμία: από του στόματος αντιδιαβητικά προϊόντα, πραλλιντίδη, ACE αναστολείς δισοπυραμιδίου, φιβράτες, φλουοξετίνη, αναστολείς μονοαμινοξειδάσης (ΜΑΟ), προποξυφαίνη, σαλικυλικά, ανάλογα σωματοστατίνης (π.χ. οκτρεοτίδιο), σουλφοναμίδιο αντιβιοτικά.
- Τα ακόλουθα είναι παραδείγματα ουσιών που μπορούν να μειώσουν την επίδραση μείωσης της γλυκόζης στο αίμα: κορτικοστεροειδή, νιασίνη, δαναζόλη, διουρητικά, συμπαθητικομιμητικά μέσα (π.χ., επινεφρίνη, σαλβουταμόλη, τερβουταλίνη), ισονιαζίδη, παράγωγα φαινοθειαζίνης, σωματοτροπίνη, ορμόνες θυρεοειδούς, οιστρογόνα, προγεστογόνα (π.χ., από του στόματος αντισυλληπτικά), άτυπη αντιψυχωσικά.
- Οι β-αναστολείς, η κλονιδίνη, τα άλατα λιθίου και η αλκοόλη μπορούν είτε να ενισχύσουν είτε να αποδυναμώσουν την επίδραση της ινσουλίνης στη μείωση της γλυκόζης στο αίμα.
- Η πενταμιδίνη μπορεί να προκαλέσει υπογλυκαιμία, η οποία μπορεί μερικές φορές να ακολουθείται από υπεργλυκαιμία.
- Τα σημάδια της υπογλυκαιμίας μπορεί να μειωθούν ή να απουσιάζουν σε ασθενείς που λαμβάνουν συμπαθολυτικά προϊόντα όπως βήτα-αναστολείς, κλονιδίνη, γουανετιδίνη και ρεσερπίνη.
μπλουζα
Χρήση σε συγκεκριμένους πληθυσμούς
Εγκυμοσύνη
Κατηγορία εγκυμοσύνης Β. Όλες οι εγκυμοσύνες παρουσιάζουν κίνδυνο για γενετικές ανωμαλίες, απώλεια ή άλλο ανεπιθύμητο αποτέλεσμα ανεξάρτητα από την έκθεση του φαρμάκου. Αυτός ο κίνδυνος υποβάθρου αυξάνεται στις κυήσεις που περιπλέκονται από την υπεργλυκαιμία και μπορεί να μειωθεί με καλό μεταβολικό έλεγχο. Είναι σημαντικό οι ασθενείς με διαβήτη ή ιστορικό διαβήτη κύησης να διατηρούν καλό μεταβολικό έλεγχο πριν από τη σύλληψη και κατά τη διάρκεια της εγκυμοσύνης. Οι ανάγκες σε ινσουλίνη ενδέχεται να μειωθούν κατά τη διάρκεια του πρώτου τριμήνου, γενικά να αυξηθούν κατά τη διάρκεια του δεύτερου και τρίτου τριμήνου και να μειωθούν γρήγορα μετά την παράδοση. Η προσεκτική παρακολούθηση του ελέγχου γλυκόζης είναι απαραίτητη σε αυτούς τους ασθενείς. Επομένως, οι γυναίκες ασθενείς θα πρέπει να ενημερώνονται για να ενημερώσουν το γιατρό τους εάν προτίθενται να γίνουν ή αν μείνουν έγκυες κατά τη λήψη του NovoLog.
Μια ανοιχτή, τυχαιοποιημένη μελέτη συνέκρινε την ασφάλεια και την αποτελεσματικότητα του NovoLog (n = 157) έναντι της κανονικής ανθρώπινης ινσουλίνης (n = 165) σε 322 έγκυες γυναίκες με διαβήτη τύπου 1. Τα δύο τρίτα των εγγεγραμμένων ασθενών ήταν ήδη έγκυοι όταν μπήκαν στη μελέτη. Επειδή μόνο το ένα τρίτο των ασθενών που συμμετείχαν πριν από τη σύλληψη, η μελέτη δεν ήταν αρκετά μεγάλη για να εκτιμήσει τον κίνδυνο συγγενών δυσμορφιών. Και οι δύο ομάδες πέτυχαν μέση HbA1c κατά ~ 6% κατά τη διάρκεια της εγκυμοσύνης και δεν υπήρξε σημαντική διαφορά στην επίπτωση της μητρικής υπογλυκαιμίας.
Έχουν διεξαχθεί μελέτες υποδόριας αναπαραγωγής και τερατολογίας με το NovoLog και τακτική ανθρώπινη ινσουλίνη σε αρουραίους και κουνέλια. Σε αυτές τις μελέτες, το NovoLog χορηγήθηκε σε θηλυκούς αρουραίους πριν από το ζευγάρωμα, κατά τη διάρκεια του ζευγαρώματος και κατά τη διάρκεια της εγκυμοσύνης και σε κουνέλια κατά τη διάρκεια της οργανογένεσης. Οι επιδράσεις του NovoLog δεν διέφεραν από εκείνες που παρατηρήθηκαν με την υποδόρια κανονική ανθρώπινη ινσουλίνη. Το NovoLog, όπως και η ανθρώπινη ινσουλίνη, προκάλεσε απώλειες πριν και μετά την εμφύτευση και σπλαχνικές / σκελετικές ανωμαλίες σε αρουραίους σε δόση 200 U / kg / ημέρα (περίπου 32 φορές την ανθρώπινη υποδόρια δόση 1,0 U / kg / ημέρα, με βάση την επιφάνεια U / σωματικού επιπέδου) και σε κουνέλια σε δόση 10 U / kg / ημέρα (περίπου τριπλάσια της ανθρώπινης υποδόριας δόσης 1,0 U / kg / επιφάνεια του σώματος περιοχή). Τα αποτελέσματα είναι πιθανώς δευτερογενή στη μητρική υπογλυκαιμία σε υψηλές δόσεις. Δεν παρατηρήθηκαν σημαντικά αποτελέσματα σε αρουραίους σε δόση 50 U / kg / ημέρα και σε κουνέλια σε δόση 3 U / kg / ημέρα. Αυτές οι δόσεις είναι περίπου 8 φορές η ανθρώπινη υποδόρια δόση 1,0 U / kg / ημέρα για τους αρουραίους και ισούται με την ανθρώπινη υποδόρια δόση 1,0 U / kg / ημέρα για τα κουνέλια, με βάση την επιφάνεια U / σωματικού βάρους.
Θηλάζουσες μητέρες
Δεν είναι γνωστό αν η ασπαρτική ινσουλίνη απεκκρίνεται στο ανθρώπινο γάλα. Η χρήση του NovoLog είναι συμβατή με το θηλασμό, αλλά οι γυναίκες με διαβήτη που θηλάζουν μπορεί να χρειαστούν προσαρμογές των δόσεων ινσουλίνης.
Παιδιατρική χρήση
Το NovoLog είναι εγκεκριμένο για χρήση σε παιδιά για υποδόριες καθημερινές ενέσεις και για υποδόρια συνεχή έγχυση με εξωτερική αντλία ινσουλίνης. Ανατρέξτε στην Ενότητα ΚΛΙΝΙΚΕΣ ΜΕΛΕΤΕΣ για περιλήψεις κλινικών μελετών.
Γηριατρική χρήση
Από τον συνολικό αριθμό των ασθενών (n = 1,375) που έλαβαν NovoLog σε 3 ελεγχόμενες κλινικές μελέτες, το 2,6% (n = 36) ήταν 65 ετών ή άνω. Οι μισοί από αυτούς τους ασθενείς είχαν διαβήτη τύπου 1 (18/1285) και το άλλο ήμισυ είχαν διαβήτη τύπου 2 (18/90). Η απόκριση HbA1c στο NovoLog, σε σύγκριση με την ανθρώπινη ινσουλίνη, δεν διέφερε ανάλογα με την ηλικία, ιδιαίτερα σε ασθενείς με διαβήτη τύπου 2. Επιπρόσθετες μελέτες σε μεγαλύτερους πληθυσμούς ασθενών ηλικίας 65 ετών και άνω χρειάζονται για να καταλήξουν σε συμπεράσματα σχετικά με την ασφάλεια του NovoLog σε ηλικιωμένους σε σύγκριση με τους νεότερους ασθενείς. Δεν έχουν πραγματοποιηθεί φαρμακοκινητικές / φαρμακοδυναμικές μελέτες για την εκτίμηση της επίδρασης της ηλικίας στην έναρξη της δράσης NovoLog.
μπλουζα
Υπερδοσολογία
Η υπερβολική χορήγηση ινσουλίνης μπορεί να προκαλέσει υπογλυκαιμία και, ιδιαίτερα όταν χορηγείται ενδοφλεβίως, υποκαλιαιμία. Τα ήπια επεισόδια υπογλυκαιμίας συνήθως μπορούν να αντιμετωπιστούν με στοματική γλυκόζη. Μπορεί να χρειαστούν προσαρμογές στη δοσολογία του φαρμάκου, στα γεύματα ή στην άσκηση. Τα σοβαρότερα επεισόδια με κώμα, κρίση ή νευρολογική ανεπάρκεια μπορούν να αντιμετωπιστούν με ενδομυϊκή / υποδόρια γλυκαγόνη ή με συμπυκνωμένη ενδοφλέβια γλυκόζη. Η παρατεταμένη λήψη και παρακολούθηση υδατανθράκων μπορεί να είναι απαραίτητη επειδή η υπογλυκαιμία μπορεί να εμφανιστεί μετά από εμφανή κλινική ανάκαμψη. Η υποκαλιαιμία πρέπει να διορθωθεί κατάλληλα.
μπλουζα
Περιγραφή
Το NovoLog (ένεση ασπαρτικής ινσουλίνης [rDNA προέλευσης]) είναι ένα ανάλογο ανθρώπινης ινσουλίνης ταχείας δράσης που χρησιμοποιείται για τη μείωση της γλυκόζης στο αίμα. Το NovoLog είναι ομόλογο με την κανονική ανθρώπινη ινσουλίνη, με την εξαίρεση μίας μόνο υποκατάστασης της προλίνης αμινοξέος ασπαρτικό οξύ στη θέση Β28 και παράγεται με τεχνολογία ανασυνδυασμένου DNA χρησιμοποιώντας Saccharomyces cerevisiae μαγιά). Η ινσουλίνη aspart έχει τον εμπειρικό τύπο C256H381Ν65079μικρό6 και ένα μοριακό βάρος 5825,8.
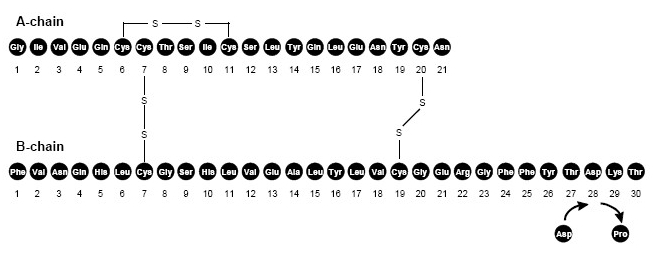
Φιγούρα 1. Δομικός τύπος ασπαρτικής ινσουλίνης.
Το NovoLog είναι ένα αποστειρωμένο, υδατικό, διαυγές και άχρωμο διάλυμα που περιέχει ινσουλίνη ασπαρτική 100 μονάδες / mL, γλυκερίνη 16 mg / mL, φαινόλη 1,50 mg / mL, μετακρεσόλη 1,72 mg / mL, ψευδάργυρος 19,6 mcg / mL, διένυδρο όξινο φωσφορικό δινάτριο 1,25 mg / mL και χλωριούχο νάτριο 0,58 mg / mL. Το NovoLog έχει ρΗ 7,2-7,6. Για τη ρύθμιση του pH μπορεί να προστεθεί υδροχλωρικό οξύ 10% και / ή υδροξείδιο του νατρίου 10%.
μπλουζα
Κλινική Φαρμακολογία
Μηχανισμός δράσης
Η κύρια δραστηριότητα του NovoLog είναι η ρύθμιση του μεταβολισμού της γλυκόζης. Οι ινσουλίνες, συμπεριλαμβανομένου του NovoLog, δεσμεύονται στους υποδοχείς ινσουλίνης στα μυϊκά και λιπώδη κύτταρα και μειώνουν τη γλυκόζη στο αίμα διευκολύνοντας την κυτταρική πρόσληψη γλυκόζης και ταυτόχρονα αναστέλλοντας την έξοδο της γλυκόζης από την γλυκόζη συκώτι.
Φαρμακοδυναμική
Μελέτες σε φυσιολογικούς εθελοντές και ασθενείς με διαβήτη έδειξαν ότι η υποδόρια χορήγηση του NovoLog έχει ταχύτερη έναρξη της δράσης από την κανονική ανθρώπινη ινσουλίνη.
Σε μια μελέτη σε ασθενείς με διαβήτη τύπου 1 (n = 22), το μέγιστο αποτέλεσμα μείωσης της γλυκόζης του NovoLog εμφανίστηκε μεταξύ 1 και 3 ωρών μετά την υποδόρια ένεση (βλ. Εικόνα 2). Η διάρκεια της δράσης για το NovoLog είναι 3 έως 5 ώρες. Η χρονική διάρκεια δράσης της ινσουλίνης και των αναλόγων ινσουλίνης όπως το NovoLog μπορεί να ποικίλει σημαντικά στα διάφορα άτομα ή στο ίδιο άτομο. Οι παράμετροι της δραστηριότητας του NovoLog (χρόνος έναρξης, χρόνος και διάρκεια αιχμής) όπως ορίζονται στο σχήμα 2 θα πρέπει να θεωρούνται μόνο ως γενικές οδηγίες. Ο ρυθμός απορρόφησης της ινσουλίνης και η έναρξη της δραστηριότητας επηρεάζεται από το σημείο της ένεσης, της άσκησης και άλλων μεταβλητών [βλ Προειδοποιήσεις και προφυλάξεις].
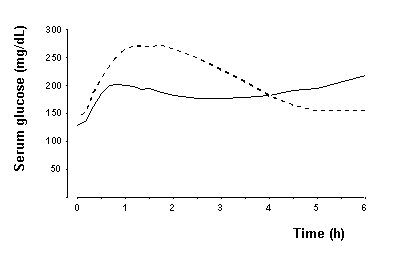
Σχήμα 2. Σειριακή μέση γλυκόζη ορού που συλλέχθηκε έως 6 ώρες μετά από μία δόση NovoLog πριν από το γεύμα (στερεή καμπύλη) ή κανονική ανθρώπινη ινσουλίνη (γραμμοσκιασμένη καμπύλη) που εγχύθηκε αμέσως πριν από το γεύμα σε 22 ασθενείς με τύπο 1 Διαβήτης.
Μια διπλή-τυφλή, τυχαιοποιημένη, αμφίδρομη μελέτη διασταύρωσης σε 16 ασθενείς με διαβήτη τύπου 1 έδειξε ότι είναι ενδοφλέβια η έγχυση του NovoLog είχε ως αποτέλεσμα ένα προφίλ γλυκόζης στο αίμα παρόμοιο με αυτό μετά από ενδοφλέβια έγχυση με κανονικό άνθρωπο ινσουλίνη. Το NovoLog ή η ανθρώπινη ινσουλίνη εγχύθηκε μέχρις ότου η γλυκόζη αίματος του ασθενούς μειωθεί στα 36 mg / dL ή έως ότου ο ασθενής έδειξε σημάδια υπογλυκαιμίας (αύξηση του καρδιακού ρυθμού και εμφάνιση εφίδρωσης), που ορίζεται ως ο χρόνος της αυτόνομης αντίδρασης (R) (βλέπε σχήμα 3).
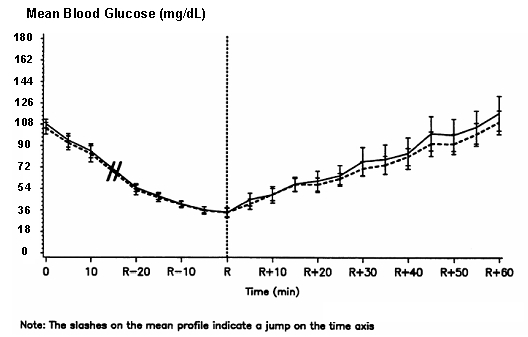
Σχήμα 3. Σειριακή μέση γλυκόζη ορού μετά από ενδοφλέβια έγχυση NovoLog (καμπύλη εκσκαφής) και κανονική ανθρώπινη ινσουλίνη (συμπαγής καμπύλη) σε 16 ασθενείς με διαβήτη τύπου 1. Το R αντιπροσωπεύει τον χρόνο της αυτόνομης αντίδρασης.
Φαρμακοκινητική
Η μόνη υποκατάσταση της προλίνης αμινοξέος με ασπαρτικό οξύ στη θέση Β28 στο NovoLog μειώνει την τάση του μορίου να σχηματίζει εξαμερή όπως παρατηρήθηκε με την κανονική ανθρώπινη ινσουλίνη. Συνεπώς, το NovoLog απορροφάται ταχύτερα μετά από υποδόρια ένεση σε σύγκριση με την κανονική ανθρώπινη ινσουλίνη.
Σε μια τυχαιοποιημένη, διπλή-τυφλή, διασταύρωση μελέτη 17 υγιείς καυκάσιοι άντρες μεταξύ 18 και 40 ετών ηλικίας έλαβε ενδοφλέβια έγχυση είτε του NovoLog είτε της κανονικής ανθρώπινης ινσουλίνης στα 1,5 mU / kg / min για 120 λεπτά. Η μέση κάθαρση ινσουλίνης ήταν παρόμοια για τις δύο ομάδες με μέσες τιμές 1,2 l / h / kg για την ομάδα NovoLog και 1,2 l / h / kg για την κανονική ομάδα ανθρώπινης ινσουλίνης.
Βιοδιαθεσιμότητα και απορρόφηση - Το NovoLog έχει ταχύτερη απορρόφηση, ταχύτερη έναρξη δράσης και α μικρότερη διάρκεια δράσης από την κανονική ανθρώπινη ινσουλίνη μετά από υποδόρια ένεση (βλ. Σχήματα 2 και 3) Σχήμα 4). Η σχετική βιοδιαθεσιμότητα του NovoLog σε σύγκριση με την κανονική ανθρώπινη ινσουλίνη δείχνει ότι οι δύο ινσουλίνες απορροφώνται σε παρόμοια έκταση.
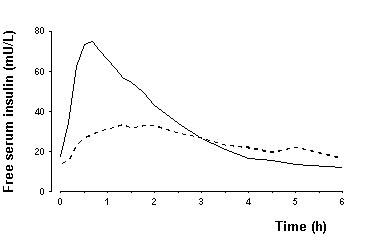
Σχήμα 4. Σειριακή μέση συγκέντρωση ινσουλίνης χωρίς ορό συλλέχθηκε έως 6 ώρες μετά από μία δόση NovoLog πριν από το γεύμα (συμπαγής καμπύλη) ή κανονική ανθρώπινη ινσουλίνη (καμπύλη εκσκαφής) που εγχύθηκε αμέσως πριν από το γεύμα σε 22 ασθενείς με τύπο 1 Διαβήτης.
Σε μελέτες σε υγιείς εθελοντές (συνολικά n = 107) και σε ασθενείς με διαβήτη τύπου 1 (σύνολο n = 40), Το NovoLog έφθασε σταθερά στις μέγιστες συγκεντρώσεις στον ορό περίπου δύο φορές πιο γρήγορα από τον κανονικό άνθρωπο ινσουλίνη. Ο μέσος χρόνος έως τη μέγιστη συγκέντρωση σε αυτές τις δοκιμές ήταν 40 έως 50 λεπτά για το NovoLog έναντι 80 έως 120 λεπτών για την κανονική ανθρώπινη ινσουλίνη. Σε κλινική δοκιμή σε ασθενείς με διαβήτη τύπου 1, NovoLog και τακτική ανθρώπινη ινσουλίνη, και οι δύο χορηγήθηκαν υποδόρια σε δόση 0,15 U / kg σωματικού βάρους, έφθασε στις μέσες μέγιστες συγκεντρώσεις των 82 και 36 mU / L, αντίστοιχα. Τα φαρμακοκινητικά / φαρμακοδυναμικά χαρακτηριστικά της ινσουλίνης aspart δεν έχουν τεκμηριωθεί σε ασθενείς με διαβήτη τύπου 2.
Η ενδο-ατομική μεταβλητότητα του χρόνου έως τη μέγιστη συγκέντρωση ινσουλίνης στον ορό για υγιείς άνδρες εθελοντές ήταν σημαντικά μικρότερη για το NovoLog από ότι για την κανονική ανθρώπινη ινσουλίνη. Η κλινική σημασία αυτής της παρατήρησης δεν έχει τεκμηριωθεί.
Σε μια κλινική μελέτη σε υγιή μη παχύσαρκα άτομα, οι φαρμακοκινητικές διαφορές μεταξύ του NovoLog και του κανονικού ανθρώπινη ινσουλίνη που περιγράφηκε παραπάνω, παρατηρήθηκαν ανεξάρτητα από τη θέση της ένεσης (κοιλιακή χώρα, μηρός ή άνω μπράτσο).
Κατανομή και εξάλειψη - Το NovoLog έχει χαμηλή δέσμευση σε πρωτεΐνες πλάσματος (<10%), παρόμοια με αυτή που παρατηρείται με την κανονική ανθρώπινη ινσουλίνη. Μετά την υποδόρια χορήγηση σε φυσιολογικούς άνδρες εθελοντές (n = 24), το NovoLog εξαλείφθηκε ταχύτερα από το κανονική ανθρώπινη ινσουλίνη με μέσο όρο ημιζωής 81 λεπτών σε σύγκριση με 141 λεπτά για κανονικό άνθρωπο ινσουλίνη.
Ειδικοί Πληθυσμοί
Παιδιά και έφηβοι - Αξιολογήθηκαν οι φαρμακοκινητικές και φαρμακοδυναμικές ιδιότητες του NovoLog και της κανονικής ανθρώπινης ινσουλίνης σε μία εφάπαξ μελέτη σε 18 παιδιά (6-12 ετών, n = 9) και εφήβους (13-17 ετών [βαθμός Tanner> 2], n = 9) με τον τύπο 1 Διαβήτης. Οι σχετικές διαφορές στη φαρμακοκινητική και τη φαρμακοδυναμική σε παιδιά και εφήβους με διαβήτη τύπου 1 μεταξύ του NovoLog και της κανονικής ανθρώπινης ινσουλίνης ήταν παρόμοιες με αυτές σε υγιή ενήλικα άτομα και ενήλικες με τύπο 1 Διαβήτης.
Φύλο - Σε υγιείς εθελοντές, δεν παρατηρήθηκε διαφορά στα επίπεδα ινσουλίνης aspart μεταξύ ανδρών και γυναικών όταν ελήφθησαν υπόψη οι διαφορές σωματικού βάρους. Δεν παρατηρήθηκε σημαντική διαφορά στην αποτελεσματικότητα που παρατηρήθηκε (όπως εκτιμήθηκε με HbAlc) μεταξύ των φύλων σε μία δοκιμασία σε ασθενείς με διαβήτη τύπου 1.
Παχυσαρκία - Σε μία μελέτη 23 ασθενών με σακχαρώδη διαβήτη τύπου 1 και ευρέος φάσματος δείκτη μάζας σώματος (BMI, 22-39 kg / m2) χορηγήθηκε μία μόνο υποδόρια δόση 0,1 U / kg NovoLog. Οι φαρμακοκινητικές παράμετροι, AUC και Cmax, του NovoLog ήταν γενικά ανεπηρέαστες από το BMI στις διάφορες ομάδες - BMI 19-23 kg / m2 (N = 4). ΒΜΙ 23-27 kg / m2 (Ν = 7). ΒΜΙ 27-32 kg / m2 (Ν = 6) και ΒΜΙ> 32 kg / m2 (Ν = 6). Η κάθαρση του NovoLog μειώθηκε κατά 28% σε ασθενείς με ΒΜΙ> 32 kg / m2 σε σύγκριση με ασθενείς με ΔΜΣ
Νεφρική δυσλειτουργία - Ορισμένες μελέτες με ανθρώπινη ινσουλίνη έχουν δείξει αυξημένα επίπεδα κυκλοφορίας ινσουλίνης σε ασθενείς με νεφρική ανεπάρκεια. Μία υποδόρια δόση 0,08 U / kg NovoLog χορηγήθηκε σε μια μελέτη σε άτομα με φυσιολογική κάθαρση κρεατινίνης (CLcr) (> 80 ml / min) ή ήπια (N = 7; CLcr = 50-80 ml / λεπτό), μέτρια (Ν = 3; CLcr = 30-50 ml / λεπτό) ή σοβαρή (χωρίς όμως αιμοδιύλιση) (N = 2; CLcr = Προειδοποιήσεις και Προφυλάξεις].
Ηπατική βλάβη - Ορισμένες μελέτες με ανθρώπινη ινσουλίνη έδειξαν αυξημένα επίπεδα κυκλοφορίας ινσουλίνης σε ασθενείς με ηπατική ανεπάρκεια. Μία απλή υποδόρια δόση 0,06 U / kg NovoLog χορηγήθηκε σε μια ανοιχτή μελέτη μιας δόσης 24 ασθενών (N = 6 / ομάδα) με διαφορετικές δόσεις βαθμού ηπατικής δυσλειτουργίας (ήπια, μέτρια και σοβαρή) που έχουν βαθμολογίες Child-Pugh που κυμαίνονται από 0 (υγιείς εθελοντές) έως 12 (σοβαρή ηπατική βλάβη). Σε αυτή τη μικρή μελέτη, δεν υπήρξε συσχέτιση μεταξύ του βαθμού ηπατικής ανεπάρκειας και οποιασδήποτε φαρμακοκινητικής παράμετρος του NovoLog. Η προσεκτική παρακολούθηση της γλυκόζης και η προσαρμογή της δόσης της ινσουλίνης, συμπεριλαμβανομένου του NovoLog, μπορεί να είναι απαραίτητες σε ασθενείς με ηπατική δυσλειτουργία [βλ. Προειδοποιήσεις και προφυλάξεις].
Δεν έχει μελετηθεί η επίδραση της ηλικίας, της εθνικής προέλευσης, της εγκυμοσύνης και του καπνίσματος στη φαρμακοκινητική και τη φαρμακοδυναμική του NovoLog.
μπλουζα
Μη κλινική τοξικολογία
Καρκινογένεση, μεταλλαξιογένεση, βλάβη της γονιμότητας
Δεν έχουν διενεργηθεί 2ετές μελέτες καρκινογένεσης σε ζώα για την αξιολόγηση του καρκινογόνου δυναμικού του NovoLog. Σε μελέτες 52 εβδομάδων, αρουραίοι Sprague-Dawley χορηγήθηκαν υποδορίως με NovoLog στα 10, 50 και 200 U / kg / ημέρα (περίπου 2, 8 και 32 φορές την ανθρώπινη υποδόρια δόση 1,0 U / kg / ημέρα, με βάση την επιφάνεια U / σωματικού επιπέδου, αντίστοιχα). Σε δόση 200 U / kg / ημέρα, το NovoLog αύξησε την εμφάνιση όγκων μαστικού αδένα σε γυναίκες σε σύγκριση με τους μη υποβληθέντες σε αγωγή μάρτυρες. Η συχνότητα εμφάνισης όγκων μαστού για το NovoLog δεν ήταν σημαντικά διαφορετική από την κανονική ανθρώπινη ινσουλίνη. Η σημασία αυτών των ευρημάτων για τον άνθρωπο δεν είναι γνωστή. Το NovoLog δεν ήταν γονιδιοτοξικό στις ακόλουθες δοκιμασίες: Δοκιμή Ames, δοκιμασία μετάλλαξης κυττάρων λεμφώματος ποντικού, ανθρώπινη περιφερική δοκιμασία εκτροπής χρωμοσωμάτων λεμφοκυττάρων αίματος, ίη νίνο δοκιμή μικροπυρήνων σε ποντικούς και σε δοκιμασία ex νίνο UDS σε ήπαρ αρουραίου ηπατοκύτταρα. Σε μελέτες γονιμότητας σε αρσενικούς και θηλυκούς αρουραίους, σε υποδόριες δόσεις μέχρι 200 U / kg / ημέρα (περίπου 32 φορές την ανθρώπινη υποδόρια δόση, με βάση την περιοχή U / σωματικού εμβαδού), δεν υπήρξαν άμεσες δυσμενείς επιδράσεις στη γονιμότητα των αρσενικών και θηλυκών ζώων ή στις γενικές αναπαραγωγικές επιδόσεις των ζώων παρατηρηθεί.
Τοξικολογία των ζώων και / ή φαρμακολογία
Σε τυπικές βιολογικές δοκιμασίες σε ποντίκια και κουνέλια, μία μονάδα NovoLog έχει την ίδια επίδραση μείωσης της γλυκόζης με μία μονάδα κανονικής ανθρώπινης ινσουλίνης. Στον άνθρωπο, η επίδραση του NovoLog είναι ταχύτερη στην έναρξη και μικρότερη διάρκεια, σε σύγκριση με την κανονική ανθρώπινη ινσουλίνη, λόγω της ταχύτερης απορρόφησης μετά από υποδόρια ένεση (βλ. ΚΛΙΝΙΚΗ ΦΑΡΜΑΚΟΛΟΓΙΑ Εικόνα 2 και Εικόνα 4).
μπλουζα
Κλινικές μελέτες
Υποδόριες ημερήσιες ενέσεις
Διεξήχθησαν δύο εξαμηνιαίες, ανοικτές, ενεργώς ελεγχόμενες μελέτες για τη σύγκριση της ασφάλειας και της αποτελεσματικότητας του NovoLog με το Novolin R σε ενήλικες ασθενείς με διαβήτη τύπου 1. Επειδή τα δύο σχέδια μελέτης και τα αποτελέσματα ήταν παρόμοια, τα δεδομένα φαίνονται μόνο για μία μελέτη (βλ. Πίνακα 3). Το NovoLog χορηγήθηκε με υποδόρια ένεση αμέσως πριν από τα γεύματα και η κανονική ανθρώπινη ινσουλίνη χορηγήθηκε με υποδόρια ένεση 30 λεπτά πριν από τα γεύματα. Η ινσουλίνη NPH χορηγήθηκε ως βασική ινσουλίνη σε απλές ή διαιρεμένες ημερήσιες δόσεις. Οι μεταβολές στην HbA1c και τα ποσοστά εμφάνισης σοβαρής υπογλυκαιμίας (όπως καθορίζεται από τον αριθμό των περιστατικών που απαιτούν παρέμβαση από τρίτο κόμμα) ήταν συγκρίσιμα για τα δύο θεραπευτικά σχήματα στη μελέτη αυτή (Πίνακας 3) καθώς και στις άλλες κλινικές μελέτες που αναφέρονται στο παρόν Ενότητα. Η διαβητική κετοξέωση δεν αναφέρθηκε σε καμία από τις μελέτες για ενήλικες σε καμία από τις ομάδες θεραπείας.
Πίνακας 3. Υποδόρια χορήγηση του NovoLog σε διαβήτη τύπου 1 (24 εβδομάδες; n = 882)
| NovoLog + NPH | Novolin R + NPH | |
| Ν | 596 | 286 |
| HbA βασικής γραμμής1γ (%)* | 7.9 ±1.1 | 8.0 ± 1.2 |
| Μεταβολή από την αρχική τιμή HbA1γ (%) | -0.1 ± 0.8 | 0.0 ± 0.8 |
| Διαφορά Θεραπείας στην HbA1γ, Μέσος (95% διάστημα εμπιστοσύνης) | -0.2 (-0.3, -0.1) | |
| Αρχική δόση ινσουλίνης (IU / kg / 24 ώρες) * | 0.7 ± 0.2 | 0.7 ± 0.2 |
| Δοσολογία ινσουλίνης στο τέλος της μελέτης (IU / kg / 24 ώρες) * | 0.7 ± 0.2 | 0.7 ± 0.2 |
| Ασθενείς με σοβαρή υπογλυκαιμία (n,%) | 104 (17%) | 54 (19%) |
|
Βάρος σώματος βάσης (kg) * Αλλαγή βάρους από την αρχική τιμή (kg) * |
75.3 ± 14.5 0.5 ± 3.3 |
75.9 ± 13.1 0.9 ± 2.9 |
* Οι τιμές είναι μέσες ± SD
• Η σοβαρή υπογλυκαιμία αναφέρεται σε υπογλυκαιμία που σχετίζεται με συμπτώματα του κεντρικού νευρικού συστήματος και απαιτεί την παρέμβαση άλλου ατόμου ή νοσηλείας.
Μια μελέτη παράλληλης ομάδας διάρκειας 24 εβδομάδων για παιδιά και εφήβους με διαβήτη τύπου 1 (n = 283) ηλικίας 6 έως 18 ετών χρόνια σύγκριση δύο υποδόριων θεραπευτικών αγωγών πολλαπλών δόσεων: NovoLog (n = 187) ή Novolin R (n = 96). Η ινσουλίνη NPH χορηγήθηκε ως βασική ινσουλίνη. Το NovoLog πέτυχε γλυκαιμικό έλεγχο συγκρίσιμο με το Novolin R, όπως μετρήθηκε με μεταβολή στην HbA1c (Πίνακας 4) και οι δύο ομάδες θεραπείας είχαν συγκρίσιμη επίπτωση υπογλυκαιμίας. Η υποδόρια χορήγηση του NovoLog και της κανονικής ανθρώπινης ινσουλίνης έχει επίσης συγκριθεί σε παιδιά με διαβήτη τύπου 1 (n = 26) ηλικίας 2 έως 6 ετών με παρόμοια αποτελέσματα στην HbA1c και την υπογλυκαιμία.
Πίνακας 4. Παιδιατρική υποδόρια χορήγηση του NovoLog σε διαβήτη τύπου 1 (24 εβδομάδες, n = 283)
| NovoLog + NPH | Novolin R + NPH | |
| Ν | 187 | 96 |
| HbA βασικής γραμμής1γ (%) * | 8.3 ± 1.2 | 8.3 ± 1.3 |
| Μεταβολή από την αρχική τιμή HbA1γ (%) | 0.1 ± 1.0 | 0.1 ± 1.1 |
| Διαφορά Θεραπείας στην HbA1c, Μέση τιμή (95% διάστημα εμπιστοσύνης) | 0.1 (-0.5, 0.1) | |
| Αρχική δόση ινσουλίνης (IU / kg / 24 ώρες) * | 0.4 ± 0.2 | 0.6 ± 0.2 |
| Δοσολογία ινσουλίνης στο τέλος της μελέτης (IU / kg / 24 ώρες) * | 0.4 ± 0.2 | 0.7 ± 0.2 |
| Ασθενείς με σοβαρή υπογλυκαιμία (n,%) | 11 (6%) | 9 (9%) |
| Διαβητική κετοξέωση (n,%) | 10 (5%) | 2 (2%) |
|
Βάρος σώματος βάσης (kg) * Αλλαγή βάρους από την αρχική τιμή (kg) * |
50.6 ± 19.6 2.7 ± 3.5 |
48.7 ± 15.8 2.4 ± 2.6 |
* Οι τιμές είναι μέσες ± SD
• Η σοβαρή υπογλυκαιμία αναφέρεται σε υπογλυκαιμία που σχετίζεται με συμπτώματα του κεντρικού νευρικού συστήματος και απαιτεί την παρέμβαση άλλου ατόμου ή νοσηλείας.
Διεξήχθη μια εξαμηνιαία, ανοικτή, ενεργός ελεγχόμενη μελέτη για τη σύγκριση της ασφάλειας και της αποτελεσματικότητας του NovoLog με το Novolin R σε ασθενείς με διαβήτη τύπου 2 (Πίνακας 5). Το NovoLog χορηγήθηκε με υποδόρια ένεση αμέσως πριν από τα γεύματα και η κανονική ανθρώπινη ινσουλίνη χορηγήθηκε με υποδόρια ένεση 30 λεπτά πριν από τα γεύματα. Η ινσουλίνη NPH χορηγήθηκε ως βασική ινσουλίνη σε απλές ή διαιρεμένες ημερήσιες δόσεις. Οι μεταβολές στην HbAlc και τα ποσοστά σοβαρής υπογλυκαιμίας (όπως προσδιορίζεται από τον αριθμό των περιπτώσεων που απαιτούν παρέμβαση από τρίτο μέρος) ήταν συγκρίσιμες για τα δύο θεραπευτικά σχήματα.
Πίνακας 5. Υποδόρια χορήγηση του NovoLog σε διαβήτη τύπου 2 (6 μήνες; n = 176)
| NovoLog + NPH | Novolin R + NPH | |
| Ν | 90 | 86 |
| HbA βασικής γραμμής1γ (%) * | 8.1 ± 1.2 | 7.8 ± 1.1 |
| Μεταβολή από την αρχική τιμή HbA1γ (%) | -0.3 ± 1.0 | -0.1 ± 0.8 |
| Διαφορά Θεραπείας στην HbA1c, Μέση τιμή (95% διάστημα εμπιστοσύνης) | - 0.1 (-0.4, -0.1) | |
| Αρχική δόση ινσουλίνης (IU / kg / 24 ώρες) * | 0.6 ± 0.3 | 0.6 ± 0.3 |
| Δοσολογία ινσουλίνης στο τέλος της μελέτης (IU / kg / 24 ώρες) * | 0.7 ± 0.3 | 0.7 ± 0.3 |
| Ασθενείς με σοβαρή υπογλυκαιμία (n,%) | 9 (10%) | 5 (8%) |
|
Βάρος σώματος βάσης (kg) * Αλλαγή βάρους από την αρχική τιμή (kg) * |
88.4 ± 13.3 1.2 ± 3.0 |
85.8 ± 14.8 0.4 ± 3.1 |
* Οι τιμές είναι μέσες ± SD
• Η σοβαρή υπογλυκαιμία αναφέρεται σε υπογλυκαιμία που σχετίζεται με συμπτώματα του κεντρικού νευρικού συστήματος και απαιτεί την παρέμβαση άλλου ατόμου ή νοσηλείας.
Συνεχής υποδόρια έγχυση ινσουλίνης (CSII) με εξωτερική αντλία
Δύο ανοιχτές μελέτες παράλληλου σχεδιασμού (6 εβδομάδες [n = 29] και 16 εβδομάδες [n = 118]) συνέκριναν το NovoLog με ρυθμιστικό διάλυμα ανθρώπινης ινσουλίνης (Velosulin) σε ενήλικες με διαβήτη τύπου 1 που λαμβάνουν υποδόρια έγχυση με εξωτερική ινσουλίνη αντλία. Τα δύο θεραπευτικά σχήματα είχαν συγκρίσιμες μεταβολές στην HbA1c και τα ποσοστά σοβαρής υπογλυκαιμίας.
Πίνακας 6. Μελέτη αντλίας ινσουλίνης σε ενήλικες σε διαβήτη τύπου 1 (16 εβδομάδες; n = 118)
| NovoLog | Ρυθμισμένη ανθρώπινη ινσουλίνη | |
| Ν | 59 | 59 |
| HbA βασικής γραμμής1γ (%) * | 7.3 ± 0.7 | 7.5 ± 0.8 |
| Μεταβολή από την αρχική τιμή HbA1γ (%) | 0.0 ± 0.5 | 0.2 ± 0.6 |
| Διαφορά Θεραπείας στην HbA1c, Μέση τιμή (95% διάστημα εμπιστοσύνης) | 0.3 (-0.1, 0.4) | |
| Αρχική δόση ινσουλίνης (IU / kg / 24 ώρες) * | 0.7 ± 0.8 | 0.6 ± 0.2 |
| Δοσολογία ινσουλίνης στο τέλος της μελέτης (IU / kg / 24 ώρες) * | 0.7 ± 0.7 | 0.6 ± 0.2 |
| Ασθενείς με σοβαρή υπογλυκαιμία (n,%) | 1 (2%) | 2 (3%) |
|
Βάρος σώματος βάσης (kg) * Αλλαγή βάρους από την αρχική τιμή (kg) * |
77.4 ± 16.1 0.1 ± 3.5 |
74.8 ± 13.8 -0.0 ± 1.7 |
* Οι τιμές είναι μέσες ± SD
• Η σοβαρή υπογλυκαιμία αναφέρεται σε υπογλυκαιμία που σχετίζεται με συμπτώματα του κεντρικού νευρικού συστήματος και απαιτεί την παρέμβαση άλλου ατόμου ή νοσηλείας.
Μια τυχαιοποιημένη, 16-εβδομάδων ανοιχτής μελέτης παράλληλου σχεδιασμού παιδιών και εφήβων με διαβήτη τύπου 1 (n = 298) ηλικίας 4-18 ετών ετών συγκρίθηκαν δύο αγωγές υποδόριας έγχυσης που χορηγήθηκαν μέσω εξωτερικής αντλίας ινσουλίνης: NovoLog (n = 198) ή ινσουλίνη lispro (η = 100). Αυτές οι δύο θεραπείες είχαν ως αποτέλεσμα συγκρίσιμες μεταβολές από την αρχική τιμή της HbA1c και συγκρίσιμες τιμές υπογλυκαιμίας μετά από 16 εβδομάδες θεραπείας (βλ. Πίνακα 7).
Πίνακας 7. Παιδιατρική μελέτη αντλίας ινσουλίνης στον διαβήτη τύπου 1 (16 εβδομάδες; n = 298)
| NovoLog | Lispro | |
| Ν | 198 | 100 |
| HbA βασικής γραμμής1γ (%) * | 8.0 ± 0.9 | 8.2 ± 0.8 |
| Μεταβολή από την αρχική τιμή HbA1γ (%) | -0.1 ± 0.8 | -0.1 ± 0.7 |
| Διαφορά Θεραπείας στην HbA1c, Μέση τιμή (95% διάστημα εμπιστοσύνης) | -0.1 (-0.3, 0.1) | |
| Αρχική δόση ινσουλίνης (IU / kg / 24 ώρες) * | 0.9 ± 0.3 | 0.9 ± 0.3 |
| Δοσολογία ινσουλίνης στο τέλος της μελέτης (IU / kg / 24 ώρες) * | 0.9 ± 0.2 | 0.9 ± 0.2 |
| Ασθενείς με σοβαρή υπογλυκαιμία (n,%) | 19 (10%) | 8 (8%) |
| Διαβητική κετοξέωση (n,%) | 1 (0.5%) | 0 (0) |
|
Βάρος σώματος βάσης (kg) * Αλλαγή βάρους από την αρχική τιμή (kg) * |
54.1 ± 19.7 1.8 ± 2.1 |
55.5 ± 19.0 1.6 ± 2.1 |
* Οι τιμές είναι μέσες ± SD
• Η σοβαρή υπογλυκαιμία αναφέρεται σε υπογλυκαιμία που σχετίζεται με συμπτώματα του κεντρικού νευρικού συστήματος και απαιτεί την παρέμβαση άλλου ατόμου ή νοσηλείας.
Μια ανοιχτή μελέτη παράλληλης μελέτης διάρκειας 16 εβδομάδων συνέκρινε την προ-γευστική ένεση NovoLog σε συνδυασμό με Ενέσεις NPH στο NovoLog που χορηγούνται με συνεχή υποδόρια έγχυση σε 127 ενήλικες με τύπο 2 Διαβήτης. Οι δύο ομάδες θεραπείας είχαν παρόμοιες μειώσεις στην HbA1c και στους ρυθμούς σοβαρής υπογλυκαιμίας (Πίνακας 8) [βλ Ενδείξεις και χρήση, Δοσολογία και χορήγηση, Προειδοποιήσεις και προφυλάξεις και Πώς παρέχεται / αποθήκευση και χειρισμός].
Πίνακας 8. Θεραπεία αντλίας σε διαβήτη τύπου 2 (16 εβδομάδες; n = 127)
| Αντλία NovoLog | NovoLog + NPH | |
| Ν | 66 | 61 |
| HbA βασικής γραμμής1γ (%) * | 8.2 ± 1.4 | 8.0 ± 1.1 |
| Μεταβολή από την αρχική τιμή HbA1γ (%) | -0.6 ± 1.1 | -0.5 ± 0.9 |
| Διαφορά Θεραπείας στην HbA1c, Μέση τιμή (95% διάστημα εμπιστοσύνης) | 0.1 (0.4, 0.3) | |
| Αρχική δόση ινσουλίνης (IU / kg / 24 ώρες) * | 0.7 ± 0.3 | 0.8 ± 0.5 |
| Δοσολογία ινσουλίνης στο τέλος της μελέτης (IU / kg / 24 ώρες) * | 0.9 ± 0.4 | 0.9 ± 0.5 |
|
Βάρος σώματος βάσης (kg) * Αλλαγή βάρους από την αρχική τιμή (kg) * |
96.4 ± 17.0 1.7 ± 3.7 |
96.9 ± 17.9 0.7 ± 4.1 |
* Οι τιμές είναι μέσες ± SD
Ενδοφλέβια χορήγηση του NovoLog
Βλ. Ενότητα Κλινική Φαρμακολογία / Φαρμακοδυναμική.
μπλουζα
Πώς παρέχεται / αποθήκευση και χειρισμός
Το NovoLog διατίθεται στα ακόλουθα μεγέθη συσκευασίας: κάθε παρουσίαση που περιέχει 100 μονάδες ασπαρτικής ινσουλίνης ανά mL (U-100).
| Φιαλίδια των 10 mL | NDC 0169-7501-11 |
| 3 mL φυσίγγια PenFill * | NDC 0169-3303-12 |
| 3 mL NovoLog FlexPen προγεμισμένη σύριγγα | NDC 0169-6339-10 |
* Τα φυσίγγια NovoLog PenFill έχουν σχεδιαστεί για χρήση με συμβατό φυσίγγιο Novo Nordisk 3 mL PenFill συσκευές χορήγησης ινσουλίνης (με ή χωρίς προσθήκη ενός NovoPen 3 PenMate) με αναλώσιμη συσκευή NovoFine βελόνες.
Συνιστώμενη αποθήκευση
Το μη χρησιμοποιούμενο NovoLog πρέπει να φυλάσσεται σε ψυγείο μεταξύ 2 ° και 8 ° C (36 ° έως 46 ° F). Μην το αποθηκεύετε στην κατάψυξη ή απευθείας δίπλα στο στοιχείο ψύξης του ψυγείου. Μην καταψύχετε το NovoLog και μην χρησιμοποιείτε το NovoLog εάν έχει παγώσει. Το NovoLog δεν πρέπει να έλκεται σε σύριγγα και να αποθηκεύεται για μεταγενέστερη χρήση.
Φιαλίδια: Μετά την αρχική χρήση, ένα φιαλίδιο μπορεί να διατηρηθεί σε θερμοκρασίες κάτω από 30 ° C (86 ° F) για έως 28 ημέρες, αλλά δεν πρέπει να εκτίθεται σε υπερβολική θερμότητα ή ηλιακό φως. Τα ανοιγμένα φιαλίδια μπορούν να ψυχθούν.
Τα μη τυποποιημένα φιαλίδια μπορούν να χρησιμοποιηθούν μέχρι την ημερομηνία λήξης που αναγράφεται στην ετικέτα, εάν αποθηκεύονται σε ψυγείο. Φυλάσσετε τα αχρησιμοποίητα φιαλίδια στο κουτί έτσι ώστε να παραμένουν καθαρά και να προστατεύονται από το φως.
Φυσίγγια PenFill ή προγεμισμένες σύριγγες NovoLog FlexPen:
Αφού διαρρηχθεί μια κασέτα ή μια προγεμισμένη σύριγγα NovoLog FlexPen, θα πρέπει να διατηρείται σε θερμοκρασίες κάτω από 30 ° C (28 ° C) για 28 ημέρες, αλλά δεν πρέπει να εκτίθεται σε υπερβολική θερμότητα ή ηλιακό φως. Φυσίγγια ή NovoLog FlexPen Τα προγεμισμένα σύριγγα που χρησιμοποιούνται δεν πρέπει να αποθηκεύονται στο ψυγείο. Φυλάσσετε όλα τα φυσίγγια PenFill® και τις προγεμισμένες σύριγγες NovoLog FlexPen μιας χρήσης μακριά από την άμεση θερμότητα και το ηλιακό φως. Μη καταγεγραμμένα δοχεία PenFill και NovoLog FlexPen Οι προγεμισμένες σύριγγες μπορούν να χρησιμοποιηθούν μέχρι την ημερομηνία λήξης που αναγράφεται στην ετικέτα, εάν αποθηκεύονται σε ψυγείο. Κρατάτε τα αχρησιμοποίητα φυσίγγια PenFill και τα προγεμισμένα σύριγγες NovoLog FlexPen στο κουτί έτσι ώστε να παραμένουν καθαρά και προστατευμένα από το φως.
Πάντοτε αφαιρέστε τη βελόνα μετά από κάθε ένεση και αποθηκεύστε τη συσκευή χορήγησης φυσιγγίων PenFill 3 mL ή την προγεμισμένη σύριγγα NovoLog FlexPen χωρίς μια βελόνα. Αυτό αποτρέπει τη μόλυνση ή / και τη μόλυνση ή τη διαρροή ινσουλίνης και θα εξασφαλίσει ακριβή δοσολογία. Χρησιμοποιείτε πάντα μια καινούργια βελόνα για κάθε ένεση για να αποτρέψετε τη μόλυνση.
Αντλία:
Το NovoLog στη δεξαμενή της αντλίας πρέπει να απορρίπτεται τουλάχιστον κάθε 48 ώρες χρήσης ή μετά από έκθεση σε θερμοκρασίες που υπερβαίνουν τους 37 ° C (98,6 ° F).
Περίληψη των όρων αποθήκευσης:
Οι συνθήκες αποθήκευσης συνοψίζονται στον ακόλουθο πίνακα:
Πίνακας 9. Συνθήκες αποθήκευσης για φιαλίδιο, φυσίγγια PenFill και προγεμισμένη σύριγγα NovoLog FlexPen
|
NovoLog παρουσίαση |
Μη χρησιμοποιημένη (μη ανοιγμένη) Θερμοκρασία δωματίου (κάτω από 30 ° C) | Δεν είναι σε χρήση (δεν έχει ανοιχτεί) Ψύξη | Θερμοκρασία δωματίου (ανοιχτή) σε λειτουργία (κάτω από 30 ° C) |
| Φιαλίδιο των 10 mL | 28 ημέρες | Μέχρι την ημερομηνία λήξης | 28 ημέρες (ψυγείο / θερμοκρασία δωματίου) |
| 3 mL φυσίγγια PenFill | 28 ημέρες | Μέχρι την ημερομηνία λήξης |
28 ημέρες (Μην ψύχετε) |
| 3 mL NovoLog FlexPen προγεμισμένη σύριγγα | 28 ημέρες | Μέχρι την ημερομηνία λήξης |
28 ημέρες (Μην ψύχετε) |
Αποθήκευση του αραιωμένου NovoLog
Το NovoLog αραιωμένο με μέσο αραίωσης ινσουλίνης για NovoLog σε συγκέντρωση ισοδύναμο με U-10 ή ισοδύναμο με U-50 μπορεί να παραμείνει στη χρήση του ασθενούς σε θερμοκρασίες κάτω από 30 ° C (86 ° F) για 28 ημέρες.
Αποθήκευση του NovoLog σε υγρά έγχυσης
Οι σάκκοι έγχυσης που παρασκευάζονται όπως υποδεικνύεται στην ενότητα Δόση και χορήγηση (2) είναι σταθεροί σε θερμοκρασία δωματίου για 24 ώρες. Κάποια ινσουλίνη θα απορροφηθεί αρχικά στο υλικό του σάκου έγχυσης.
Τελευταία ενημέρωση 12/2008
NovoLog, ινσουλίνη aspart, πληροφορίες για τον ασθενή (στην απλή αγγλική γλώσσα)
Λεπτομερείς πληροφορίες για σημεία, συμπτώματα, αιτίες, θεραπείες διαβήτη
Οι πληροφορίες σε αυτή τη μονογραφία δεν προορίζονται να καλύψουν όλες τις πιθανές χρήσεις, οδηγίες, προφυλάξεις, αλληλεπιδράσεις φαρμάκων ή ανεπιθύμητες ενέργειες. Αυτές οι πληροφορίες είναι γενικευμένες και δεν προορίζονται ως συγκεκριμένες ιατρικές συμβουλές. Εάν έχετε απορίες σχετικά με τα φάρμακα που παίρνετε ή θέλετε περισσότερες πληροφορίες, επικοινωνήστε με το γιατρό σας, το φαρμακοποιό ή τη νοσοκόμα σας.
πίσω στο: Περιηγηθείτε σε όλα τα φάρμακα για τον διαβήτη



