Iloperidone (fanapt) Πλήρεις πληροφορίες συνταγογράφησης
Εμπορικό σήμα: Fanapt
Γενικό όνομα: Ιλοπεριδόνη
Οδηγός συνταγογράφησης Fanapt (Iloperidone) (PDF)
Περιεχόμενα:
Εγκιβωτισμένη προειδοποίηση
Ενδείξεις και χρήση
Δοσολογία και χορήγηση
Αντενδείξεις
Προειδοποιήσεις και προφυλάξεις
Ανεπιθύμητες ενέργειες
Αλληλεπιδράσεις με άλλα φάρμακα
Χρήση σε συγκεκριμένους πληθυσμούς
Κατάχρηση ναρκωτικών και εξάρτηση
Υπερβολική δόση
Περιγραφή
Κλινική Φαρμακολογία
Μη κλινική τοξικολογία
Κλινικές μελέτες
Πώς παρέχεται
Οδηγός φαρμακευτικής αγωγής Brintellix
ΠΡΟΕΙΔΟΠΟΙΗΣΗ: ΑΥΞΗΜΕΝΗ ΘΑΝΑΤΟΤΗΤΑ ΣΕ ΠΑΝΩ ΑΣΘΕΝΕΙΑ ΜΕ ΨΥΧΟΓΕΝΕΙΑ
Οι ηλικιωμένοι ασθενείς με ψυχώση σχετιζόμενη με άνοια που λαμβάνουν αντιψυχωσικά φάρμακα έχουν αυξημένο κίνδυνο θανάτου. Το FANAPT δεν έχει εγκριθεί για τη θεραπεία ασθενών με ψύχωση που σχετίζεται με άνοια.
Ενδείξεις και χρήση
Το FANAPT® ενδείκνυται για τη θεραπεία της σχιζοφρένειας σε ενήλικες.
Όταν αποφασίζει μεταξύ των διαθέσιμων εναλλακτικών θεραπειών για αυτή την πάθηση, ο συνταγογράφος πρέπει να εξετάσει το εύρημα ότι το FANAPT σχετίζεται με την παράταση του διαστήματος QTc. Η παράταση του διαστήματος QTc συσχετίζεται με ορισμένα άλλα φάρμακα με την ικανότητα να προκαλούν torsade de τύπου αρρυθμίας, μια δυνητικά θανατηφόρα πολυμορφική κοιλιακή ταχυκαρδία που μπορεί να οδηγήσει σε ξαφνική θάνατος. Σε πολλές περιπτώσεις αυτό θα οδηγούσε στο συμπέρασμα ότι πρώτα θα πρέπει να δοκιμάζονται και άλλα φάρμακα. Το αν το FANAPT θα προκαλέσει κνησμό ή αύξηση του αιφνίδιου θανάτου δεν είναι ακόμη γνωστό.
Οι ασθενείς πρέπει να τιτλοδοτούνται σε αποτελεσματική δόση του FANAPT. Επομένως, ο έλεγχος των συμπτωμάτων μπορεί να καθυστερήσει κατά τη διάρκεια των πρώτων 1 έως 2 εβδομάδων θεραπείας σε σύγκριση με ορισμένα άλλα αντιψυχωτικά φάρμακα που δεν απαιτούν παρόμοια τιτλοδότηση. Οι συνταγογράφοι θα πρέπει να γνωρίζουν αυτή την καθυστέρηση κατά την επιλογή ενός αντιψυχωτικού φαρμάκου για τη θεραπεία της σχιζοφρένειας.
συνεχίστε την παρακάτω ιστορία
Δοσολογία και χορήγηση
Συνήθης δόση
Το FANAPT πρέπει να τιτλοποιείται αργά από χαμηλή δόση έναρξης για να αποφευχθεί η ορθοστατική υπόταση λόγω των αλφα-αδρενεργικών δεσμευτικών ιδιοτήτων του. Η συνιστώμενη δόση έναρξης για τα δισκία FANAPT είναι 1 mg από του στόματος δύο φορές την ημέρα. Η δόση αυξάνεται για να φτάσει το εύρος στόχου των 6-12 mg δύο φορές ημερησίως (12-24 mg / ημέρα), με ημερήσιες δόσεις να μην υπερβαίνουν τα 2 mg δύο φορές την ημέρα (4 mg / ημέρα). Η μέγιστη συνιστώμενη δόση είναι 12 mg δύο φορές την ημέρα (24 mg / ημέρα). Οι δόσεις FANAPT άνω των 24 mg / ημέρα δεν αξιολογήθηκαν συστηματικά στις κλινικές δοκιμές. Η αποτελεσματικότητα αποδείχθηκε με το FANAPT σε μια δόση από 6 έως 12 mg δύο φορές την ημέρα. Οι συνταγογράφοι πρέπει να γνωρίζουν το γεγονός ότι οι ασθενείς πρέπει να τιτλοδοτούνται σε μια αποτελεσματική δόση του FANAPT. Έτσι, ο έλεγχος των συμπτωμάτων μπορεί να καθυστερήσει κατά τη διάρκεια των πρώτων 1 έως 2 εβδομάδων θεραπείας σε σύγκριση με ορισμένα άλλα αντιψυχωσικά φάρμακα που δεν απαιτούν παρόμοια τιτλοδότηση. Οι συνταγογράφοι πρέπει επίσης να γνωρίζουν ότι ορισμένες ανεπιθύμητες ενέργειες που σχετίζονται με τη χρήση του FANAPT σχετίζονται με τη δόση. Το FANAPT μπορεί να χορηγηθεί ανεξάρτητα από τα γεύματα.
Δοσολογία σε Ειδικούς Πληθυσμούς
Ρύθμιση δοσολογίας για ασθενείς που λαμβάνουν FANAPT ταυτόχρονα με πιθανούς αναστολείς του CYP2D6: Η δόση του FANAPT πρέπει να είναι μειωμένη κατά το ήμισυ όταν χορηγείται ταυτόχρονα με ισχυρούς αναστολείς του CYP2D6 όπως η φλουοξετίνη ή παροξετίνη. Όταν αναστέλλεται ο αναστολέας του CYP2D6 από τη συνδυασμένη θεραπεία, η δόση του FANAPT θα πρέπει να αυξηθεί σε εκείνη που ήταν πριν.
Ρύθμιση δοσολογίας για ασθενείς που λαμβάνουν FANAPT ταυτόχρονα με πιθανούς αναστολείς του CYP3A4: Η δόση του FANAPT πρέπει να είναι μειωμένη κατά το ήμισυ όταν χορηγείται ταυτόχρονα με ισχυρούς αναστολείς του CYP3A4, όπως η κετοκοναζόλη ή η κετοκοναζόλη κλαριθρομυκίνη. Όταν ο αναστολέας του CYP3A4 αποσυρθεί από τη θεραπεία συνδυασμού, η δόση του FANAPT θα πρέπει να αυξηθεί σε εκείνη που ήταν πριν.
Αναπροσαρμογή δοσολογίας για ασθενείς που λαμβάνουν FANAPT που είναι κακοί μεταβολιστές του CYP2D6: Η δόση του FANAPT θα πρέπει να μειωθεί κατά το ήμισυ για τους ασθενείς με κακοήθη μεταβολισμό του CYP2D6.
Ηπατική δυσλειτουργία: Δεν απαιτείται προσαρμογή της δόσης στο FANAPT σε ασθενείς με ήπια ηπατική δυσλειτουργία. Ασθενείς με μέτρια ηπατική δυσλειτουργία μπορεί να απαιτούν μείωση της δόσης, εάν είναι κλινικά ενδεδειγμένο. Το FANAPT δεν συνιστάται σε ασθενείς με σοβαρή ηπατική δυσλειτουργία.
Συντήρηση Θεραπεία
Σε μια πιο μακροπρόθεσμη μελέτη, το FANAPT ήταν αποτελεσματικό στην καθυστέρηση της υποτροπής σε ασθενείς με σχιζοφρένεια οι οποίοι σταθεροποιήθηκαν σε FANAPT έως 24 mg / ημέρα. Οι ασθενείς θα πρέπει να επανεξετάζονται περιοδικά για να καθορίσουν την ανάγκη θεραπείας συντήρησης.
Επανένταξη της θεραπείας σε ασθενείς που είχαν διακοπεί στο παρελθόν Παρά το γεγονός ότι δεν υπάρχουν δεδομένα για την ειδική αντιμετώπιση της επανάληψης του θεραπεία, συνιστάται να ακολουθείται το πρόγραμμα τιτλοποίησης έναρξης κάθε φορά που οι ασθενείς έχουν διαλείμματα από το FANAPT περισσότερων από 3 ημέρες.
μπλουζα
Δοσολογικές μορφές και δυνατά σημεία
Τα δισκία FANAPT διατίθενται στις ακόλουθες περιεκτικότητες: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg και 12 mg. Τα δισκία είναι λευκά, στρογγυλά, επίπεδη, λοξότμητα και ταυτοποιημένα με λογότυπο "" που φέρει την ετικέτα "" 1 "," 2 "," 4 "," 6 "," 8 "," 10 " ή "12" στην άλλη πλευρά.
μπλουζα
Αντενδείξεις
Το FANAPT αντενδείκνυται σε άτομα με γνωστή αντίδραση υπερευαισθησίας στο προϊόν. Έχουν αναφερθεί αναφυλαξία, αγγειοοίδημα και άλλες αντιδράσεις υπερευαισθησίας.
μπλουζα
ΠΡΟΕΙΔΟΠΟΙΗΣΕΙΣ ΚΑΙ ΠΡΟΦΥΛΑΞΕΙΣ
Αυξημένη θνησιμότητα σε ηλικιωμένους ασθενείς με ψύχωση που σχετίζεται με την άνοια
Τα αντιψυχωσικά φάρμακα αυξάνουν τον κίνδυνο πρόκλησης θανάτου σε ηλικιωμένους ασθενείς με ψύχωση που σχετίζεται με την άνοια. Αναλύσεις 17 ελεγχόμενων με άνοια ψευδο-ελεγχόμενων ελεγχόμενων δοκιμών (διάρκεια των 10 εβδομάδων και σε μεγάλο βαθμό σε ασθενείς που έλαβαν άτυπη αντιψυχωσικά φάρμακα) έδειξε κίνδυνο θανάτου στους ασθενείς που έλαβαν φάρμακο μεταξύ 1,6 και 1,7 φορές σε σχέση με τους ασθενείς που έλαβαν εικονικό φάρμακο. Κατά τη διάρκεια μιας τυπικής ελεγχόμενης δοκιμής 10 εβδομάδων, ο ρυθμός θανάτου σε ασθενείς που έλαβαν φάρμακο ήταν περίπου 4,5%, σε σύγκριση με ρυθμό περίπου 2,6% στους ασθενείς που έλαβαν εικονικό φάρμακο.
Αν και οι αιτίες θανάτου ποικίλουν, οι περισσότεροι από τους θανάτους φαίνεται να είναι καρδιαγγειακοί (π.χ. καρδιακή ανεπάρκεια, αιφνίδιος θάνατος) ή μολυσματικός (π.χ. πνευμονία) στη φύση. Το FANAPT δεν έχει εγκριθεί για τη θεραπεία ασθενών με ψύχωση που σχετίζεται με άνοια.
Εγκεφαλοαγγειακές ανεπιθύμητες αντιδράσεις, συμπεριλαμβανομένου του εγκεφαλικού επεισοδίου, σε ηλικιωμένους ασθενείς με ψύχωση που σχετίζεται με την άνοια
Σε ελεγχόμενες με εικονικό φάρμακο μελέτες σε ηλικιωμένα άτομα με άνοια, ασθενείς τυχαιοποιημένοι σε ρισπεριδόνη, η αριπιπραζόλη και η ολανζαπίνη είχαν υψηλότερη συχνότητα εμφάνισης εγκεφαλικού επεισοδίου και παροδικής ισχαιμικής επίθεσης, συμπεριλαμβανομένης της θανατηφόρου Εγκεφαλικό. Το FANAPT δεν έχει εγκριθεί για τη θεραπεία ασθενών με ψύχωση που σχετίζεται με άνοια.
Παράταση QT
Σε μια ανοιχτή μελέτη QTc σε ασθενείς με σχιζοφρένεια ή σχιζοσυναισθηματική διαταραχή (n = 160), το FANAPT συσχετίστηκε με παράταση QTc των 9 msec σε δόση λοπεριδόνης 12 mg δύο φορές την ημέρα. Η επίδραση του FANAPT στο διάστημα QT αυξήθηκε με την παρουσία μεταβολικής αναστολής του CYP450 2D6 ή 3Α4 (παροξετίνη 20 mg μία φορά την ημέρα και κετοκοναζόλη 200 mg δύο φορές την ημέρα, αντίστοιχα). Υπό συνθήκες μεταβολικής αναστολής τόσο για 2D6 όσο και για 3Α4, το FANAPT 12 mg δύο φορές την ημέρα συσχετίστηκε με μια μέση αύξηση QTcF από την αρχική τιμή περίπου 19 msec.
Δεν παρατηρήθηκαν περιστατικά torsade de pointes ή άλλες σοβαρές καρδιακές αρρυθμίες κατά τη διάρκεια του κλινικού προγράμματος πριν από την κυκλοφορία του φαρμάκου.
Η χρήση του FANAPT θα πρέπει να αποφεύγεται σε συνδυασμό με άλλα φάρμακα που είναι γνωστό ότι παρατείνουν το QTc συμπεριλαμβανομένης της κλάσης 1Α (π.χ., κινιδίνη, ποζαϊναμίδη) ή κατά τάξης III (π.χ., αμιωδαρόνη, σοταλόλη), αντιψυχωτικά φάρμακα (π.χ., χλωροπρομαζίνη, θειοριδαζίνη), αντιβιοτικά (π.χ., γκατιφλοξασίνη, μοξιφλοξασίνη) ή οποιαδήποτε άλλη κατηγορία φαρμάκων που είναι γνωστό ότι παρατείνουν το διάστημα QTc (π.χ., πενταμιδίνη, οξεικό λεβομεθαδύλιο, μεθαδόνη). Το FANAPT πρέπει επίσης να αποφεύγεται σε ασθενείς με σύνδρομο συγγενούς μακρού QT και σε ασθενείς με ιστορικό καρδιακών αρρυθμιών.
Ορισμένες περιστάσεις μπορεί να αυξήσουν τον κίνδυνο εμφάνισης κνησμού ή / και αιφνίδιου θανάτου σε συνδυασμό με τη χρήση φαρμάκων που παρατείνουν το διάστημα QTc, συμπεριλαμβανομένης της (1) βραδυκαρδίας. (2) υποκαλιαιμία ή υπομαγνησιμία, (3) ταυτόχρονη χρήση άλλων φαρμάκων που παρατείνουν το διάστημα QTc. και (4) παρουσία συγγενούς παράτασης του διαστήματος QT. (5) πρόσφατο οξύ έμφραγμα του μυοκαρδίου. και / ή (6) μη αντισταθμισμένη καρδιακή ανεπάρκεια.
Προσοχή απαιτείται όταν συνταγογραφείται το FANAPT με φάρμακα που αναστέλλουν το μεταβολισμό του FANAPT και σε ασθενείς με μειωμένη δραστικότητα του CYP2D6.
Συνιστάται στους ασθενείς που εξετάζονται για τη θεραπεία με το FANAPT να διατρέχουν κίνδυνο για σημαντική οι διαταραχές του ηλεκτρολύτη έχουν βασικές μετρήσεις του καλίου και του μαγνησίου στον ορό με περιοδική παρακολούθησης. Η υποκαλιαιμία (και / ή η υπομαγνησιμία) μπορεί να αυξήσει τον κίνδυνο παράτασης του διαστήματος QT και αρρυθμίας. Το FANAPT πρέπει να αποφεύγεται σε ασθενείς με ιστορικό σημαντικών καρδιαγγειακών παθήσεων, π.χ. QT παράταση, πρόσφατο οξύ έμφραγμα του μυοκαρδίου, μη αντισταθμισμένη καρδιακή ανεπάρκεια ή καρδιακή αρρυθμία. Το FANAPT θα πρέπει να διακόπτεται σε ασθενείς που παρουσιάζουν επίμονες μετρήσεις QTc> 500 msec.
Εάν οι ασθενείς που λαμβάνουν FANAPT έχουν συμπτώματα που θα μπορούσαν να υποδηλώνουν την εμφάνιση καρδιακών αρρυθμιών, π.χ., ζάλη, αίσθημα παλμών ή συγκοπή, ο γιατρός θα πρέπει να ξεκινήσει περαιτέρω αξιολόγηση, συμπεριλαμβανομένου του καρδιακού παρακολούθησης.
Νευροληπτικό κακόηθες σύνδρομο (NMS)
Ένα δυνητικά θανατηφόρο σύμπλεγμα συμπτωμάτων που μερικές φορές αναφέρεται ως κακοήθες νευροληπτικό σύνδρομο (NMS) έχει αναφερθεί σε συνδυασμό με τη χορήγηση αντιψυχωσικών φαρμάκων, συμπεριλαμβανομένου του FANAPT. Οι κλινικές εκδηλώσεις περιλαμβάνουν υπερπυρεξία, μυϊκή δυσκαμψία, αλλοιωμένη ψυχική κατάσταση (συμπεριλαμβανομένων των κατατονικών σημείων) και ενδείξεις αυτόνομης αστάθειας (ακανόνιστος παλμός ή πίεση αίματος, ταχυκαρδία, διάφαση και καρδιακή ανεπάρκεια δυσρυθμία). Επιπλέον σημεία μπορεί να περιλαμβάνουν αυξημένη φωσφοκινάση κρεατίνης, μυοσφαιρινουρία (ραβδομυόλυση) και οξεία νεφρική ανεπάρκεια. Η διαγνωστική αξιολόγηση των ασθενών με αυτό το σύνδρομο είναι περίπλοκη. Κατά τη διάγνωση, είναι σημαντικό να εντοπίζονται περιπτώσεις στις οποίες περιλαμβάνεται η κλινική παρουσίαση τόσο σοβαρές ιατρικές ασθένειες όσο και ανεπεξέργαστα ή ανεπαρκώς αντιμετωπιζόμενα εξωπυραμιδικά σημεία και συμπτώματα (EPS). Άλλες σημαντικές εκτιμήσεις στη διαφορική διάγνωση περιλαμβάνουν την κεντρική αντιχολινεργική τοξικότητα, την θερμική διαταραχή, τον πυρετό φαρμάκου και την παθολογία του κεντρικού νευρικού συστήματος (ΚΝΣ).
Η αντιμετώπιση αυτού του συνδρόμου πρέπει να περιλαμβάνει: (1) την άμεση διακοπή των αντιψυχωτικών φαρμάκων και άλλων φαρμάκων που δεν είναι απαραίτητα για την ταυτόχρονη θεραπεία, (2) εντατική συμπτωματική θεραπεία και ιατρική παρακολούθηση και (3) θεραπεία οποιωνδήποτε συνακόλουθων σοβαρών ιατρικών προβλημάτων για τα οποία υπάρχουν διαθέσιμες ειδικές θεραπείες. Δεν υπάρχει γενική συμφωνία σχετικά με συγκεκριμένα φαρμακολογικά θεραπευτικά σχήματα για τα ΝΜΣ.
Εάν ένας ασθενής απαιτεί θεραπεία με αντιψυχωσικό φάρμακο μετά από ανάκτηση από το NMS, θα πρέπει να εξεταστεί προσεκτικά η πιθανή επανεισαγωγή της φαρμακευτικής αγωγής. Ο ασθενής θα πρέπει να παρακολουθείται προσεκτικά, καθώς έχουν αναφερθεί υποτροπιάζουσες ανεπιθύμητες ενέργειες.
Τερματική δυσκινησία
Η όψιμη δυσκινησία είναι ένα σύνδρομο που αποτελείται από δυνητικά μη αναστρέψιμες, ακούσιες, δυσκινητικές κινήσεις, οι οποίες μπορεί να εμφανιστούν σε ασθενείς που λαμβάνουν αντιψυχωσικά φάρμακα. Παρόλο που ο επιπολασμός του συνδρόμου φαίνεται να είναι ο υψηλότερος στους ηλικιωμένους, ιδιαίτερα σε ηλικιωμένες γυναίκες, είναι αδύνατο βασίζονται σε εκτιμήσεις του επιπολασμού για την πρόβλεψη, κατά την έναρξη της αντιψυχωσικής αγωγής, ποιοι ασθενείς είναι πιθανό να αναπτύξουν σύνδρομο. Το εάν τα αντιψυχωσικά φαρμακευτικά προϊόντα διαφέρουν ως προς τη δυνατότητά τους να προκαλούν όψιμη δυσκινησία είναι άγνωστη.
Ο κίνδυνος εμφάνισης όψιμης δυσκινησίας και η πιθανότητα να γίνει μη αναστρέψιμος πιστεύεται να αυξηθεί όσο η διάρκεια της θεραπείας και η συνολική σωρευτική δόση του χορηγούμενου αντιψυχωτικού φαρμάκου αυξάνεται. Ωστόσο, το σύνδρομο μπορεί να αναπτυχθεί, αν και πολύ λιγότερο συχνά, μετά από σχετικά σύντομες περιόδους θεραπείας σε χαμηλές δόσεις.
Δεν υπάρχει γνωστή θεραπεία για τις καθιερωμένες περιπτώσεις ταχύτερης δυσκινησίας, παρόλο που το σύνδρομο μπορεί να αποσυρθεί, εν μέρει ή πλήρως, εάν αποσυρθεί αντιψυχωσική θεραπεία. Ωστόσο, η ίδια η αντιψυχωτική αγωγή μπορεί να καταστείλει (ή μερικώς να καταστείλει) τα σημεία και τα συμπτώματα του συνδρόμου και έτσι να καλύψει ενδεχομένως την υποκείμενη διαδικασία. Η επίδραση που έχει η συμπτωματική καταστολή στην μακροχρόνια πορεία του συνδρόμου είναι άγνωστη.
Δεδομένων αυτών των εκτιμήσεων, το FANAPT θα πρέπει να συνταγογραφείται με τρόπο που είναι πιθανότερο να ελαχιστοποιήσει την εμφάνιση όψιμης δυσκινησίας. Η χρόνια αντιψυχωσική θεραπεία πρέπει γενικά να προορίζεται για ασθενείς που πάσχουν από χρόνια ασθένεια που (1) είναι γνωστό ότι ανταποκρίνεται αντιψυχωσικά φάρμακα και (2) για τα οποία δεν υπάρχουν διαθέσιμες εναλλακτικές, εξίσου αποτελεσματικές αλλά δυνητικά λιγότερο επιβλαβείς θεραπείες ή κατάλληλος. Σε ασθενείς που χρειάζονται χρόνια θεραπεία, θα πρέπει να αναζητηθεί η μικρότερη δόση και η μικρότερη διάρκεια της θεραπείας που προκαλούν ικανοποιητική κλινική ανταπόκριση. Η ανάγκη συνεχούς θεραπείας πρέπει να επανεξετάζεται περιοδικά.
Εάν εμφανιστούν σημεία και συμπτώματα της όψιμης δυσκινησίας σε έναν ασθενή στο FANAPT, πρέπει να εξεταστεί το ενδεχόμενο διακοπής του φαρμάκου. Ωστόσο, ορισμένοι ασθενείς μπορεί να χρειαστούν θεραπεία με το FANAPT παρά την ύπαρξη του συνδρόμου.
Μεταβολικές μεταβολές
Τα άτυπα αντιψυχωσικά φάρμακα έχουν συσχετιστεί με μεταβολικές αλλαγές που μπορεί να αυξήσουν τον καρδιαγγειακό / εγκεφαλοαγγειακό κίνδυνο. Αυτές οι μεταβολικές μεταβολές περιλαμβάνουν υπεργλυκαιμία, δυσλιπιδαιμία και αύξηση σωματικού βάρους. Αν και όλα τα άτυπα αντιψυχωτικά φάρμακα έχουν αποδειχθεί ότι προκαλούν μερικές μεταβολικές μεταβολές, κάθε φάρμακο στην κατηγορία έχει το δικό του ειδικό προφίλ κινδύνου.
Υπεργλυκαιμία και σακχαρώδη διαβήτη
Υπεργλυκαιμία, σε ορισμένες περιπτώσεις ακραία και σχετιζόμενη με κετοξέωση ή υπεροσμωτικό κώμα ή θάνατο, έχει αναφερθεί σε ασθενείς που έλαβαν αγωγή με άτυπα αντιψυχωσικά, συμπεριλαμβανομένου του FANAPT. Η αξιολόγηση της σχέσης μεταξύ της χρήσης άτυπης αντιψυχωσικής και των ανωμαλιών γλυκόζης περιπλέκεται από τη δυνατότητα αύξησης κινδύνου για σακχαρώδη διαβήτη σε ασθενείς με σχιζοφρένεια και την αυξανόμενη συχνότητα εμφάνισης σακχαρώδους διαβήτη στη γενική πληθυσμός. Δεδομένων αυτών των συγχυτικών στοιχείων, η σχέση μεταξύ της χρήσης άτυπης αντιψυχωσικής και των ανεπιθύμητων συμβάντων που σχετίζονται με την υπεργλυκαιμία δεν είναι πλήρως κατανοητή. Ωστόσο, οι επιδημιολογικές μελέτες υποδηλώνουν αυξημένο κίνδυνο εμφάνισης ανεπιθύμητων ενεργειών σχετιζόμενων με την υπεργλυκαιμία σε ασθενείς που έλαβαν θεραπεία με τα άτυπα αντιψυχωσικά που περιλαμβάνονται σε αυτές τις μελέτες.
Οι ασθενείς με καθιερωμένη διάγνωση σακχαρώδους διαβήτη που ξεκινούν από άτυπα αντιψυχωσικά πρέπει να παρακολουθούνται τακτικά για επιδείνωση του ελέγχου της γλυκόζης. Οι ασθενείς με παράγοντες κινδύνου για σακχαρώδη διαβήτη (π.χ. παχυσαρκία, οικογενειακό ιστορικό διαβήτη) που αρχίζουν θεραπεία με τα άτυπα αντιψυχωσικά πρέπει να υποβάλλονται σε δοκιμασία γλυκόζης αίματος νηστείας στην αρχή της θεραπείας και περιοδικά κατά τη διάρκεια της θεραπείας θεραπευτική αγωγή. Οποιοσδήποτε ασθενής αντιμετωπίζεται με άτυπα αντιψυχωσικά πρέπει να παρακολουθείται για συμπτώματα υπεργλυκαιμίας, όπως πολυδιψία, πολυουρία, πολυφαγία και αδυναμία. Οι ασθενείς που αναπτύσσουν συμπτώματα υπεργλυκαιμίας κατά τη διάρκεια της θεραπείας με άτυπα αντιψυχωσικά πρέπει να υποβάλλονται σε δοκιμασία γλυκόζης αίματος νηστείας. Σε ορισμένες περιπτώσεις, η υπεργλυκαιμία έχει επιλυθεί όταν διακόπτεται το άτυπο αντιψυχωσικό. Ωστόσο, ορισμένοι ασθενείς χρειάστηκαν συνέχιση της αντιδιαβητικής θεραπείας παρά τη διακοπή του ύποπτου φαρμάκου.
Τα δεδομένα από μία μελέτη σταθερής δόσης 4 εβδομάδων σε ενήλικα άτομα με σχιζοφρένεια, στα οποία λήφθηκαν δείγματα αίματος νηστείας, παρουσιάζονται στον Πίνακα 1.
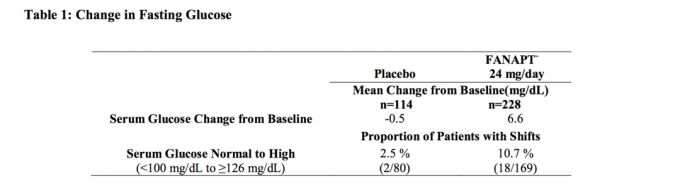
Οι συγκεντρωμένες αναλύσεις των δεδομένων γλυκόζης από κλινικές μελέτες, συμπεριλαμβανομένων των μακροπρόθεσμων δοκιμών, παρουσιάζονται στον Πίνακα 2.
Δυσλιπιδαιμία
Ανεπιθύμητες μεταβολές στα λιπίδια έχουν παρατηρηθεί σε ασθενείς που έλαβαν αγωγή με άτυπα αντιψυχωσικά.
Τα δεδομένα από ελεγχόμενη με εικονικό φάρμακο μελέτη 4 εβδομάδων σταθερής δόσης, στην οποία τραβήχτηκαν δείγματα αίματος νηστείας, σε ενήλικες ασθενείς με σχιζοφρένεια παρουσιάζονται στον Πίνακα 3.

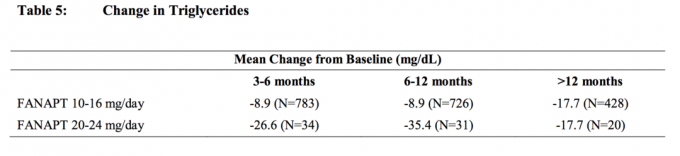
Οι συγκεντρωμένες αναλύσεις των δεδομένων χοληστερόλης και τριγλυκεριδίων από κλινικές μελέτες, συμπεριλαμβανομένων των μακροπρόθεσμων δοκιμών, παρουσιάζονται στον Πίνακα 4 και στον Πίνακα 5.

Αύξηση βάρους
Η αύξηση του σωματικού βάρους έχει παρατηρηθεί με άτυπη αντιψυχωσική χρήση. Συνιστάται κλινική παρακολούθηση του βάρους.
Σε όλες τις βραχυπρόθεσμες και μακροπρόθεσμες μελέτες, η συνολική μέση μεταβολή από την αρχική τιμή στο τελικό σημείο ήταν 2,1 kg.
Οι μεταβολές στο σωματικό βάρος (kg) και η αναλογία των ατόμων με ≥7% αύξηση στο σωματικό βάρος από 4 ελεγχόμενες με εικονικό φάρμακο, διάρκειας 4 ή 6 εβδομάδων, με σταθερή ή ευέλικτη δόση σε ενήλικες Πίνακας 6.

Επιληπτικές κρίσεις
Σε βραχυχρόνιες ελεγχόμενες με εικονικό φάρμακο μελέτες (4 έως 6 εβδομάδες), οι κρίσεις εμφανίστηκαν στο 0,1% (1/1344) των ασθενών που έλαβαν FANAPT σε σύγκριση με 0,3% (2/587) στο εικονικό φάρμακο. Όπως και με άλλα αντιψυχωσικά, το FANAPT θα πρέπει να χρησιμοποιείται με προσοχή σε ασθενείς με ιστορικό επιληπτικών κρίσεων ή με καταστάσεις που ενδεχομένως μειώνουν το κατώφλιο κρίσης. Οι συνθήκες που μειώνουν το κατώφλι επιληπτικών κρίσεων μπορεί να είναι συχνότερες σε πληθυσμό 65 ετών και άνω.
Ορθοστατική υπόταση και συγκοπή
Το FANAPT μπορεί να προκαλέσει ορθοστατική υπόταση που σχετίζεται με ζάλη, ταχυκαρδία και συγκοπή. Αυτό αντανακλά τις ιδιότητες του άλφα1-αδρενεργικού ανταγωνιστή. Σε διπλά τυφλές, ελεγχόμενες με εικονικό φάρμακο βραχυχρόνιες μελέτες, όπου η δόση αυξήθηκε αργά, όπως συνιστάται ανωτέρω, η συγκοπή αναφέρθηκε στο 0,4% (5/1344) των ασθενών που έλαβαν θεραπεία με FANAPT, σε σύγκριση με 0,2% (1/587) εικονικό φάρμακο. Η ορθοστατική υπόταση αναφέρθηκε στο 5% των ασθενών που έλαβαν 20-24 mg / ημέρα, στο 3% των ασθενών που έλαβαν 10-16 mg / ημέρα και στο 1% των ασθενών που έλαβαν εικονικό φάρμακο. Η ταχύτερη τιτλοδότηση θα αναμένεται να αυξήσει τον ρυθμό της ορθοστατικής υπότασης και της συγκοπής.
Το FANAPT πρέπει να χρησιμοποιείται με προσοχή σε ασθενείς με γνωστή καρδιαγγειακή νόσο (π.χ. καρδιακή ανεπάρκεια, ιστορικό εμφράγματος του μυοκαρδίου, ισχαιμία ή αγωγή ανωμαλίες), εγκεφαλοαγγειακή νόσο ή καταστάσεις που προδιαθέτουν τον ασθενή σε υπόταση (αφυδάτωση, υποογκαιμία και θεραπεία με αντιυπερτασικά φάρμακα). Θα πρέπει να εξετάζεται η παρακολούθηση ορθοστατικών ζωτικών σημείων σε ασθενείς που είναι ευάλωτοι σε υπόταση.
Λευκοπενία, ουδετεροπενία και ακοκκιοκυτταραιμία
Στην κλινική δοκιμή και στην εμπειρία μετά την κυκλοφορία του φαρμάκου, έχουν αναφερθεί περιστατικά λευκοπενίας / ουδετεροπενίας που σχετίζονται χρονικά με αντιψυχωσικούς παράγοντες. Έχει επίσης αναφερθεί ακοκκιοκυτταραιμία (συμπεριλαμβανομένων και θανατηφόρων περιστατικών).
Οι πιθανοί παράγοντες κινδύνου για λευκοπενία / ουδετεροπενία περιλαμβάνουν προϋπάρχοντα χαμηλό αριθμό λευκών αιμοσφαιρίων (WBC) και ιστορικό λευκοπενίας / ουδετεροπενίας που προκαλείται από φάρμακα. Ασθενείς με προϋπάρχουσα χαμηλή WBC ή με ιστορικό λευκοπενίας / ουδετεροπενίας που προκαλείται από φάρμακα θα πρέπει να παρακολουθούν τον πλήρη αριθμό αίματός τους (CBC) συχνά κατά τη διάρκεια των πρώτων μηνών θεραπείας και θα πρέπει να διακόψει το FANAPT κατά τα πρώτα σημάδια της μείωσης του WBC απουσία άλλου αιτιολογικού παραγόντων.
Οι ασθενείς με ουδετεροπενία θα πρέπει να παρακολουθούνται προσεκτικά για πυρετό ή άλλα συμπτώματα ή σημεία λοίμωξης και να θεραπεύονται αμέσως εάν εμφανιστούν τέτοια συμπτώματα ή σημεία. Ασθενείς με σοβαρή ουδετεροπενία (απόλυτος αριθμός ουδετερόφιλων <1000 / mm3) θα πρέπει να διακόψουν το FANAPT και να ακολουθήσουν την παρακολούθηση του WBC μέχρι την ανάρρωση.
Υπερπρολακτιναιμία
Όπως και με άλλα φάρμακα που ανταγωνίζονται τους υποδοχείς D2 της ντοπαμίνης, το FANAPT αυξάνει τα επίπεδα της προλακτίνης.
Η υπερπρολακτιναιμία μπορεί να καταστείλει την υποθαλαμική GnRH, με αποτέλεσμα την μειωμένη έκκριση της γοναδοτροπίνης της υπόφυσης. Αυτό, με τη σειρά του, μπορεί να εμποδίσει την αναπαραγωγική λειτουργία μειώνοντας τη γονιδιακή στεροειδογένεση τόσο σε γυναίκες όσο και σε άνδρες. Έχουν αναφερθεί γαλακτόρροια, αμηνόρροια, γυναικομαστία και ανικανότητα με ενώσεις που αυξάνουν την προλακτίνη. Η μακροχρόνια υπερπρολακτιναιμία όταν συνδυάζεται με υπογοναδισμό μπορεί να οδηγήσει σε μειωμένη οστική πυκνότητα τόσο σε γυναίκες όσο και σε άνδρες.
Τα πειράματα καλλιέργειας ιστών υποδεικνύουν ότι περίπου το ένα τρίτο των ανθρώπινων καρκίνων μαστού εξαρτάται από την προλακτίνη in vitro, α παράγοντα δυνητικής σημασίας εάν η συνταγογράφηση αυτών των φαρμάκων εξετάζεται σε έναν ασθενή με προηγουμένως ανιχνευόμενο μαστό Καρκίνος. Οι πολλαπλασιαστικές μεταβολές των θηλυκών αδένων και οι αυξήσεις της προλακτίνης στον ορό παρατηρήθηκαν σε ποντίκια και αρουραίους που υποβλήθηκαν σε αγωγή με FANAPT. Ούτε κλινικές μελέτες ούτε επιδημιολογικές μελέτες που έχουν διεξαχθεί μέχρι σήμερα έχουν δείξει συσχετισμό μεταξύ της χρόνιας χορήγησης αυτής της κατηγορίας φαρμάκων και της ογκογένεσης στους ανθρώπους. τα διαθέσιμα αποδεικτικά στοιχεία θεωρούνται πολύ περιορισμένα για να είναι πειστικά αυτή τη στιγμή.
Σε μια βραχυχρόνια ελεγχόμενη με εικονικό φάρμακο μελέτη (4 εβδομάδες), η μέση μεταβολή από την αρχική τιμή στο τελικό σημείο σε επίπεδα προλακτίνης στο πλάσμα για την ομάδα που έλαβε FANAPT 24 mg / ημέρα ήταν μια αύξηση των 2,6 ng / mL σε σύγκριση με μια μείωση των 6,3 ng / mL στην ομάδα εικονικού φαρμάκου. Σε αυτή τη δοκιμή παρατηρήθηκαν αυξημένα επίπεδα προλακτίνης στο πλάσμα στο 26% των ενηλίκων που έλαβαν θεραπεία με FANAPT σε σύγκριση με 12% στην ομάδα του εικονικού φαρμάκου. Στις βραχυχρόνιες μελέτες, το FANAPT συσχετίστηκε με μέτρια επίπεδα ανύψωσης προλακτίνης σε σύγκριση με τα μεγαλύτερα αυξημένα επίπεδα προλακτίνης που παρατηρήθηκαν με κάποιους άλλους αντιψυχωσικούς παράγοντες. Σε συγκεντρωτική ανάλυση από κλινικές μελέτες, συμπεριλαμβανομένων των μακροχρόνιων δοκιμών, σε 3210 ενήλικες που έλαβαν θεραπεία με iloperidone, η γυναικομαστία αναφέρθηκε σε 2 άνδρες (0,1%) σε σύγκριση με το 0% σε ασθενείς που έλαβαν εικονικό φάρμακο και η γαλαδόρεα αναφέρθηκε σε 8 θηλυκά άτομα (0,2%) σε σύγκριση με 3 θηλυκά άτομα (0,5%) σε εικονικό φάρμακο ασθενείς.
Κανονισμός θερμοκρασίας σώματος
Η διαταραχή της ικανότητας του σώματος να μειώνει τη θερμοκρασία του σώματος του πυρήνα έχει αποδοθεί σε αντιψυχωσικούς παράγοντες. Συνιστάται η δέουσα προσοχή κατά τη συνταγογράφηση του FANAPT για ασθενείς που αντιμετωπίζουν καταστάσεις οι οποίες μπορεί να συνεισφέρουν σε ανύψωση του πυρήνα του σώματος να ασκείται έντονα, να εκτίθεται σε υπερβολική θερμότητα, να δέχεται ταυτόχρονα φαρμακευτική αγωγή με αντιχολινεργική δραστικότητα ή να υπόκειται σε αφυδάτωση.
Δυσφαγία
Η οισοφαγική δυσκινητικότητα και η αναρρόφηση σχετίζονται με τη χρήση αντιψυχωσικού φαρμάκου. Η πνευμονία της αναρρόφησης είναι μια κοινή αιτία νοσηρότητας και θνησιμότητας σε ηλικιωμένους ασθενείς. Το FANAPT και άλλα αντιψυχωσικά φάρμακα πρέπει να χρησιμοποιούνται με προσοχή σε ασθενείς που διατρέχουν κίνδυνο πνευμονίας από αναρρόφηση.
Αυτοκτονία
Η πιθανότητα μιας προσπάθειας αυτοκτονίας είναι εγγενής στην ψυχωσική ασθένεια και η στενή παρακολούθηση των ασθενών με υψηλό κίνδυνο θα πρέπει να συνοδεύει τη φαρμακευτική θεραπεία. Οι προδιαγραφές για το FANAPT πρέπει να συντάσσονται για τη μικρότερη ποσότητα δισκίων που είναι σύμφωνες με την καλή διαχείριση των ασθενών, προκειμένου να μειωθεί ο κίνδυνος υπερδοσολογίας.
Πριαπισμός
Τρεις περιπτώσεις πριαπισμού αναφέρθηκαν στο πρόγραμμα FANAPT πριν από την κυκλοφορία του προϊόντος. Τα φάρμακα με αλφα-αδρενεργικά αποτελέσματα αποκλεισμού έχουν αναφερθεί ότι προκαλούν πριαπισμό. Το FANAPT μοιράζεται αυτή τη φαρμακολογική δραστηριότητα. Ο σοβαρός πριαπισμός μπορεί να απαιτεί χειρουργική επέμβαση.
Δυναμικό για γνωστικές και κινητικές βλάβες
Το FANAPT, όπως και άλλα αντιψυχωσικά, μπορεί να βλάψει την κρίση, τη σκέψη ή τις κινητικές δεξιότητες. Σε βραχυχρόνιες, ελεγχόμενες με εικονικό φάρμακο δοκιμές, η υπνηλία (συμπεριλαμβανομένης της καταστολής) αναφέρθηκε σε 11,9% (104/874) σε ενήλικες ασθενείς που έλαβαν θεραπεία με FANAPT σε δόσεις των 10 mg / ημέρα ή περισσότερο έναντι 5,3% (31/587) που έλαβαν θεραπεία εικονικό φάρμακο. Οι ασθενείς θα πρέπει να προειδοποιούνται για τη λειτουργία επικίνδυνων μηχανημάτων, συμπεριλαμβανομένων των αυτοκινήτων, μέχρις ότου είναι εύλογα βέβαιοι ότι η θεραπεία με το FANAPT δεν τους επηρεάζει δυσμενώς.
μπλουζα
Ανεπιθύμητες ενέργειες
Εμπειρία κλινικών μελετών
Επειδή οι κλινικές δοκιμές διεξάγονται υπό πολύ διαφορετικές συνθήκες, τα ποσοστά ανεπιθύμητων αντιδράσεων που παρατηρούνται στην κλινική δοκιμή ενός φαρμάκου δεν μπορεί να συγκριθεί άμεσα με τα ποσοστά στις κλινικές δοκιμές ενός άλλου φαρμάκου και μπορεί να μην αντικατοπτρίζει τους ρυθμούς που παρατηρούνται στο κλινικό πρακτική. Οι παρακάτω πληροφορίες προέρχονται από μια βάση δεδομένων κλινικών δοκιμών για το FANAPT που αποτελείται από 3229 ασθενείς που εκτέθηκαν στο FANAPT σε δόσεις των 10 mg / ημέρα ή περισσότερο, για τη θεραπεία της σχιζοφρένειας. Από αυτά, το 999 έλαβε FANAPT για τουλάχιστον 6 μήνες, με 657 άτομα να εκτεθούν στο FANAPT για τουλάχιστον 12 μήνες. Όλοι αυτοί οι ασθενείς που έλαβαν FANAPT συμμετείχαν σε κλινικές δοκιμές πολλαπλών δόσεων. Οι συνθήκες και η διάρκεια της θεραπείας με το FANAPT ποικίλλουν σε μεγάλο βαθμό και συμπεριλάμβαναν (σε επικαλυπτόμενες κατηγορίες), ανοιχτές και ανοικτές διπλά τυφλές φάσεις μελετών, νοσηλευόμενων και εξωτερικών ασθενών, μελέτες σταθερής δόσης και ευέλικτης δόσης και βραχυπρόθεσμες και μακροπρόθεσμες μελέτες έκθεση.
Οι πληροφορίες που παρουσιάζονται σε αυτές τις ενότητες προέρχονται από συγκεντρωτικά δεδομένα από 4 ελεγχόμενες με εικονικό φάρμακο, 4 ή 6 εβδομάδες, μελέτες σταθερής ή ευέλικτης δόσης σε ασθενείς που έλαβαν FANAPT σε ημερήσιες δόσεις που κυμαίνονταν από 10 έως 24 mg (η = 874).
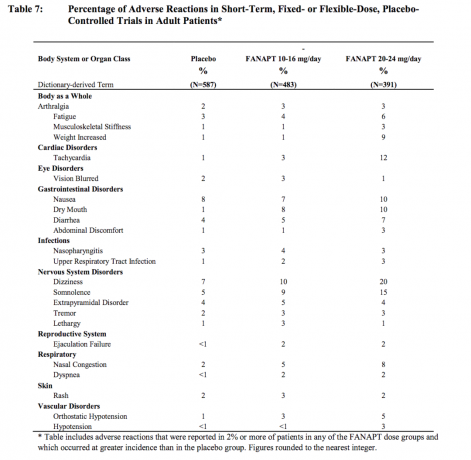
Ανεπιθύμητες αντιδράσεις που εμφανίστηκαν σε συχνότητα εμφάνισης 2% ή περισσότερο μεταξύ των ασθενών που έλαβαν θεραπεία με FANAPT και πιο συχνές από το εικονικό φάρμακο
Ο Πίνακας 7 απαριθμεί τις συγκεντρωτικές επιπτώσεις των ανεπιθύμητων ενεργειών που αναφέρθηκαν αυθόρμητα σε τέσσερις ελεγχόμενες με εικονικό φάρμακο, 4- ή 6-εβδομάδες, σε μελέτες σταθερής ή ευέλικτης δόσης, αναφέροντας τις αντιδράσεις που εμφανίστηκαν σε ποσοστό 2% ή περισσότερο των ασθενών που έλαβαν θεραπεία με FANAPT σε οποιαδήποτε από τις δόσεις και για τις οποίες η συχνότητα εμφάνισης σε ασθενείς που έλαβαν θεραπεία με FANAPT σε οποιαδήποτε ομάδα δόσης ήταν μεγαλύτερη από την συχνότητα εμφάνισης σε ασθενείς που έλαβαν θεραπεία με εικονικό φάρμακο.
Ανεπιθύμητες αντιδράσεις που σχετίζονται με τη δόση σε κλινικές δοκιμές
Με βάση τα συγκεντρωτικά δεδομένα από 4 μελέτες ελεγχόμενες με εικονικό φάρμακο, 4- ή 6 εβδομάδων, σταθερής ή εύκαμπτης δόσης, οι ανεπιθύμητες ενέργειες που εμφανίστηκαν με ποσοστό μεγαλύτερο από 2% συχνότητα εμφάνισης στους ασθενείς που έλαβαν θεραπεία με FANAPT και για τους οποίους η συχνότητα εμφάνισης σε ασθενείς που έλαβαν θεραπεία με FANAPT 20-24 mg / ημέρα ήταν οι ασθενείς που έλαβαν θεραπεία με FANAPT 10 -16 mg / ημέρα ήταν: κοιλιακή δυσφορία, ζάλη, υπόταση, μυοσκελετική δυσκαμψία, ταχυκαρδία και βάρος αυξήθηκε.
Συχνές και ανεπιθύμητες αντιδράσεις σχετιζόμενες με τα ναρκωτικά σε κλινικές δοκιμές
Με βάση τα συγκεντρωτικά δεδομένα από 4 μελέτες ελεγχόμενες με εικονικό φάρμακο, 4- ή 6 εβδομάδων, σταθερής ή εύκαμπτης δόσης, οι ακόλουθες ανεπιθύμητες ενέργειες εμφανίσθηκαν σε ≥ 5% επίπτωση στους ασθενείς που έλαβαν αγωγή με το FANAPT και τουλάχιστον με το διπλάσιο του εικονικού φαρμάκου για τουλάχιστον 1 δόση: ζάλη, ξηροστομία, κόπωση, ρινική συμφόρηση, υπνηλία, ταχυκαρδία, ορθοστατική υπόταση και βάρος αυξήθηκε. Η ζάλη, η ταχυκαρδία και η αύξηση του σωματικού βάρους ήταν τουλάχιστον δύο φορές πιο συνηθισμένες σε 20-24 mg / ημέρα όπως σε 10-16 mg / ημέρα.
Εξτραπυραμιδικά συμπτώματα (EPS) σε κλινικές δοκιμές
Τα συγκεντρωμένα δεδομένα από τις 4 ελεγχόμενες με εικονικό φάρμακο μελέτες, 4- ή 6-εβδομάδων, σταθερής ή εύκαμπτης δόσης έδωσαν πληροφορίες σχετικά με το EPS. Τα δεδομένα των ανεπιθύμητων ενεργειών που συλλέχθηκαν από αυτές τις μελέτες έδειξαν τα ακόλουθα ποσοστά ανεπιθύμητων συμβάντων που σχετίζονται με το EPS, όπως φαίνεται στον πίνακα 8.

Ανεπιθύμητες αντιδράσεις που σχετίζονται με τη διακοπή της θεραπείας σε κλινικές δοκιμές
Με βάση τα συγκεντρωτικά δεδομένα από 4 ελεγχόμενες με εικονικό φάρμακο, 4- ή 6-εβδομάδες, σταθερές ή ευέλικτες μελέτες χορήγησης, δεν υπήρχε η διαφορά στη συχνότητα διακοπής λόγω ανεπιθύμητων ενεργειών μεταξύ των ασθενών που έλαβαν θεραπεία με FANAPT (5%) και του εικονικού φαρμάκου (5%) ασθενείς. Οι τύποι ανεπιθύμητων συμβάντων που οδήγησαν στη διακοπή ήταν παρόμοιοι για τους ασθενείς που έλαβαν θεραπεία με FANAPT και εικονικό φάρμακο.
Δημογραφικές διαφορές στις ανεπιθύμητες αντιδράσεις σε κλινικές δοκιμές
Έλεγχος των υποομάδων πληθυσμού στις 4 ελεγχόμενες με εικονικό φάρμακο, 4- ή 6-εβδομάδες, σταθερές- ή οι μελέτες ευέλικτης δόσης δεν αποκάλυψαν καμία ένδειξη διαφορών όσον αφορά την ασφάλεια με βάση την ηλικία, φύλο ή φυλή.
Ανωμαλίες εργαστηριακών εξετάσεων σε κλινικές δοκιμές
Δεν υπήρξαν διαφορές μεταξύ του FANAPT και του εικονικού φαρμάκου στη συχνότητα διακοπής λόγω μεταβολών στην αιματολογία, στην ανάλυση ούρων ή στη χημεία του ορού.
Σε βραχυχρόνιες ελεγχόμενες με εικονικό φάρμακο μελέτες (4- έως 6 εβδομάδες), υπήρχαν ασθενείς με 1.0% (13/1342) ασθενείς που έλαβαν λοπεριδόνη με αιματοκρίτη τουλάχιστον μία φορά κάτω από την εκτεταμένη φυσιολογική περιοχή κατά τη διάρκεια της θεραπείας μετά από τυχαιοποίηση, σε σύγκριση με το 0,3% (2/585) εικονικό φάρμακο. Το εκτεταμένο φυσιολογικό εύρος για τον μειωμένο αιματοκρίτη καθορίστηκε σε κάθε μια από αυτές τις δοκιμές ως τιμή 15% κάτω από την κανονική κλίμακα για το κεντρικό εργαστήριο που χρησιμοποιήθηκε στη δοκιμή.
Άλλες αντιδράσεις κατά την αξιολόγηση πριν από την κυκλοφορία του FANAPT
Τα παρακάτω είναι ένας κατάλογος των όρων MedDRA που αντικατοπτρίζουν τις ανεπιθύμητες αντιδράσεις σε ασθενείς που έλαβαν θεραπεία με FANAPT σε πολλαπλές δόσεις ≥ 4 mg / ημέρα κατά τη διάρκεια οποιασδήποτε φάσης μιας δοκιμής με τη βάση δεδομένων των 3210 FANAPT που υποβλήθηκαν σε θεραπεία ασθενείς. Όλες οι αναφερόμενες αντιδράσεις περιλαμβάνονται εκτός από εκείνες που έχουν ήδη αναγραφεί στον Πίνακα 7 ή άλλα μέρη των Ανεπιθύμητων Αντιδράσεων (6), εκείνες που εξετάζονται στην Προειδοποιήσεις και προφυλάξεις (5), οι εν λόγω όροι αντίδρασης που ήταν τόσο γενικοί ώστε να μην είναι ενημερωτικοί, οι αντιδράσεις που αναφέρθηκαν σε λιγότερους από 3 ασθενείς και οι οποίες δεν ήταν ούτε σοβαρές ούτε θρησκευτικές, αντιδράσεις που είναι κατά τα άλλα κοινές ως αντιδράσεις υποβάθρου και αντιδράσεις που θεωρούνται απίθανο να είναι ναρκωτικές ουσίες σχετιζομαι με.
Οι αντιδράσεις κατηγοριοποιούνται περαιτέρω από την κατηγορία οργάνου συστήματος MedDRA και παρατίθενται κατά φθίνουσα συχνότητα σύμφωνα με τα παρακάτω ορισμοί: συχνές ανεπιθύμητες ενέργειες είναι αυτές που εμφανίζονται σε τουλάχιστον 1/100 ασθενείς (μόνο εκείνοι που δεν παρατίθενται στον Πίνακα 7 εμφανίζονται σε αυτό λίστα). ανεπαρκείς ανεπιθύμητες ενέργειες είναι εκείνες που εμφανίζονται σε 1/100 έως 1/1000 ασθενείς. σπάνια συμβάντα συμβαίνουν σε λιγότερους από 1/1000 ασθενείς.
Διαταραχές αίματος και λεμφικού συστήματος: Σπάνια αναιμία, αναιμία από ανεπάρκεια σιδήρου. Σπάνια λευκοπενία
Καρδιακές διαταραχές: Συχνές - αίσθημα παλμών. Σπάνιες - αρρυθμία, κολποκοιλιακός αποκλεισμός πρώτου βαθμού, καρδιακή ανεπάρκεια (συμπεριλαμβανομένης της συμφορητικής και οξείας)
Διαταραχές του αυτιού και του λαβυρίνθου: Σπάνιες - αδιαθεσία, εμβοές
Ενδοκρινικές διαταραχές: Σπάνιος-υποθυρεοειδισμός
Οφθαλμικές διαταραχές: Συχνές - επιπεφυκίτιδα (συμπεριλαμβανομένης της αλλεργίας). Συχνές - ξηροφθαλμία, βλεφαρίτιδα, οίδημα των βλεφάρων, οίδημα των οφθαλμών, φακοειδής αδιαφάνεια, καταρράκτης, υπεραιμία (συμπεριλαμβανομένου του επιπεφυκότος)
Διαταραχές του γαστρεντερικού: Σπάνιες - γαστρίτιδα, υπερέκκριση του σιελογόνου, ακράτεια κοπράνων, έλκος στο στόμα. Σπάνιες - αφθώδης στοματίτιδα, έλκος δωδεκαδακτύλου, κήλη διαλείμματος, υπερχλωρυδρία, έλκος χείλους, οισοφαγική παλινδρόμηση, στοματίτιδα
Γενικές διαταραχές και συνθήκες διοικητικού χώρου: Σπάνιες - οίδημα (γενική, κνησμώδης, λόγω καρδιακής νόσου), δυσκολία στο βάδισμα, δίψα. Σπάνια - υπερθερμία
Διαταραχές του ήπατος και των χοληφόρων: Σπάνια - χολολιθίαση
Έρευνες: Συχνές: μειωμένο βάρος. Συχνές - μειωμένη αιμοσφαιρίνη, αυξημένος αριθμός ουδετερόφιλων, μειωμένος αιματοκρίτης
Διαταραχές του μεταβολισμού και της διατροφής: Σπάνια - αυξημένη όρεξη, αφυδάτωση, υποκαλιαιμία, κατακράτηση υγρών
Διαταραχές του μυοσκελετικού συστήματος και του συνδετικού ιστού: Συχνές - μυαλγία, μυϊκοί σπασμοί. Σπάνια - ταρτικολλίς
Διαταραχές του νευρικού συστήματος: Σπάνια-παραισθησία, ψυχοκινητική υπερκινητικότητα, ανησυχία, αμνησία, νυσταγμός. Σπάνιο σύνδρομο ανήσυχων ποδιών
Ψυχιατρικές διαταραχές: Συχνές - ανησυχία, επιθετικότητα, ψευδαίσθηση. Σπάνια - εχθρότητα, μειωμένη λίμπιντο, παράνοια, ανοργάσμια, κατάσταση σύγχυσης, μανία, κατατονία, μεταβολές της διάθεσης, πανικός επίθεση, ιδεοψυχαναγκαστική διαταραχή, νευρική βουλιμία, παραλήρημα, ψυχογενής πολυδιψία, διαταραχή ελέγχου του παλμού, κατάθλιψη
Διαταραχές των νεφρών και των ουροφόρων οδών: Συχνή - ακράτεια ούρων. Σπάνια - δυσουρία, πολλακυρία, ενούρηση, νεφρολιθίαση; Σπάνια - κατακράτηση ούρων, οξεία νεφρική ανεπάρκεια
Διαταραχές του αναπαραγωγικού συστήματος και του μαστού: Συχνή - στυτική δυσλειτουργία. Έλλειψη - οσφυαλγία, αμηνόρροια, πόνος στο στήθος. Σπάνιες - μη φυσιολογική εμμηνόρροια, γυναικομαστία, μενεορρίαση, μετρουργία, μετεμμηνοπαυσιακή αιμορραγία, προστατίτιδα.
Διαταραχές του αναπνευστικού, του θώρακα και του μεσοθωρακίου: Σπάνιες - επίσταξη, άσθμα, ρινόρροια, συμφόρηση των κόλπων, ρινική ξηρότητα. Σπάνιες - ξηρό λαιμό, σύνδρομο άπνοιας ύπνου, δύσπνοια
Εμπειρία μετά την κυκλοφορία
Οι ακόλουθες ανεπιθύμητες ενέργειες εντοπίστηκαν κατά τη χρήση μετά την έγκριση του FANAPT: αντιδράσεις οπισθοδρομικής εκσπερμάτωσης και υπερευαισθησίας (συμπεριλαμβανομένης αναφυλαξίας, αγγειοοίδημα. σφίξιμο στο λαιμό? οροφαρυγγικό οίδημα. πρήξιμο του προσώπου, των χειλιών, του στόματος και της γλώσσας. κνίδωση; εξάνθημα; και κνησμός). Επειδή αυτές οι αντιδράσεις αναφέρθηκαν οικειοθελώς από πληθυσμό αβέβαιου μεγέθους, δεν είναι δυνατόν να εκτιμηθεί αξιόπιστα η συχνότητά τους ή να καθοριστεί αιτιώδης σχέση με την έκθεση του φαρμάκου.
μπλουζα
Αλληλεπιδράσεις με άλλα φάρμακα
Λόγω των πρωτογενών επιδράσεων του FANAPT στο ΚΝΣ, πρέπει να δίνεται προσοχή όταν λαμβάνεται σε συνδυασμό με άλλα φάρμακα και αλκοόλ με κεντρική δράση. Λόγω του ανταγωνισμού του - άλφα1-αδρενεργικού υποδοχέα, το FANAPT έχει τη δυνατότητα να ενισχύσει την επίδραση ορισμένων αντιυπερτασικών παραγόντων.
Δυνατότητα άλλων φαρμάκων να επηρεάσουν το FANAPT
Η λοπεριδόνη δεν αποτελεί υπόστρωμα για τα ένζυμα CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 ή CYP2E1. Αυτό υποδηλώνει ότι μια αλληλεπίδραση της λοπεριδόνης με αναστολείς ή επαγωγείς αυτών των ενζύμων ή άλλους παράγοντες, όπως το κάπνισμα, είναι απίθανο. Τόσο το CYP3A4 όσο και το CYP2D6 είναι υπεύθυνες για το μεταβολισμό της λοπεριδόνης. Οι αναστολείς του CYP3A4 (π.χ. κετοκοναζόλη) ή CYP2D6 (π.χ., φλουοξετίνη, παροξετίνη) μπορούν να αναστείλουν την απομάκρυνση της λοπεριδόνης και να προκαλέσουν αυξημένα επίπεδα στο αίμα.
Κετοκοναζόλη: Η συγχορήγηση κετοκοναζόλης (200 mg δύο φορές ημερησίως για 4 ημέρες), ενός ισχυρού αναστολέα του CYP3A4, με μία εφάπαξ δόση λοπεριδόνης των 3 mg σε 19 υγιείς εθελοντές, ηλικίας 18-45 ετών, αύξησαν την περιοχή κάτω από την καμπύλη (AUC) της λοπεριδόνης και των μεταβολιτών της P88 και P95 κατά 57%, 55% και 35% αντίστοιχα. Οι δόσεις της λοπεριδόνης θα πρέπει να μειώνονται περίπου κατά το ήμισυ όταν χορηγούνται με κετοκοναζόλη ή άλλους ισχυρούς αναστολείς του CYP3A4 (π.χ. ιτρακοναζόλη). Οι ασθενέστεροι αναστολείς (π.χ., ερυθρομυκίνη, χυμός γκρέιπφρουτ) δεν έχουν μελετηθεί. Όταν ο αναστολέας του CYP3A4 αποσυρθεί από τη θεραπεία συνδυασμού, η δόση της λοπεριδόνης πρέπει να επιστραφεί στο προηγούμενο επίπεδο.
Φλουοξετίνη: Η συγχορήγηση της φλουοξετίνης (20 mg δύο φορές την ημέρα για 21 ημέρες), ένας ισχυρός αναστολέας του CYP2D6, με μία μόνο δόση 3 mg iloperidone σε 23 υγιείς εθελοντές ηλικίας 29-44 ετών, που ταξινομήθηκαν ως εκτεταμένοι μεταβολιστές του CYP2D6, αύξησαν την AUC της λοπεριδόνης και του μεταβολίτη P88 κατά περίπου 2 έως 3 φορές και μείωσαν την AUC του μεταβολίτη P95 με μισό. Οι δόσεις της λοπεριδόνης θα πρέπει να μειώνονται κατά το ήμισυ όταν χορηγούνται με τη φλουοξετίνη. Όταν η φλουοξετίνη αποσύρεται από τη συνδυασμένη θεραπεία, η δόση της λοπεριδόνης θα πρέπει να επιστρέφει στο προηγούμενο επίπεδο. Άλλοι ισχυροί αναστολείς του CYP2D6 αναμένεται να έχουν παρόμοια αποτελέσματα και θα χρειαστούν κατάλληλες μειώσεις της δόσης. Όταν αναστέλλεται ο αναστολέας του CYP2D6 από τη συνδυασμένη θεραπεία, η δόση της λοπεριδόνης μπορεί στη συνέχεια να αυξηθεί στο προηγούμενο επίπεδο.
Παροξένη: Η συγχορήγηση παροξετίνης (20 mg / ημέρα για 5-8 ημέρες), ενός ισχυρού αναστολέα του CYP2D6, με πολλαπλές δόσεις λοπεριδόνης (8 ή 12 mg δύο φορές ημερησίως) σε ασθενείς με σχιζοφρένεια ηλικίας 18-65 ετών είχε ως αποτέλεσμα αυξημένες μέσες συγκεντρώσεις μέγιστης σταθερής κατάστασης η λοπεριδόνη και ο μεταβολίτης της P88, κατά περίπου 1,6 φορές, και μειώθηκαν οι μέσες σταθερές μέγιστες συγκεντρώσεις του μεταβολίτη P95 μισό. Οι δόσεις της λοπεριδόνης θα πρέπει να μειώνονται κατά το ήμισυ όταν χορηγούνται με παροξετίνη. Όταν η παροξετίνη αποσύρεται από τη συνδυασμένη θεραπεία, η δόση της λοπεριδόνης πρέπει να επιστραφεί στο προηγούμενο επίπεδο. Άλλοι ισχυροί αναστολείς του CYP2D6 αναμένεται να έχουν παρόμοια αποτελέσματα και θα χρειαστούν κατάλληλες μειώσεις της δόσης. Όταν ο αναστολέας του CYP2D6 αποσυρθεί από τη συνδυασμένη θεραπεία, η δόση της λοπεριδόνης θα μπορούσε στη συνέχεια να αυξηθεί σε προηγούμενα επίπεδα.
Παροξετίνη και Κετοκοναζόλη: Η συγχορήγηση παροξετίνης (20 mg μία φορά ημερησίως για 10 ημέρες), ενός αναστολέα του CYP2D6 και της κετοκοναζόλης (200 mg δύο φορές ημερησίως) με πολλαπλές δόσεις λοπεριδόνης (8 ή 12 mg δύο φορές ημερησίως) σε ασθενείς με σχιζοφρένεια ηλικίας 18-65 ετών οδήγησε σε 1,4 αύξηση των συγκεντρώσεων της ιλοπεριδόνης και του μεταβολίτη P88 σε σταθεροποιημένη κατάσταση και μείωση κατά 1,4 φορές του P95 παρουσία παροξετίνη. Έτσι, η χορήγηση της λοπεριδόνης με αναστολείς αμφοτέρων των μεταβολικών οδών της δεν προστέθηκε στην επίδραση είτε του αναστολέα χορηγούμενου μόνο του. Επομένως, οι δόσεις της λοπεριδόνης θα πρέπει να μειωθούν κατά περίπου το ήμισυ εάν χορηγηθούν ταυτόχρονα με αναστολέα του CYP2D6 και του CYP3A4.
Υπάρχει πιθανότητα το FANAPT να επηρεάσει άλλα φάρμακα
Μελέτες in vitro σε μικροσώματα ανθρώπινου ήπατος έδειξαν ότι η λοπεριδόνη δεν αναστέλλει ουσιαστικά το μεταβολισμό του φάρμακα που μεταβολίζονται από τα ακόλουθα ισοένζυμα του κυτοχρώματος P450: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 ή CYP2E1. Επιπλέον, μελέτες in vitro σε μικροσώματα ανθρώπινου ήπατος έδειξαν ότι η λοπεριδόνη δεν έχει επαγωγή ενζύμων ιδιότητες, ειδικά για τα ακόλουθα ισοένζυμα του κυτοχρώματος P450: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 και CYP3A5.
Dextromethorphan: Μια μελέτη σε υγιείς εθελοντές έδειξε ότι οι αλλαγές στη φαρμακοκινητική της δεξτρομεθορφάνης (δόση 80 mg) όταν δόθηκε δόση 3 mg η συγχορήγηση λοπεριδόνης είχε σαν αποτέλεσμα αύξηση της συνολικής έκθεσης κατά 17% και αύξηση κατά 26% των μέγιστων συγκεντρώσεων στο πλάσμα Cmax δεξτρομεθορφάνη. Συνεπώς, μια αλληλεπίδραση μεταξύ της λοπεριδόνης και άλλων υποστρωμάτων του CYP2D6 είναι απίθανη.
Φλουοξετίνη: Μία εφάπαξ δόση λοπεριδόνης 3 mg δεν είχε καμία επίδραση στη φαρμακοκινητική της φλουοξετίνης (20 mg δύο φορές ημερησίως).
Μιδαζολάμη (ευαίσθητο υπόστρωμα CYP 3Α4): Μία μελέτη σε ασθενείς με σχιζοφρένεια έδειξε αύξηση κάτω του 50% στο σύνολο της μιδαζολάμης η έκθεση σε ιλοπεριδόνη σε σταθερή κατάσταση (14 ημέρες από τη χορήγηση από το στόμα έως και 10 mg λοπεριδόνης δύο φορές ημερησίως) και καμία επίδραση στη μιδαζολάμη C Μέγιστη. Συνεπώς, μια αλληλεπίδραση μεταξύ της λοπεριδόνης και άλλων υποστρωμάτων του CYP3A4 είναι απίθανη.
Φάρμακα που παρατείνουν το διάστημα QT Το FANAPT δεν θα πρέπει να χρησιμοποιείται με άλλα φάρμακα που παρατείνουν το διάστημα QT.
μπλουζα
Χρήση σε συγκεκριμένους πληθυσμούς
Μητρώο έκθεσης εγκυμοσύνης
Υπάρχει ένα μητρώο έκθεσης εγκυμοσύνης που παρακολουθεί τα αποτελέσματα της εγκυμοσύνης σε γυναίκες που εκτίθενται στο FANAPT κατά τη διάρκεια της εγκυμοσύνης. Για περισσότερες πληροφορίες επικοινωνήστε με το Εθνικό Μητρώο Εγκυμοσύνης για Ατυπικά Αντιψυχωσικά στο 1-866-961-2388 ή επισκεφθείτε http://womensmentalhealth.org/clinical-and -η έρευνα-προγράμματα / εγκυμοσύνηregistry /.
Σύνοψη κινδύνου
Τα νεογνά των οποίων οι μητέρες εκτίθενται σε αντιψυχωσικά φάρμακα, συμπεριλαμβανομένου του FANAPT, κατά τη διάρκεια του τρίτου τριμήνου της εγκυμοσύνης διατρέχουν κίνδυνο για συμπτώματα εξωπυραμιδικής και / ή στέρησης μετά την παράδοση. Τα περιορισμένα διαθέσιμα δεδομένα με το FANAPT σε έγκυες γυναίκες δεν επαρκούν για να ενημερώσουν τον σχετιζόμενο με τα ναρκωτικά κίνδυνο για μείζονες γενετικές ανωμαλίες και αποβολές. Η λοπεριδόνη δεν ήταν τερατογόνος όταν χορηγήθηκε από το στόμα σε εγκύους αρουραίους κατά τη διάρκεια οργανογένεσης σε δόσεις έως και 26 φορές τη μέγιστη συνιστώμενη ανθρώπινη δόση των 24 mg / ημέρα σε mg / m2. Ωστόσο, παρατάθηκε η διάρκεια της εγκυμοσύνης και του τοκετού, οι αυξημένες γεννήσεις, οι πρώιμοι ενδομήτριοι θάνατοι, η αυξημένη συχνότητα εμφάνισης αναπτυξιακών καθυστερήσεων και η μείωση της επιβίωσης του κουταβιού μετά τον τοκετό. Η λοπεριδόνη δεν ήταν τερατογόνος όταν χορηγήθηκε από το στόμα σε έγκυα κουνέλια κατά τη διάρκεια της οργανογένεσης σε δόσεις έως και 20 φορές την MRHD σε mg / m2 βάση. Ωστόσο, αύξησε τον πρώιμο ενδομήτριο θάνατο και μείωσε τη βιωσιμότητα του εμβρύου στη διάρκεια της μέγιστης δόσης που ήταν επίσης δόση τοξική για τη μητέρα.
Ο βασικός κίνδυνος για μείζονες γενετικές ανωμαλίες και αποβολές για τον ενδεικνυόμενο πληθυσμό είναι άγνωστος. Στον γενικό πληθυσμό των Η.Π.Α., ο εκτιμώμενος κίνδυνος υποβάθρου για μείζονες γενετικές ανωμαλίες και αποβολές σε κλινικά αναγνωρισμένες εγκυμοσύνες είναι 2-4% και 15-20% αντίστοιχα.
Κλινικές εκτιμήσεις
Ανεπιθύμητες αντιδράσεις εμβρύου / νεογνών
Εξωπυραμιδικά και / ή συμπτώματα στέρησης, συμπεριλαμβανομένης της διέγερσης, υπερτονίας, υποτονίας, τρόμου, υπνηλίας, αναπνευστικής δυσφορίας και διαταραχές διατροφής έχουν αναφερθεί σε νεογνά των οποίων οι μητέρες εκτέθηκαν σε αντιψυχωσικά φάρμακα κατά τη διάρκεια του τρίτου τριμήνου του εγκυμοσύνη. Αυτά τα συμπτώματα έχουν ποικίλη σοβαρότητα. Ορισμένα νεογνά ανακτώνται εντός ωρών ή ημερών χωρίς ειδική θεραπεία. άλλοι χρειάστηκαν παρατεταμένη νοσηλεία. Παρακολουθήστε νεογνά για εξωπυραμιδικά και / ή συμπτώματα απόσυρσης και διαχειριστείτε κατάλληλα τα συμπτώματα.
Δεδομένα
Στοιχεία για τα ζώα
Σε μια μελέτη εμβρυϊκής ανάπτυξης, οι εγκύους αρουραίοι έλαβαν 4, 16 ή 64 mg / kg / ημέρα (1,6, 6,5 και 26 φορές μέγιστη συνιστώμενη δόση σε ανθρώπους (MRHD) 24 mg / ημέρα σε mg / m2) από την λοπεριδόνη από το στόμα κατά την περίοδο οργανογένεση. Η υψηλότερη δόση προκάλεσε αυξημένο πρόωρο ενδομήτριο θάνατο, μειωμένο βάρος και μήκος εμβρύου, η μειωμένη οστεοποίηση του σκελετικού εμβρύου και η αυξημένη συχνότητα εμφάνισης ελάσσονος εμβρυϊκής σκελετικής ανωμαλίας και παραλλαγές · αυτή η δόση προκάλεσε επίσης μειωμένη κατανάλωση μητρικής τροφής και αύξηση βάρους.
Σε μια μελέτη ανάπτυξης εμβρύου-εμβρύου χορηγήθηκαν σε έγκυες κουνέλια 4, 10 ή 25 mg / kg / ημέρα (3, 8 και 20 φορές το MRHD σε βάση mg / m2) της λοπεριδόνης κατά την περίοδο της οργανογένεσης. Η υψηλότερη δόση προκάλεσε αυξημένους πρώιμους ενδομήτριους θανάτους και μειωμένη βιωσιμότητα του εμβρύου στο διάστημα. αυτή η δόση προκάλεσε επίσης τη μητρική τοξικότητα.
Σε επιπρόσθετες μελέτες στις οποίες οι αρουραίοι έλαβαν λοπεριδόνη σε δόσεις παρόμοιες με τις παραπάνω ξεκινώντας είτε από προ-σύλληψη είτε από η 17η ημέρα της κύησης και η συνέχιση του απογαλακτισμού, οι ανεπιθύμητες ενέργειες αναπαραγωγής περιλαμβάνουν παρατεταμένη εγκυμοσύνη και τοκετό, αυξημένες τα ποσοστά θνησιγένειας, η αυξημένη συχνότητα εμβρυϊκών σπλαγχνικών διακυμάνσεων, τα μειωμένα βάρη των εμβρύων και των νεογνών και το μειωμένο κουτάβι μετά τον τοκετό επιβίωση. Δεν υπήρξαν φαρμακευτικές επιδράσεις στη νευροαναπνευστική ή αναπαραγωγική ανάπτυξη των επιζώντων νεογνών. Οι δόσεις χωρίς επιπτώσεις κυμαίνονταν από 4 έως 12 mg / kg, εκτός από την αύξηση των ποσοστών θνησιγόνων γεννητικών οργάνων που παρατηρήθηκαν στη χαμηλότερη δοσολογία των 4 mg / kg, δηλαδή 1,6 φορές την MRHD σε mg / m2. Η τοξικότητα της μητέρας παρατηρήθηκε στις υψηλότερες δόσεις στις μελέτες αυτές.
Ο μεταβολίτης της λοπεριδόνης P95, ο οποίος αποτελεί μείζον κυκλοφορούντα μεταβολίτη της λοπεριδόνης στους ανθρώπους αλλά δεν σημαντικές ποσότητες σε αρουραίους, δόθηκε σε εγκύους αρουραίους κατά την περίοδο οργανογένεσης σε από του στόματος δόσεις των 20, 80 ή 200 mg kg / ημέρα. Δεν παρατηρήθηκαν τερατογόνες επιδράσεις. Η καθυστερημένη σκελετική οστεοποίηση εμφανίστηκε σε όλες τις δόσεις. Δεν υπήρξε σημαντική μητρική τοξικότητα. Τα επίπεδα πλάσματος του P95 (AUC) στην υψηλότερη δόση που δοκιμάστηκε ήταν 2 φορές υψηλότερα από αυτά των ανθρώπων που έλαβαν MRHD της λοπεριδόνης.
Γαλουχιά
Σύνοψη κινδύνου
Δεν υπάρχουν πληροφορίες σχετικά με την παρουσία της λοπεριδόνης ή των μεταβολιτών της στο ανθρώπινο γάλα τα αποτελέσματα της λοπεριδόνης σε ένα θηλασμένο παιδί, ούτε τα αποτελέσματα της λοπεριδόνης στο ανθρώπινο γάλα παραγωγή. Η λοπεριδόνη είναι παρούσα στο γάλα των αρουραίων. Λόγω της πιθανότητας σοβαρών ανεπιθύμητων ενεργειών σε βρέφη που θηλάζουν, συμβουλεύστε μια γυναίκα να μην θηλάζει κατά τη διάρκεια της θεραπείας με το FANAPT.
Δεδομένα Η μετάθεση της ραδιενέργειας στο γάλα των θηλαστικών αρουραίων ερευνήθηκε μετά από μία δόση [14C] λοπεριδόνης στα 5 mg / kg. Η συγκέντρωση της ραδιενέργειας στο γάλα στις 4 ώρες μετά τη χορήγηση δόσης ήταν σχεδόν 10 φορές μεγαλύτερη από εκείνη του πλάσματος την ίδια στιγμή. Ωστόσο, 24 ώρες μετά τη δοσολόγηση, οι συγκεντρώσεις ραδιενέργειας στο γάλα είχαν πέσει σε τιμές ελαφρώς χαμηλότερες από το πλάσμα. Το μεταβολικό προφίλ στο γάλα ήταν ποιοτικά παρόμοιο με αυτό στο πλάσμα.
Παιδιατρική χρήση Η ασφάλεια και η αποτελεσματικότητα σε παιδιατρικούς και εφήβους ασθενείς δεν έχουν τεκμηριωθεί.
Γηριατρική χρήση
Οι κλινικές μελέτες του FANAPT για τη θεραπεία της σχιζοφρένειας δεν περιελάμβαναν επαρκείς αριθμούς ασθενείς ηλικίας 65 ετών και άνω για να διαπιστωθεί αν ανταποκρίνονται διαφορετικά από τους νεότερους ενήλικες ασθενείς. Από τους 3210 ασθενείς που έλαβαν θεραπεία με FANAPT σε μελέτες πριν από τη διάθεση στην αγορά, 25 (0,5%) ήταν ηλικίας ≥ 65 ετών και δεν υπήρχαν ασθενείς ηλικίας ≥75 ετών.
Οι ηλικιωμένοι ασθενείς με ψυχώση σχετιζόμενη με άνοια που λαμβάνουν θεραπεία με FANAPT διατρέχουν αυξημένο κίνδυνο θανάτου σε σύγκριση με το εικονικό φάρμακο. Το FANAPT δεν έχει εγκριθεί για τη θεραπεία ασθενών με ψύχωση που σχετίζεται με άνοια.
Νεφρική δυσλειτουργία
Επειδή το FANAPT μεταβολίζεται σημαντικά, με λιγότερο από το 1% του φαρμάκου που απεκκρίνεται αμετάβλητο, μόνο η νεφρική ανεπάρκεια είναι απίθανο να έχει σημαντική επίδραση στη φαρμακοκινητική του FANAPT. Η νεφρική δυσλειτουργία (κάθαρση κρεατινίνης <30 mL / min) είχε ελάχιστη επίδραση στη Cmax της λοπεριδόνης (χορηγούμενη σε μία μόνο δόση των 3 mg) και των μεταβολιτών της P88 και P95 σε οποιοδήποτε από τα 3 αναλυθέντα δείγματα. Η AUC0- ∞ αυξήθηκε κατά 24%, μειώθηκε κατά 6% και αυξήθηκε κατά 52% για τη λοπεριδόνη, P88 και P95, αντίστοιχα, σε άτομα με νεφρική δυσλειτουργία.
Ηπατική ανεπάρκεια
Δεν απαιτείται προσαρμογή της δόσης στο FANAPT σε ασθενείς με ήπια ηπατική ανεπάρκεια. Οι ασθενείς με μέτρια ηπατική δυσλειτουργία ενδέχεται να απαιτούν μείωση της δόσης. Το FANAPT δεν συνιστάται σε ασθενείς με σοβαρή ηπατική δυσλειτουργία.
Σε ενήλικες ασθενείς με ήπια ηπατική δυσλειτουργία δεν παρατηρήθηκε σχετική διαφορά στη φαρμακοκινητική της λοπεριδόνης, Ρ88 ή Ρ95 (ολική ή μη) σε σύγκριση με τους υγιείς ενήλικες μάρτυρες. Σε άτομα με μέτρια ηπατική δυσλειτουργία, υψηλότερη (2 φορές) και πιο μεταβλητή ελεύθερη έκθεση στους ενεργούς μεταβολίτες Ρ88 ήταν παρατηρήθηκε σύγκριση με τους υγιείς μάρτυρες, ενώ η έκθεση σε λοπεριδόνη και P95 ήταν γενικά παρόμοια (λιγότερο από 50% αλλαγή σε σύγκριση με έλεγχος). Δεδομένου ότι δεν έχει διεξαχθεί μελέτη για σοβαρά άτομα με ηπατική δυσλειτουργία, το FANAPT δεν συνιστάται σε ασθενείς με σοβαρή ηπατική δυσλειτουργία.
Κατάσταση καπνίσματος
Με βάση μελέτες in vitro που χρησιμοποιούν ανθρώπινα ηπατικά ένζυμα, το FANAPT δεν αποτελεί υπόστρωμα για το CYP1A2. Συνεπώς, το κάπνισμα δεν πρέπει να έχει επίδραση στη φαρμακοκινητική του FANAPT.
Εγκυμοσύνη
μπλουζα
Κατάχρηση ναρκωτικών και εξάρτηση
Ελεγχόμενη ουσία
Το FANAPT δεν είναι ελεγχόμενη ουσία.
Κατάχρηση
Το FANAPT δεν έχει μελετηθεί συστηματικά σε ζώα ή ανθρώπους για τις πιθανότητες κατάχρησης, ανοχής ή φυσικής εξάρτησης. Ενώ οι κλινικές δοκιμές δεν αποκάλυψαν καμία τάση για συμπεριφορά αναζήτησης ναρκωτικών, αυτές οι παρατηρήσεις δεν ήταν συστηματικές και δεν είναι δυνατόν να εκτιμήσει βάσει αυτής της εμπειρίας τον βαθμό στον οποίο ένα ενεργό φάρμακο του ΚΝΣ, το FANAPT, θα χρησιμοποιηθεί, θα εκτραπεί ή / και θα κακοποιηθεί μία φορά εμπορεύεται. Κατά συνέπεια, οι ασθενείς θα πρέπει να αξιολογούνται προσεκτικά για ιστορικό κατάχρησης ναρκωτικών και οι ασθενείς αυτοί πρέπει να είναι παρατηρείται στενά για ενδείξεις κατάχρησης ή κατάχρησης του FANAPT (π.χ. ανάπτυξη ανοχής, αύξηση της δόσης, αναζήτηση φαρμάκων η ΣΥΜΠΕΡΙΦΟΡΑ).
μπλουζα
Υπερδοσολογία
Η ανθρώπινη εμπειρία
Στις δοκιμές πριν από την κυκλοφορία, στις οποίες συμμετείχαν περισσότεροι από 3210 ασθενείς, η τυχαία ή εκ προθέσεως υπερδοσολογία του FANAPT ήταν τεκμηριώθηκε σε 8 ασθενείς που κυμαίνονταν από 48 mg έως 576 mg που ελήφθησαν ταυτόχρονα και 292 mg ελήφθησαν σε μια 3-ημέρα περίοδος. Δεν αναφέρθηκαν θάνατοι από αυτές τις περιπτώσεις. Η μεγαλύτερη επιβεβαιωμένη μοναδική κατάποση του FANAPT ήταν 576 mg. δεν παρατηρήθηκαν δυσμενείς φυσικές επιδράσεις για αυτόν τον ασθενή. Η επόμενη μεγαλύτερη επιβεβαιωμένη κατάποση του FANAPT ήταν 438 mg σε διάστημα 4 ημερών. εξωπυραμιδικά συμπτώματα και ένα διάστημα QTc των 507 msec αναφέρθηκαν για αυτόν τον ασθενή χωρίς καρδιακό επακόλουθο. Αυτός ο ασθενής συνέχισε τη θεραπεία με το FANAPT για επιπλέον 11 μήνες.
Γενικά, τα αναφερθέντα σημεία και συμπτώματα ήταν αυτά που προέκυψαν από την υπερβολή των γνωστών φαρμακολογικών αποτελεσμάτων (π.χ. υπνηλία και καταστολή, ταχυκαρδία και υπόταση) του FANAPT.
Διαχείριση υπερδοσολογίας
Δεν υπάρχει ειδικό αντίδοτο για το FANAPT. Επομένως, πρέπει να θεσπιστούν κατάλληλα υποστηρικτικά μέτρα. Σε περίπτωση οξείας υπερδοσολογίας, ο ιατρός πρέπει να δημιουργήσει και να διατηρήσει έναν αεραγωγό και να εξασφαλίσει επαρκή οξυγόνωση και αερισμό. Θα πρέπει να λαμβάνεται υπόψη η πλύση στομάχου (μετά από τη διασωλήνωση, αν ο ασθενής είναι ασυνείδητος) και η χορήγηση ενεργού άνθρακα μαζί με καθαρτικό. Η πιθανότητα σπασίματος, επιληπτικών κρίσεων ή δυστονικής αντίδρασης της κεφαλής και του αυχένα μετά από υπερδοσολογία μπορεί να δημιουργήσει κίνδυνο αναρρόφησης με επαγόμενη έμεση. Η καρδιαγγειακή παρακολούθηση θα πρέπει να ξεκινά αμέσως και θα πρέπει να περιλαμβάνει συνεχή παρακολούθηση ΗΚΓ για τον εντοπισμό πιθανών αρρυθμιών. Εάν χορηγηθεί αντιαρρυθμική θεραπεία, δεν πρέπει να χρησιμοποιηθούν δισοπυραμίδη, προκαϊναμίδη και κινιδίνη, καθώς έχουν τη δυνατότητα επιπτώσεων επιμήκυνσης του QT που μπορεί να είναι προσθετικές σε εκείνες του FANAPT. Παρομοίως, είναι λογικό να αναμένεται ότι οι ιδιότητες δέσμευσης του άλγους του bretylium ενδέχεται να είναι προσθετικές σε εκείνες του FANAPT, με αποτέλεσμα την προβληματική υπόταση. Η υπόταση και η κατάρρευση του κυκλοφορικού συστήματος θα πρέπει να αντιμετωπίζονται με κατάλληλα μέτρα όπως ενδοφλέβια υγρά ή συμπαθομιμητικά μέσα (η επινεφρίνη και η ντοπαμίνη δεν πρέπει να χρησιμοποιούνται, καθώς η βήτα διέγερση μπορεί να επιδεινώσει την υπόταση κατά τη ρύθμιση των επαγόμενων από το FANAPT άλφα αποκλεισμός). Σε περιπτώσεις σοβαρών εξωπυραμιδικών συμπτωμάτων, θα πρέπει να χορηγείται αντιχολινεργική φαρμακευτική αγωγή. Η στενή ιατρική παρακολούθηση θα πρέπει να συνεχιστεί μέχρι να ανακάμψει ο ασθενής.
μπλουζα
Περιγραφή
Το FANAPT είναι ένα άτυπο αντιψυχωτικό που ανήκει στη χημική κατηγορία των παραγώγων πιπεριδινυλ-βενζισοξαζόλης. Η χημική του ονομασία είναι η 4 '- [3- [4- (6-φθορο-1,2-βενζισοξαζολ-3-υλ) πιπεριδινο] προποξυ] -3'-μεθοξυακετοφαινόνη. Ο μοριακός του τύπος είναι C24H27FN2O4 και το μοριακό βάρος του είναι 426,48. Ο δομικός τύπος είναι:
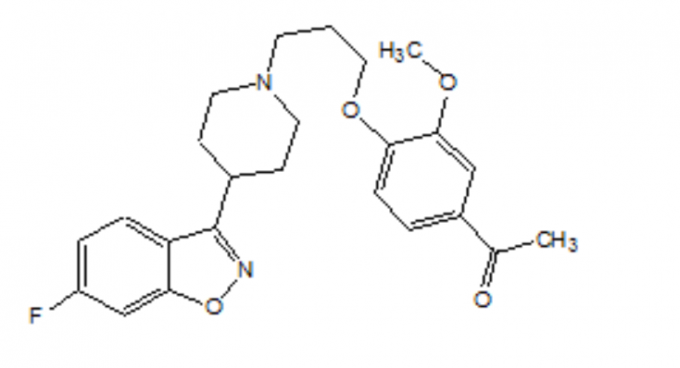
Η λοπεριδόνη είναι μία λευκή έως υπόλευκη λεπτώς κρυσταλλική σκόνη. Είναι πρακτικά αδιάλυτο στο νερό, πολύ ελαφρώς διαλυτό σε 0,1 Ν HCl και ελεύθερα διαλυτό σε χλωροφόρμιο, αιθανόλη, μεθανόλη και ακετονιτρίλιο.
Τα δισκία FANAPT προορίζονται μόνο για χορήγηση από το στόμα. Κάθε γύρος, χωρίς επικάλυψη
Το δισκίο περιέχει 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg ή 12 mg λοπεριδόνης. Τα ανενεργά συστατικά είναι: μονοϋδρική λακτόζη, μικροκρυσταλλική κυτταρίνη, υδροξυπροπυλμεθυλκυτταρίνη, κροσποβιδόνη, στεατικό μαγνήσιο, κολλοειδές πυρίτιο
διοξείδιο και καθαρό νερό (αφαιρείται κατά τη διάρκεια της επεξεργασίας). Τα δισκία είναι λευκά, στρογγυλά, επίπεδη, λοξότμητα και ταυτοποιημένα με λογότυπο "" που φέρει την ετικέτα "" 1 "," 2 "," 4 "," 6 "," 8 "," 10 " ή "12" στην άλλη πλευρά.
μπλουζα
Κλινική Φαρμακολογία
Μηχανισμός δράσης
Ο μηχανισμός δράσης της λοπεριδόνης στη σχιζοφρένεια είναι άγνωστος. Ωστόσο, η αποτελεσματικότητα της λοπεριδόνης θα μπορούσε να επιτευχθεί μέσω ενός συνδυασμού ανταγωνιστή τύπου ντοπαμίνης 2 (D2) και σεροτονίνης τύπου 2 (5-ΗΤ2).
Η λοπεριδόνη σχηματίζει έναν ενεργό μεταβολίτη, Ρ88, ο οποίος έχει in vitro προφίλ δέσμευσης υποδοχέα παρόμοιο με το γονικό φάρμακο.
Φαρμακοδυναμική
Η λοπεριδόνη δρα ως ανταγωνιστής με υψηλή συγγένεια συγγένειας (ηΜ) με την σεροτονίνη 5-ΗΤ2Α ντοπαμίνη D2 και Υποδοχείς D3 και νορεπινεφρίνης NEa1 (τιμές Κι 5,6, 6,3, 7,1 και 0,36 ηΜ, αντίστοιχα). Η ελοπεριδόνη έχει μέτρια συγγένεια για ντοπαμίνη D4 και υποδοχείς σεροτονίνης 5-ΗΤ6 και 5-ΗΤ7 (τιμές Κί 25, 43 και 22, ηΜ αντιστοίχως) και χαμηλή συγγένεια για τους υποδοχείς σεροτονίνης 5-ΗΤ1Α, ντοπαμίνης D1 και ισταμίνης Η1 (τιμές Κι 168, 216 και 437 ηΜ, αντίστοιχα). Η λοπεριδόνη δεν έχει αξιόλογη συγγένεια (Ki> 1000 ηΜ) για τους χολινεργικούς μουσκαρινικούς υποδοχείς. Η συγγένεια του μεταβολίτη λοπεριδόνης Ρ88 είναι γενικά ίση ή μικρότερη από εκείνη της μητρικής ένωσης, ενώ ο μεταβολίτης Ρ95 δείχνει συγγένεια για υποδοχείς 5-ΗΤ2Α (τιμή Κί 3,91) και ΝΕα1Α, NEa1B, NEa1D και ΝΕα2C (τιμές Κι 4.7, 2.7, 8.8 και 4.7 ηΜ αντίστοιχα).
Φαρμακοκινητική
Οι παρατηρούμενες μέσες ημιζωες αποβολής για τη λοπεριδόνη, P88 και P95 στους εκτεταμένους μεταβολιστές του CYP2D6 (EM) είναι 18, 26 και 23 ώρες, αντίστοιχα, και σε ασθενείς μεταβολιστές (PM) είναι 33, 37 και 31 ώρες, αντίστοιχα. Οι συγκεντρώσεις σε σταθερή κατάσταση επιτυγχάνονται εντός 3-4 ημερών από τη χορήγηση της δόσης. Η συσσώρευση ιλοπεριδόνης είναι προβλέψιμη από τη φαρμακοκινητική μιας δόσης. Η φαρμακοκινητική της λοπεριδόνης είναι μεγαλύτερη από την αναλογία της δόσης. Η αποβολή της λοπεριδόνης είναι κυρίως μέσω του ηπατικού μεταβολισμού που περιλαμβάνει 2 ισοένζυμα Ρ450, CYP2D6 και CYP3A4.
Απορρόφηση: Η λοπεριδόνη απορροφάται καλά μετά τη χορήγηση του δισκίου με μέγιστες συγκεντρώσεις στο πλάσμα που εμφανίζονται εντός 2 έως 4 ωρών. ενώ η σχετική βιοδιαθεσιμότητα του σκευάσματος δισκίων σε σύγκριση με το πόσιμο διάλυμα είναι 96%. Η χορήγηση της λοπεριδόνης με ένα πρότυπο γεύμα υψηλής περιεκτικότητας σε λιπαρά δεν επηρέασε σημαντικά τη Cmax ή την AUC της λοπεριδόνης, της P88 ή της Ρ95, αλλά καθυστέρησε την Tmax κατά 1 ώρα για τη λοπεριδόνη, 2 ώρες για την P88 και 6 ώρες για P95. Το FANAPT μπορεί να χορηγηθεί ανεξάρτητα από τα γεύματα.
Κατανομή: Η ελοπεριδόνη έχει εμφανή κάθαρση (κάθαρση / βιοδιαθεσιμότητα) 47 έως 102 L / h, με φαινόμενο όγκο κατανομής 1340-2800 L. Σε θεραπευτικές συγκεντρώσεις, το μη δεσμευμένο κλάσμα της λοπεριδόνης στο πλάσμα είναι ~ 3% και από κάθε μεταβολίτη (P88 και P95) είναι ~ 8%.
Μεταβολισμός και εξάλειψη: Η ελοπεριδόνη μεταβολίζεται κυρίως με τρεις οδούς βιομετατροπής: αναγωγή καρβονυλίου, υδροξυλίωση (με τη μεσολάβηση του CYP2D6) και Ο-απομεθυλίωση (διαμεσολαβούμενη από το CYP3A4). Υπάρχουν 2 κυρίαρχοι μεταβολίτες ιλοπεριδόνης, Ρ95 και Ρ88. Ο μεταβολίτης της λοπεριδόνης P95 αντιπροσωπεύει 47,9% της AUC της λοπεριδόνης και των μεταβολιτών της στο πλάσμα σε σταθερή κατάσταση για εκτεταμένους μεταβολιστές (EM) και 25% για τους φτωχούς μεταβολιστές (PM). Ο ενεργός μεταβολίτης Ρ88 αντιπροσωπεύει το 19,5% και το 34,0% της συνολικής έκθεσης στο πλάσμα σε ΗΜ και ΜΜ αντίστοιχα.
Περίπου 7% -10% των Καυκάσιων και 3% -8% των μαύρων / Αφρικανών Αμερικανών στερούνται την ικανότητα να μεταβολίζουν το CYP2D6 υποστρώματα και ταξινομούνται ως κακοί μεταβολιστές (PM), ενώ οι υπόλοιποι είναι ενδιάμεσοι, εκτεταμένοι ή υπερτασικοί μεταβολιστές. Η συγχορήγηση του FANAPT με γνωστούς ισχυρούς αναστολείς του CYP2D6 όπως η φλουοξετίνη έχει ως αποτέλεσμα 2,3 φορές αύξηση της έκθεσης σε ιλοπεριδόνη στο πλάσμα και κατά συνέπεια το ήμισυ της δόσης του FANAPT πρέπει να είναι χορηγείται.
Παρομοίως, τα PMs του CYP2D6 έχουν υψηλότερη έκθεση σε λοπεριδόνη σε σύγκριση με τα EMs και οι ΡΜ θα πρέπει να μειώσουν τη δόση τους κατά το ήμισυ. Υπάρχουν εργαστηριακές δοκιμές για τον εντοπισμό των CYP2D6 PMs.
Ο όγκος των ραδιενεργών υλικών ανακτήθηκε στα ούρα (μέσος όρος 58,2% και 45,1% σε ΕΜ και ΡΜ, αντίστοιχα), με κόπρανα που αντιπροσωπεύουν το 19,9% (ΕΜ) έως 22,1% (ΡΜ) της δοσολογημένης ραδιενέργειας.
Αλληλεπίδραση μεταφορέα: Η λοπεριδόνη και η P88 δεν είναι υποστρώματα της P-gp και η λοπεριδόνη είναι ασθενής αναστολέας της P-gp.
μπλουζα
Μη κλινική τοξικολογία
Καρκινογένεση, Μεταλλαξογένεση, Βλάβη της Γονιμότητας
Καρκινογένεση: Διεξήχθησαν μελέτες καρκινογένεσης σε όλη τη ζωή σε CD-1 ποντικούς και αρουραίους Sprague Dawley. Η ελοπεριδόνη χορηγήθηκε από του στόματος σε δόσεις των 2,5, 5,0 και 10 mg / kg / ημέρα σε CD-1 ποντίκια και 4, 8 και 16 mg / kg / ημέρα Οι αρουραίοι Sprague Dawley (0,5, 1,0 και 2,0 φορές και 1,6, 3,2 και 6,5 φορές αντίστοιχα, το MRHD 24 mg / ημέρα σε mg / m2 βάση). Υπήρξε αυξημένη συχνότητα εμφάνισης κακοήθων όγκων μαστικού αδένα σε θηλυκά ποντίκια που έλαβαν τη χαμηλότερη δόση (2,5 mg / kg / ημέρα) μόνο. Δεν παρατηρήθηκαν αυξήσεις στη νεοπλασία σε αρουραίους.
Το καρκινογόνο δυναμικό του μεταβολίτη της λοπεριδόνης P95, ο οποίος αποτελεί μείζον κυκλοφορούντα μεταβολίτη της λοπεριδόνης στους ανθρώπους, αλλά δεν υπάρχει σε σημαντικές ποσότητες σε ποντικούς ή αρουραίοι Wistar σε δόσεις 25, 75 και 200 mg / kg / ημέρα σε άνδρες και 50, 150 και 250 (μειωμένες από 400) mg / kg / ημέρα σε αρουραίους θηλυκά. Οι σχετιζόμενες με το φάρμακο νεοπλασματικές μεταβολές εμφανίστηκαν σε αρσενικά, στον αδένα της υπόφυσης (αδένωμα pars distalis) σε όλες τις δόσεις και στο πάγκρεας (αδένωμα κυττάρων νησιδίων) στην υψηλή δόση. Τα επίπεδα πλάσματος του P95 (AUC) σε άνδρες στις δοκιμαζόμενες δόσεις (25, 75 και 200 mg / kg / ημέρα) ήταν περίπου 0,4, 3 και 23 φορές, αντίστοιχα, η έκθεση του ανθρώπου στο Ρ95 στο MRHD της λοπεριδόνης.
Μεταλλαξογένεση: Η λοπεριδόνη ήταν αρνητική στη δοκιμασία Ames και σε in vivo δοκιμασίες μυελού των οστών ποντικού και μικροπυρήνων ήπατος αρουραίου. Η λοπεριδόνη προκάλεσε χρωμοσωμικές ανωμαλίες σε κύτταρα ωοθήκης κινέζικου κρικητού (CHO) in vitro σε συγκεντρώσεις που προκάλεσαν επίσης κάποια κυτταροτοξικότητα.
Ο μεταβολίτης P95 της λοπεριδόνης ήταν αρνητικός στη δοκιμή Ames, στη δοκιμασία εκτροπής χρωμοσώματος V79 και σε δοκιμασία μικροπυρήνων in vivo ποντικού μυός των οστών.
Αποτέλεσμα της γονιμότητας: Η λοπεριδόνη μείωσε τη γονιμότητα στα 12 και 36 mg / kg σε μια μελέτη στην οποία υποβλήθηκαν σε αγωγή τόσο αρσενικοί όσο και θηλυκοί αρουραίοι. Η δόση χωρίς επιπτώσεις ήταν 4 mg / kg, η οποία είναι 1,6 φορές η τιμή MRHD των 24 mg / ημέρα σε βάση mg / m2.
μπλουζα
Κλινικές μελέτες
Η αποτελεσματικότητα του FANAPT στη θεραπεία της σχιζοφρένειας υποστηρίχθηκε με 2 εικονικά φάρμακα και ενεργά ελεγχόμενες βραχυχρόνιες (4- και 6-εβδομάδες) δοκιμές και μία μακροχρόνια ελεγχόμενη με εικονικό φάρμακο τυχαιοποιημένη μελέτη δοκιμή απόσυρσης. Όλες οι μελέτες περιλάμβαναν ασθενείς που πληρούσαν τα κριτήρια DSM-III / IV για σχιζοφρένεια.
Χρησιμοποιήθηκαν τρία όργανα για την αξιολόγηση των ψυχιατρικών συμπτωμάτων και συμπτωμάτων σε αυτές τις μελέτες. Η Κλίμακα Θετικού και Αρνητικού Συνδρόμου (PANSS) και η Σύντομη Κλίμακα Ψυχιατρικής Αξιολόγησης (BPRS) είναι και τα δύο αποθέματα πολλών στοιχείων.
της γενικής ψυχοπαθολογίας που συνήθως χρησιμοποιείται για την αξιολόγηση των επιδράσεων της φαρμακευτικής αγωγής στη σχιζοφρένεια. Η αξιολόγηση της κλινικής παγκόσμιας εντύπωσης (CGI) αντικατοπτρίζει την εντύπωση ενός ειδικευμένου παρατηρητή, εξοικειωμένου πλήρως με τις εκδηλώσεις της σχιζοφρένειας, σχετικά με τη συνολική κλινική κατάσταση του ασθενούς.
Μια ελεγχόμενη με εικονικό φάρμακο μελέτη 6 εβδομάδων (n = 706) περιελάμβανε 2 εύκαμπτες δόσεις FANAPT (12-16 mg / ημέρα ή 20-24 mg / ημέρα) σε σύγκριση με το εικονικό φάρμακο και ενεργό μάρτυρα (ρισπεριδόνη). Για την ομάδα 12-16 mg / ημέρα, το πρόγραμμα τιτλοδότησης του FANAPT ήταν 1 mg δύο φορές την ημέρα στις Ημέρες 1 και 2, 2 mg δύο φορές την ημέρα στις Ημέρες 3 και 4, 4 mg δύο φορές την ημέρα στις Ημέρες 5 και 6 και 6 mg δύο φορές καθημερινά την Ημέρα 7. Για την ομάδα 20-24 mg / ημέρα, το πρόγραμμα τιτλοδότησης του FANAPT ήταν 1 mg δύο φορές την ημέρα την ημέρα 1, 2 mg δύο φορές την ημέρα την ημέρα 2, 4 mg δύο φορές την ημέρα την ημέρα 3, 6 mg δύο φορές την ημέρα στις ημέρες 4 και 5, 8 mg δύο φορές την ημέρα την ημέρα 6 και 10 mg δύο φορές την ημέρα την ημέρα 7. Το κύριο τελικό σημείο ήταν αλλαγή από τη βασική γραμμή στο συνολικό σκορ BPRS στο τέλος της θεραπείας (Ημέρα 42). Τόσο οι δόσεις 12-16 mg / ημέρα όσο και οι δόσεις 20-24 mg / ημέρα του FANAPT ήταν ανώτερες από το εικονικό φάρμακο στην συνολική βαθμολογία BPRS. Το δραστικό αντιψυχωτικό φάρμακο ελέγχου φαίνεται να είναι ανώτερο από το FANAPT σε αυτή τη δοκιμή εντός των πρώτων 2 ετών εβδομάδες, ένα εύρημα που μπορεί εν μέρει να εξηγηθεί από την ταχύτερη τιτλοδότηση που ήταν δυνατή γι 'αυτό φάρμακο. Σε ασθενείς της μελέτης αυτής που παρέμειναν σε θεραπεία για τουλάχιστον 2 εβδομάδες, η λοπεριδόνη φαίνεται ότι είχε συγκρίσιμη αποτελεσματικότητα με τον ενεργό έλεγχο.
Μια δοκιμή ελεγχόμενη με εικονικό φάρμακο διάρκειας 4 εβδομάδων (n = 604) περιελάμβανε μια σταθερή δόση FANAPT (24 mg / ημέρα) σε σύγκριση με το εικονικό φάρμακο και ένα ενεργό μάρτυρα (ζιπρασιδόνη). Το πρόγραμμα τιτλοδότησης αυτής της μελέτης ήταν παρόμοιο με αυτό για τη μελέτη 6 εβδομάδων. Η μελέτη αυτή περιελάμβανε τιτλοποίηση του FANAPT ξεκινώντας από 1 mg δύο φορές την ημέρα την ημέρα 1 και αυξάνονταν σε 2, 4, 6, 8, 10 και 12 mg δύο φορές την ημέρα τις ημέρες 2, 3, 4, 5, 6 και 7. Το κύριο τελικό σημείο ήταν η αλλαγή από την αρχική τιμή στην συνολική βαθμολογία PANSS στο τέλος της θεραπείας (Ημέρα 28). Η δόση FANAPT των 24 mg / ημέρα ήταν ανώτερη από το εικονικό φάρμακο στη συνολική βαθμολογία PANSS. Το FANAPT φαίνεται να έχει παρόμοια αποτελεσματικότητα με το δραστικό φάρμακο ελέγχου, το οποίο επίσης χρειάστηκε αργή τιτλοδότηση στη δόση-στόχο.
Σε μια μακροπρόθεσμη δοκιμή, κλινικά σταθεροί ενήλικοι εξωτερικοί ασθενείς (n = 303) που πληρούσαν τα κριτήρια DSM-IV για σχιζοφρένεια που παρέμειναν σταθεροί μετά από 12 εβδομάδες ανοιχτή θεραπεία με εύκαμπτες δόσεις FANAPT (8 mg / ημέρα - 24 mg / ημέρα χορηγούμενες ως δόσεις δύο φορές ημερησίως) τυχαιοποιήθηκαν σε εικονικό φάρμακο ή η τρέχουσα δόση του FANAPT (8 mg / ημέρα - 24 mg / ημέρα χορηγούμενη ως δόσεις δύο φορές ημερησίως) για παρατήρηση για πιθανή υποτροπή κατά τη διάρκεια της διπλά τυφλής υποτροπής φάση πρόληψης. Η σταθεροποίηση κατά τη διάρκεια της ανοιχτής φάσης ορίστηκε ως σταθεροποιημένη δόση του FANAPT που ήταν αμετάβλητη λόγω της αποτελεσματικότητας κατά τις 4 εβδομάδες πριν από την τυχαιοποίηση, με βαθμολογία CGI-βαρύτητας ≤4 και συνολική βαθμολογία PANSS ≤70, βαθμολογία ≤4 για καθένα από τα ακόλουθα μεμονωμένα στοιχεία PANSS (P1-παραληρητικές ιδέες, P2-εννοιολογική αποδιοργάνωση, Συμπεριφορά P3-ψευδαισθήσεων, ύποπτος / διωγμός P6, εχθρότητα P7 ή G8-έλλειψη συνεργασίας) και καμία νοσηλεία ή αύξηση του επιπέδου φροντίδας για θεραπεία εξάρσεων. Η υποτροπή ή η επικείμενη υποτροπή κατά τη διάρκεια της διπλά τυφλής φάσης πρόληψης υποτροπής ορίστηκε ως οποιαδήποτε από τις μετά από: νοσηλεία εξαιτίας της επιδείνωσης της σχιζοφρένειας, αύξηση (επιδείνωση) της συνολικής βαθμολογίας PANSS ≥30%, CGI-
Βαθμός βελτίωσης ≥6, ο ασθενής είχε αυτοκτονική, ανθρωποειδή ή επιθετική συμπεριφορά ή ανάγκη για οποιοδήποτε άλλο αντιψυχωτικό φάρμακο.

Με βάση την ενδιάμεση ανάλυση, μια ανεξάρτητη επιτροπή παρακολούθησης δεδομένων αποφάσισε ότι η μελέτη θα πρέπει να διακοπεί νωρίς λόγω των ενδείξεων αποτελεσματικότητας. Με βάση τα αποτελέσματα της ενδιάμεσης ανάλυσης, τα οποία επιβεβαιώθηκαν από το σύνολο δεδομένων τελικής ανάλυσης, οι ασθενείς που έλαβαν θεραπεία Το FANAPT εμφάνισε στατιστικά σημαντικότερο μεγαλύτερο χρονικό διάστημα υποτροπής ή επικείμενης υποτροπής σε σχέση με τους ασθενείς που έλαβαν εικονικό φάρμακο. Το σχήμα 1 δείχνει την εκτιμώμενη σωρευτική αναλογία ασθενών με υποτροπή ή επικείμενη υποτροπή με βάση το τελικό σύνολο δεδομένων.
μπλουζα
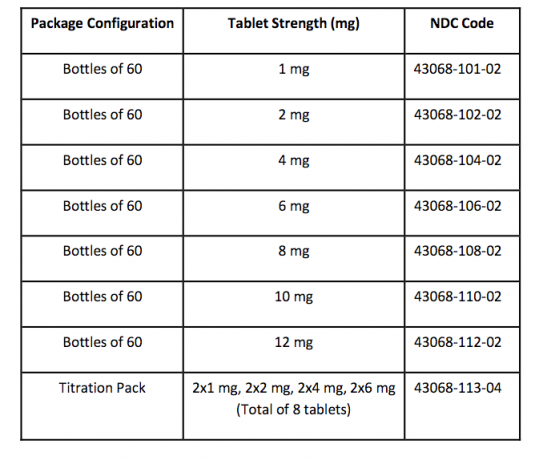
Πώς παρέχεται / αποθήκευση και χειρισμός
Τα δισκία FANAPT είναι λευκά, στρογγυλά και ταυτοποιούνται με λογότυπο που φέρει την ετικέτα στη μία πλευρά και την ένδειξη "1", "2", "4", "6", "8", "10" ή "12" πλευρά. Τα δισκία διατίθενται στις ακόλουθες μορφές δοσολογίας:
Αποθήκευση
Φυλάσσετε τα δισκία FANAPT σε ελεγχόμενη θερμοκρασία δωματίου, 25 ° C (77 ° F). επιτρεπόμενες εκδρομές στους 15 ° έως 30 ° C (59 ° έως 86 ° F) [Βλ. Θερμοκρασία Ελεγχόμενης Χώρας USP]. Προστατεύστε τα δισκία FANAPT από την έκθεση στο φως και την υγρασία.
ΠΛΗΡΟΦΟΡΙΕΣ ΑΣΚΗΣΗΣ ΑΣΘΕΝΕΩΝ
Οι γιατροί συμβουλεύονται να συζητήσουν τα ακόλουθα θέματα με τους ασθενείς για τους οποίους συνταγογραφούν το FANAPT:
Παράταση διαστήματος QT
Οι ασθενείς θα πρέπει να συμβουλεύονται να συμβουλεύονται αμέσως το γιατρό τους εάν αισθάνονται εξασθενημένοι, χάνουν συνείδηση ή έχουν καρδιακή παλμούς. Οι ασθενείς πρέπει να συμβουλεύονται να μην λαμβάνουν το FANAPT με άλλα φάρμακα που προκαλούν παράταση του διαστήματος QT. Οι ασθενείς πρέπει να ενημερώνονται για να ενημερώσουν τους γιατρούς ότι λαμβάνουν το FANAPT πριν από τη λήψη οποιουδήποτε νέου φαρμάκου.
Νευροληπτικό κακόηθες σύνδρομο
Οι ασθενείς και οι φροντιστές θα πρέπει να συμβουλεύονται ότι μερικές φορές αναφέρεται ένα δυνητικά θανατηφόρο σύμπλεγμα συμπτωμάτων ως ΝΜΣ έχει αναφερθεί σε συνδυασμό με τη χορήγηση αντιψυχωτικών φαρμάκων, συμπεριλαμβανομένου του FANAPT. Τα σημεία και τα συμπτώματα των ΝΜΣ περιλαμβάνουν υπερπυρεξία, μυϊκή ακαμψία, αλλοιωμένη ψυχική κατάσταση και στοιχεία αυτονομίας
αστάθεια (ακανόνιστος παλμός ή αρτηριακή πίεση, ταχυκαρδία, διάφαρεση και καρδιακή δυσρυθμία).
Μεταβολικές μεταβολές
Οι ασθενείς θα πρέπει να γνωρίζουν τα συμπτώματα της υπεργλυκαιμίας (υψηλό σάκχαρο στο αίμα) και του σακχαρώδη διαβήτη. Οι ασθενείς που διαγιγνώσκονται με διαβήτη, αυτοί με παράγοντες κινδύνου για διαβήτη ή εκείνοι που αναπτύσσουν αυτά τα συμπτώματα κατά τη διάρκεια της θεραπείας θα πρέπει να παρακολουθούνται με γλυκόζη αίματος στην αρχή και περιοδικά κατά τη διάρκεια της θεραπείας θεραπευτική αγωγή. Οι ασθενείς θα πρέπει να συμβουλεύονται ότι έχει σημειωθεί αύξηση βάρους κατά τη διάρκεια της θεραπείας με το FANAPT. Συνιστάται κλινική παρακολούθηση του βάρους.
Ορθοστατική υπόταση
Οι ασθενείς θα πρέπει να ενημερώνονται για τον κίνδυνο ορθοστατικής υπότασης, ιδιαίτερα κατά την έναρξη της θεραπείας, την εκ νέου έναρξη της θεραπείας ή την αύξηση της δόσης.
Παρεμβολές με τη γνωστική και την κινητική απόδοση
Επειδή το FANAPT μπορεί να έχει τη δυνατότητα να βλάψει την κρίση, τη σκέψη ή τις κινητικές δεξιότητες, οι ασθενείς θα πρέπει να προειδοποιούνται λειτουργούν επικίνδυνα μηχανήματα, συμπεριλαμβανομένων των αυτοκινήτων, μέχρις ότου είναι εύλογα βέβαιοι ότι η θεραπεία με το FANAPT δεν τους επηρεάζει αρνητικά.
Εγκυμοσύνη
Ενημερώστε τους ασθενείς ότι η χρήση του Fanapt μπορεί να προκαλέσει εξωπυραμιδικά και / ή συμπτώματα στέρησης σε νεογνό. Συμβουλεύστε τους ασθενείς να ενημερώνουν τον παροχέα υγειονομικής περίθαλψης τους με γνωστή ή υποψία εγκυμοσύνης.
Μητρώο εγκυμοσύνης
Συμβουλευτείτε τους ασθενείς ότι υπάρχει μητρώο έκθεσης εγκυμοσύνης που παρακολουθεί τα αποτελέσματα της εγκυμοσύνης σε γυναίκες που εκτέθηκαν στο FANAPT κατά τη διάρκεια της εγκυμοσύνης
Γαλουχιά
Συμβουλευτείτε τις γυναίκες να μην θηλάζουν κατά τη διάρκεια της θεραπείας με το FANAPT.
Συγχορηγούμενο φάρμακο
Οι ασθενείς θα πρέπει να ενημερώνονται για να ενημερώσουν τους γιατρούς τους εάν παίρνουν ή σχεδιάζουν να παίρνουν οποιοδήποτε φάρμακο με συνταγή ή υπερβολική δόση, καθώς υπάρχει πιθανότητα αλληλεπιδράσεων.
Αλκοόλ
Οι ασθενείς θα πρέπει να ενημερώνονται για να αποφεύγουν το αλκοόλ ενώ παίρνουν το FANAPT.
Θερμική έκθεση και αφυδάτωση
Οι ασθενείς θα πρέπει να ενημερώνονται για την κατάλληλη φροντίδα για την αποφυγή υπερθέρμανσης και αφυδάτωσης.
Διανεμήθηκαν από:
Η Vanda Pharmaceuticals Inc.
Washington, D.C. 20037 ΗΠΑ
Το Vanda και το Fanapt® είναι σήματα κατατεθέντα της Vanda Pharmaceuticals Inc. στις Ηνωμένες Πολιτείες και σε άλλες χώρες.
Επιστροφή στην κορυφή
Οδηγός συνταγογράφησης Fanapt (Iloperidone) (PDF)
Οι πληροφορίες σε αυτή τη μονογραφία δεν προορίζονται να καλύψουν όλες τις πιθανές χρήσεις, οδηγίες, προφυλάξεις, αλληλεπιδράσεις φαρμάκων ή ανεπιθύμητες ενέργειες. Αυτές οι πληροφορίες είναι γενικευμένες και δεν προορίζονται ως συγκεκριμένες ιατρικές συμβουλές. Εάν έχετε απορίες σχετικά με τα φάρμακα που παίρνετε ή θέλετε περισσότερες πληροφορίες, επικοινωνήστε με το γιατρό σας, το φαρμακοποιό ή τη νοσοκόμα σας.
Τελευταία ενημέρωση 07/13
πίσω στο: Ιστοσελίδα Φαρμακολογίας Ψυχιατρικών Φαρμάκων



